子痫前期(preeclampsia,PE)是导致孕产妇及围产儿死亡的主要原因之一,病因及发病机制未明,是多因素相互作用的结果,其发病的中心环节为血管内皮功能失调和损伤[1-2]。越来越多的研究发现胎盘组织中炎症反应和氧化应激反应可损伤内皮细胞,造成内皮细胞功能紊乱,在PE的发生和发展中发挥了重要作用[3-5]。因此,抑制炎症反应有可能抑制子痫前期的发生和发展。环孢素A(cyclosporin A,CsA)是一种常用免疫抑制剂,广泛应用于器官移植后、妊娠期合并系统性红斑狼疮及再生障碍性贫血等自身免疫疾患,对胎儿生长及发育无明显影响[6-7]。Hu等[7]初步观察到CsA可降低内毒素所致PE大鼠的血压和24 h蛋白尿,并可减少炎性因子的分泌,提示CsA可抑制PE的过度炎性反应状态。但CsA在抑制炎症反应的同时,是否能减轻PE过度的氧化应激反应、改善内皮细胞功能仍未见报道。本研究探讨CsA对PE大鼠外周血淋巴细胞亚群、胎盘氧化应激和一氧化氮含量的影响,旨在为CsA治疗PE的临床应用提供实验依据。
1 材 料 与 方 法
1.1实验动物 3~4月龄的雌性SD大鼠(体重约200 g)30只,雄性SD大鼠(体重约300 g)10只,于室温18~28 ℃、相对湿度40%~70% 的屏障系统内饲养,不控制饲料和水。雌性大鼠与雄性大鼠同笼饲养,观察到阴栓脱落为孕第1天。
1.2药品及试剂 注射用内毒素购自美国Sigma公司,CsA注射用购自美国诺华公司,抗CD4-FITC、抗CD25-APC和抗FoxP3-PE购自美国Immtmotech Coult公司, IL-4、IL-6、TNF-αELISA试剂盒购自南京凯基公司。活性氧(oxygen species,ROS)活性、丙二醛(malondialdehyde,MDA)、一氧化氮检测试剂盒均购自南京建成公司。
1.3实验方法
1.3.1大鼠分组及PE模型的建立 妊娠大鼠(30只)随机分为对照组、模型组及治疗组(每组10只)。PE模型:内毒素按1.0 μg/kg大鼠体重,以生理盐水配置成2 mL,于妊娠第14天,通过尾静脉分别泵入模型组和治疗组大鼠,1 h给药完毕。对照组大鼠同法给予2 mL生理盐水。
1.3.2CsA给药及标本采集 治疗组大鼠分别予孕15、16、17、18 d经腹腔注射CsA注射液。CsA给药剂量为10 mg/kg大鼠体重,生理盐水稀释成1 mL。模型组和对照组大鼠于相同时间腹腔注射1 mL生理盐水。孕20 d,断头处死大鼠,采集母鼠血液5 mL,置入含EDTA的试管备用。取出胎盘和胎鼠,分别称其质量。
1.3.3血压测定 分别于孕14、19 d,应用大鼠尾套无创血压检测仪测定各组大鼠的收缩压,在大鼠呼吸平稳状态下,连续测量3次,取平均值。
1.3.424 h尿蛋白测定 分别于孕14、19 d,分别收集各组大鼠24 h尿液,应用全自动生化分析仪测定大鼠24 h尿蛋白含量。
1.3.5流式细胞术检测大鼠外周血CD4+CD25+FoxP3+Treg细胞/CD4+细胞亚群比值 取大鼠新鲜外周血0.1 mL,分别加入抗CD4-FITC、抗CD25-APC和抗FoxP3-PE,振荡器上混匀,加入红细胞裂解液,避光l5~25 min;PBS洗涤2遍后,离心弃上清液,应用流式细胞仪检测各组组大鼠外周血CD4+CD25+FoxP3+Treg细胞/CD4+细胞亚群比值。
1.3.6外周血炎性因子检测 大鼠外周血3 mL,离心后留血浆,-20 ℃保存备用。采用酶联免疫吸附测定法检测血浆白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、TNF-γ含量,按检测试剂盒说明书操作。应用酶标仪测定OD值,绘制标准曲线,得到标准曲线方程,计算各指标浓度。
1.3.7胎盘组织ROS活性、MDA和一氧化氮含量检测 取适量胎盘组织,用匀浆机充分研磨,4 ℃下以12 000 r/min的速度离心30 min,取上清,-80 ℃ 冰箱保存。实验时取胎盘匀浆液,分别采用硫代巴比妥酸法、光泽精法和硝酸还原酶法测定各组大鼠胎盘组织的ROS活性、MDA和一氧化氮含量,严格按照说明书步骤操作。
1.4统计学方法 应用SPSS 16.0统计学软件分析数据。计量资料比较分别采用配对t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠收缩压和24 h蛋白尿比较 与孕14 d相比,对照组孕19 d收缩压和24 h蛋白尿差异均无统计学意义(P>0.05);模型组和治疗组孕19 d收缩压和24 h蛋白尿则均明显高于孕14 d(P<0.05)。在给予内毒素前(孕14 d),各组大鼠收缩压和24 h蛋白尿差异均无统计学意义(P>0.05)。而孕19 d检测结果显示,模型组、治疗组收缩压和24 h蛋白尿均明显高于对照组(P<0.05);与模型组比较,治疗组收缩压和24 h蛋白尿均明显降低(P<0.05)。见表1。
Table1Comparison of blood pressure and24hoururine protein of the rats in each group
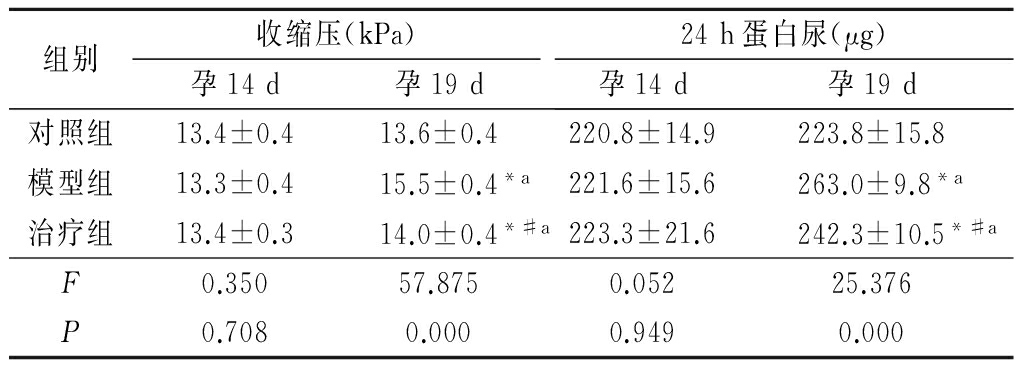
*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验) aP<0.05与孕14 d比较(配对t检验)
2.2各组胎盘质量及胎鼠质量比较 于孕20 d取出胎盘和胎鼠并称其质量,模型组大鼠胎盘和胎鼠质量均明显低于对照组(P<0.05),而治疗组大鼠胎盘和胎鼠质量均明显高于模型组(P<0.05);治疗组与对照组胎盘质量胎鼠质量差异均无统计学意义(P>0.05)。见表2。
Table2Comparison of placenta weight and weightof the fetal rat in each group
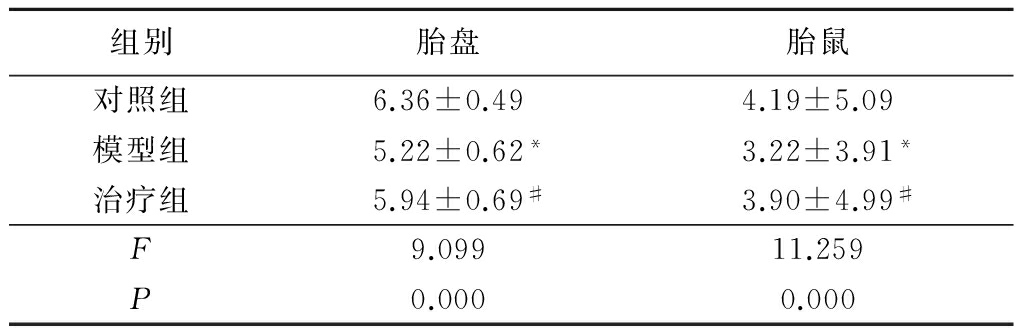
*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验)
2.3各组大鼠外周血T细胞亚群比较 流式细胞术检测结果显示,模型组大鼠外周血CD4+CD25+FoxP3+Treg细胞/CD4+细胞亚群比值低于对照组,而治疗组亚群比值则明显高于模型组,差异有统计学意义(P<0.05),见表3。
Table3Comparison of serum T cell subsetsof the rats in each group
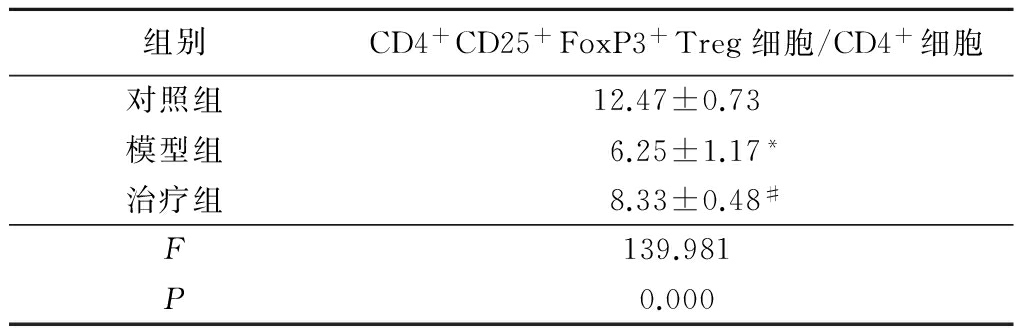
*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验)
2.4各组大鼠外周血炎性因子表达水平比较 孕20 d检测结果显示,模型组大鼠外周血IL-6、TNF-α、TNF-γ均明显高于对照组(P<0.05);与模型组比较,治疗组外周血IL-6、TNF-α、TNF-γ均明显降低(P<0.05)。见表4。
Table4Comparison of serum levels of IL-6,TNF-α and TNF-γ on the20th gestation day
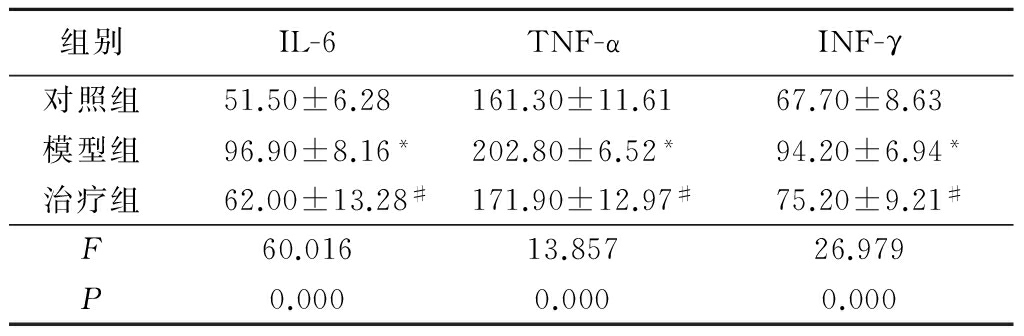
*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验)
2.5各组大鼠胎盘氧化应激指标和一氧化氮含量比较 孕20 d胎盘组织的ROS活性、MDA和一氧化氮含量检测结果显示,与对照组相比,模型组ROS活性和MDA含量明显升高,而一氧化氮含量明显下降(P<0.05);与模型组相比,治疗组ROS活性和MDA含量明显下降, 一氧化氮含量明显升高(P<0.05)。见表5。
Table5Comparison of placenta activity of ROS,MDA and NO levels on the20th gestation day
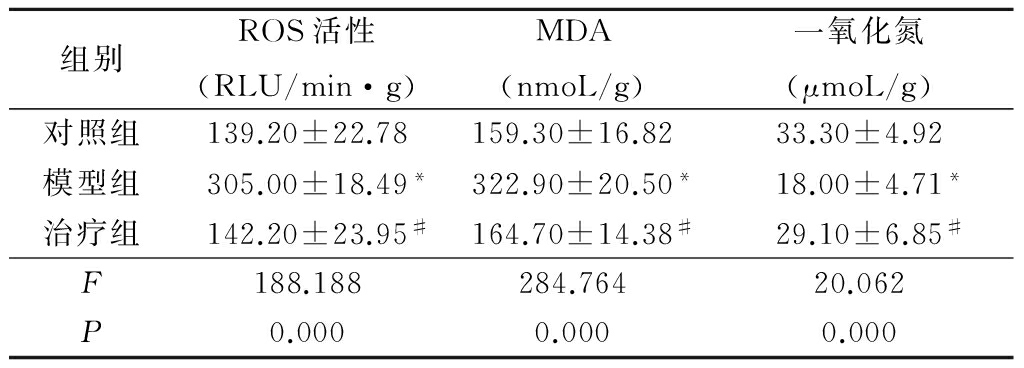
*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验)
3 讨 论
采用小剂量内毒素建立PE大鼠模型是一种得到广泛接受的造模方法[8]。妊娠期大鼠对内毒索较为敏感,小剂量内毒素即可激活大鼠全身炎症反应,导致肾脏及胎盘微血管系统出现类似于PE的组织病理学改变,并导致血压升高和蛋白尿。本研究结果显示,给予小剂量内毒素之前,对照组和模型组大鼠的收缩压和24 h蛋白尿均无明显差别,而给药后孕19 d模型组大鼠的收缩压和24 h蛋白尿均明显高于对照组大鼠。与文献报道一致[8],表明PE大鼠造模成功。
炎症免疫过度激活学说认为,炎症反应在PE的发生发展过程中起了重要作用[3]。PE患者不论胎盘还是全身,均存在着炎症和免疫反应过度激活现象。免疫因素还与其他因素相互作用,共同促进PE的发展。免疫反应可导致母体血管内皮细胞损伤、痉挛及局部缺血,引起血管功能障碍,进而出现PE的各种病理改变。PE患者的外周血和胎盘TNF-α均明显升高,TNF-α刺激更多炎症因子释放,加重内皮损伤[9]。这些研究结果表明抑制炎症免疫反应,有望阻止PE的发展。CsA的主要机制是与细胞浆内的环孢亲和素结合蛋白竞争性结合,阻断IL-2基因活化通路,抑制IL-2、IFN-α和TNF-γ等细胞因子的合成,从而抑制T细胞介导的细胞免疫应答[10]。研究表明,CsA在合适浓度范围内可促进人滋养细胞增殖及侵袭,可能对妊娠有保护作用[11]。IL-6、TNF-α、TNF-γ在PE的病理生理中发挥了重要作用[3,5]。Hu等[7]研究发现,CsA可降低内毒素所致PE大鼠的IL-6、TNF-α、TNF-γ水平。本研究也得到了类似结果。此外,本研究更进一步发现,CsA可升高PE大鼠外周血的CD4+CD25+FoxP3+Treg 细胞/CD4+细胞亚群比值。CD4+CD25+FoxP3+Treg细胞是下调免疫反应的调节性T细胞,可以抑制效应细胞的增殖和免疫活性,其活性增强有益于炎症的转归。成功妊娠的维持表明母体处于免疫耐受状态,故CD4+CD25+FoxP3+Treg细胞对人类妊娠有着重要的影响,是维持妊娠母体免疫耐受所必需的[12]。PE患者T淋巴细胞被激活并伴随着Treg细胞减少,可能打破母胎之间的免疫耐受[13]。本研究中,CsA升高CD4+CD25+FoxP3+Treg细胞/CD4+细胞亚群比值。提示CsA在诱导PE大鼠重获免疫耐受、抑制免疫反应方面具有重要意义。
氧化应激损伤是公认的PE发生发展的重要因素之一[4]。炎症反应不仅直接损伤内皮功能,还可激活氧化应激。正常妊娠时,机体氧化/抗氧化物质水平处于动态平衡状态。PE患者胎盘局部组织中氧化应激反应激活过度,超氧阴离子、过氧化氢等氧自由基生成过多。内皮细胞产生大量ROS,启动脂质过氧化过程,进一步使内皮细胞发生氧化反应并破坏细胞结构、损伤内皮细胞功能[4,14]。胎盘组织中大量产生的ROS在介导氧化应激反应的同时,也会导致中性粒细胞在局部组织的进入并释放多种细胞因子,引起炎症反应的激活和级联放大。可见炎症反应和氧化应激是PE发生发展中互相促进的2个因素。MDA是胎盘组织中滋养细胞,内皮细胞发生氧化损伤后,细胞结构中的脂质成分被氧化所形成的物质,能够反映氧化损伤的程度[15]。本研究中治疗组大鼠胎盘组织中的ROS和MDA水平较模型组明显降低。表明CsA可抑制PE大鼠胎盘的氧化应激反应。一氧化氮是体内最重要的内皮细胞释放因子之一,具有松弛血管平滑肌、舒张血管、抑制血小板聚集等作用,与PE的发生发展密切相关。PE患者一氧化氮水平低于正常孕妇,其原因在于患者的血管内皮细胞受损,产生一氧化氮的酶活性受到抑制,一氧化氮合成减少[16]。本研究发现,CsA治疗后,PE大鼠胎盘的一氧化氮含量明显升高。说明CsA在降低氧化应激的同时,可有效改善PE胎盘的内皮功能。
综上所述,CsA可缓解内毒素所致PE大鼠的高血压和蛋白尿,其机制可能与CsA抑制PE大鼠的炎症反应和氧化应激并提高胎盘一氧化氮含量有关。CsA有望用于治疗PE,但实验结果和具体用法尚需在人体上进一步研究探讨。
[参考文献]
[1] Trifonova EA,Gabidulina TV,Ershov NI,et al. Analysis of the placental tissue transcriptome of normal and preeclampsia complicated pregnancies[J]. Acta Naturae,2014,6(2):71-83.
[2] 史丽,赵喜娃,赵艳玲,等.不良孕产史与子痫前期发病关系的研究[J].河北医科大学学报,2014,35(12):1379-1381.
[3] Harmon AC,Cornelius DC,Am aral LM,et al. The role of inflammation in the pathology of preeclampsia[J]. Clin Sci(Lond),2016,130(6):409-419.
[4] 周小波,石书明,张华,等.线粒体自噬受损引起的ROS清除障碍导致子痫前期患者滋养细胞过度凋亡[J].重庆医科大学学报,2017,42(3):315-318.
[5] 李书平,蒋学莲.炎症反应与子痫前期进展的临床相关性[J].实用临床医药杂志,2014,18(7):147-148,151.
[6] 林丽娟,陈兴强,吴琳虹,等.环孢素A与环磷酰胺联合激素治疗难治性肾病综合征的疗效比较[J].河北医科大学学报,2015,36(3):320-332.
[7] Hu B,Yang J,Huang Q,et al. Cyclosporin A significantly improves preeclampsia signs and suppresses inflammation in a rat model[J]. Cytokine,2016,81:77-81.
[8] 李静,唐卉.低剂量内毒素诱导构建子痫前期大鼠模型[J].山东医药,2014,54(19):26-28.
[9] Shaw J,Tang Z,Schneider H,et al. Inflammatory processes are specifically enhanced in endothelial cells by placental-derived TNF-α:Implications in preeclampsia(PE) [J]. Placenta,2016,43:1-8.
[10] 杨燕宁,朱伽月,宋秀胜,等.环孢素A临床应用的研究进展[J].国际眼科杂志,2017,17(3):463-466.
[11] 张瑾,张建华,赵欣媛.山奈酚联合环孢素A抑制人滋养细胞氧化应激损伤的研究[J].中国医药导报,2016,13(7):24-27.
[12] 王宁,姜凤良.Th1/Th2,Th17/Treg细胞与母胎免疫耐受和病理妊娠[J].中国免疫学杂志,2016,32(1):136-139.
[13] 袁靖中,周强,杨凯,等.子痫前期患者血清Treg细胞含量及超氧化物歧化酶水平变化的临床意义[J].国际检验医学杂志,2017,38(9):1196-1197.
[14] Almasry SM,Elfayomy AK,Hashem HE. Ultra structure and histomorphometric analysis of human umbilical cord vessels in preeclampsia:a potential role of VEGF,VEGFR-1 and VEGFR-2[J]. Rom J Morphol Embryol,2016,57(2 Supp1):681-689.
[15] Lim R,Acharya R,Delpachitra P,et al. Activin and NADPH-oxidase in preeclampsia: insights from in vitro and murine studies[J]. Am J Obstet Gynecol,2015,212(1):1-12.
[16] Sircar M,Thadhani R,Karumanchi SA. Pathogenesis of preeclampsia[J]. Curr Opin Nephrol Hypertens,2015,24(2):131-138.