血管性痴呆(vascular dementia,VD)是仅次于阿尔茨海默病(Alzheimer disease,AD)第二常见的痴呆类型[1-3]。VD患者的持续和不可逆的记忆损伤会导致生活质量的严重恶化并给患者的家庭带来沉重的经济负担[4-5]。在人口老龄化的国家,预防和治疗VD的重要性日益增加。因此,寻找有效药物治疗VD引起了越来越多学者们的研究兴趣。白藜芦醇是一种天然的酚类化合物,在红葡萄表皮和红酒中富集,在虎杖中也大量存在。大量研究证实了白藜芦醇具有许多药理学作用,包括抗氧化、抗凋亡、抗癌症及抗炎等特性[6-8],其对于认知功能同样具有明显的改善作用[9]。脑慢性低灌注被认为是轻度认知损伤、AD和VD重要的潜在病理因素。本研究采用双侧颈总动脉结扎(bilateral common carotid arteryocclusion/two-vessel occlusion,BCCAO)法制作VD模型,通过水迷宫试验检测大鼠认知功能的变化并评价白藜芦醇对VD大鼠的治疗效果,采用免疫印记法检测大鼠海马部位PSD95、SYN的表达,从而研究其潜在的作用机制。
1 材 料 与 方 法
1.1 实验动物分组 选取雄性健康无特定病原体级SD大鼠45只,体重220~260 g,由天津医科大学实验动物中心提供。动物饲养在屏障环境内,动物房环境噪音低于60 dB,室温控制在20~25 ℃,相对湿度40%~60%,给予动物12 h光照/12 h黑暗交替的环境。所有动物自由获取食物与饮用水。所有动物操作均严格遵守天津市环湖医院关于动物实验操作规范的相关规定。将45只SD大鼠按随机数字表法分为3组:对照组、VD组和治疗组,每组大鼠15只。VD组和治疗组大鼠采用BCCAO法制作VD模型,对照组给予同样的麻醉和操作处理,但不闭塞双侧颈总动脉。造模后1周,治疗组大鼠给予50 mg/kg(10 mL/kg)白藜芦醇腹腔注射治疗,1次/d,连续治疗6周。对照组和VD组大鼠每日给予等量生理盐水腹腔注射。
1.2 实验仪器及主要试剂 Morris水迷宫(中国医学科学院药物所);白藜芦醇(Sigma公司),β-actin抗体、PSD95、SYN抗体(Abcam公司)。
1.3 大鼠认知功能检测 白藜芦醇治疗4周后行水迷宫试验检测各组大鼠空间学习记忆能力。水迷宫水池壁高为50 cm,水深为40 cm,水温维持在20~24 ℃,水池直径为150 cm。在水迷宫的目标象限正中心位置放置一直径为10 cm的水下隐性平台,平台上表面位于水下1 cm处。前5 d进行定位航行试验, 每天4次,每次从不同入水点放入大鼠。每只大鼠面朝水池壁放入池中,记录逃避潜伏期,即大鼠寻找平台的时间。若大鼠2 min内未到达水下平台,则将大鼠小心引导至平台上,并让其逗留15 s,120 s则为该大鼠逃避潜伏期时间。第6天,撤去水下平台,记录每组大鼠穿越平台次数。
1.4 海马PSD95、SYN蛋白检测 行为学试验结束后,每组大鼠随机挑选5只(采用随机数字表方法),每只大鼠麻醉后提取海马备用,RIPA进行蛋白裂解(冰30 min),匀浆在4 ℃条件下使用离心机离心5 min(14 000 r/min),随后测定蛋白浓度(BCA法)。取裂解液用10%SDS聚丙烯酰胺凝胶室温下电泳(3 h),随后转膜,再TTBS处理1 h。再与如下抗体相结合:β-actin抗体 (浓度1∶2 000)、抗PSD95抗体(1∶2 000)、抗SYN抗体(1∶2 000),4 ℃过夜。洗膜,然后用二抗孵育,室温下1 h。最后红外成像系统进行曝光显影。PSD95、SYN蛋白与β-actin的IOD值比值作为其相对蛋白表达量。
1.5 统计学方法 应用SPSS 17.0统计软件处理数据。计量资料比较分别采用单因素方差分析和LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Morris水迷宫试验检测大鼠认知功能 与对照组比较,VD组大鼠逃避潜伏期明显延长,穿越平台的次数明显减少,差异均有统计学意义(P<0.05);治疗组大鼠逃避潜伏期较VD组明显缩短,但仍长于对照组,差异均有统计学意义(P<0.05);治疗组大鼠穿越平台次数较VD组明显增加,但仍少于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 白藜芦醇治疗对VD大鼠认知功能的影响
Table 1 The effect of resveratrol on cognitivefunction in VD rats ![]()
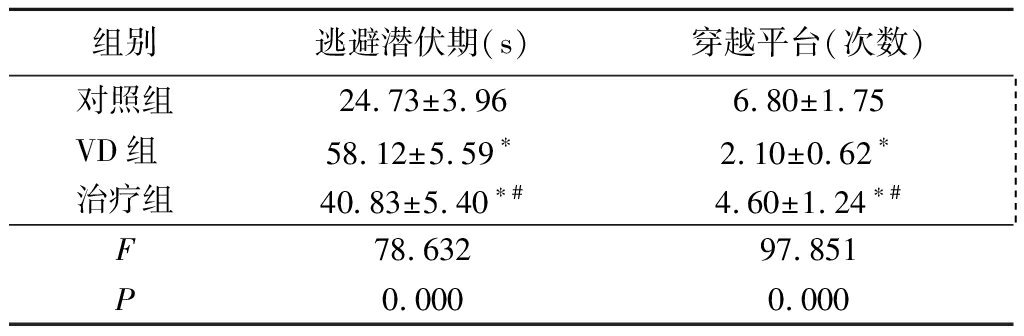
*P<0.05与对照组比较 #P<0.05与模型组比较(LSD-t检验)
2.2 Western blot检测大鼠海马PSD95和SYN的表达 VD组大鼠海马PSD95和SYN的表达较对照组明显减少,差异均有统计学意义(P<0.05);治疗组大鼠海马PSD95和SYN的表达较VD组明显增多,但仍低于对照组,差异均有统计学意义(P<0.05)。见表2,图1。
表2 各组大鼠海马PSD95、SYN蛋白的表达
Table 2 The protein expression of hippocampalPSD95 and SYN in different groups ![]()
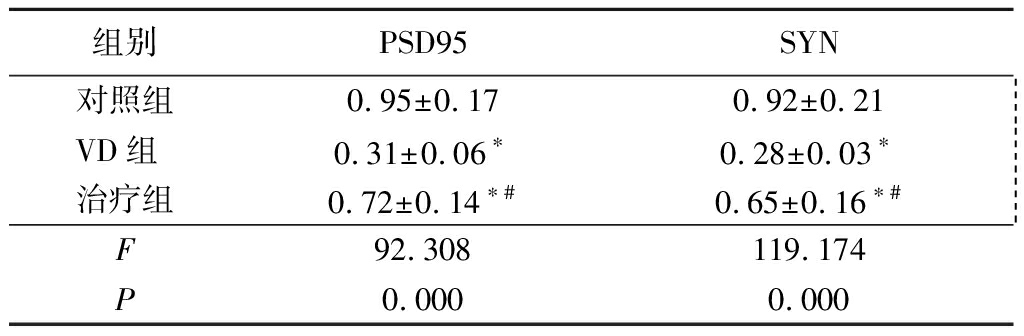
*P<0.05与对照组比较 #P<0.05与VD组比较(LSD-t检验)
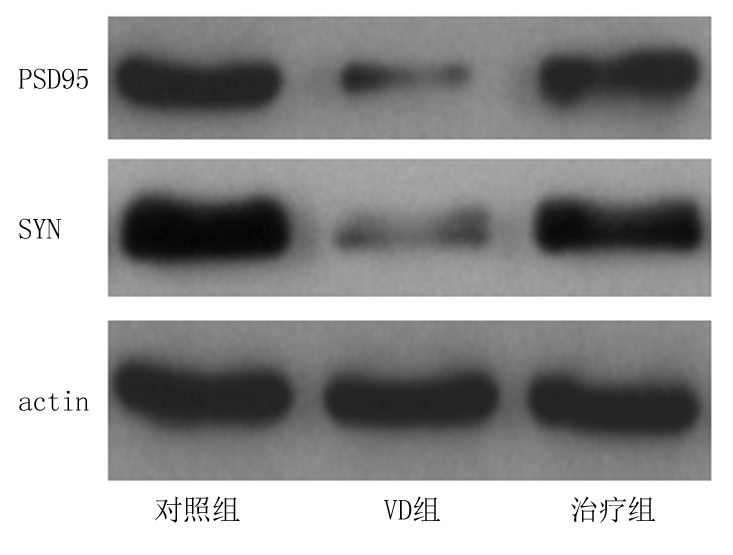
图1 各组大鼠海马PSD95、SYN蛋白的表达
Figure 1 The protein expression of hippocampal PSD95 and SYN in different groups
3 讨 论
VD是由脑血管疾病引起的,表现为记忆、行为和认知障碍的一类综合征[10-11]。所有类型痴呆的病理均是相同的,并且痴呆进展的根本原因均是神经退化[12-13]。越来越多的证据表明, AD和VD是大多数痴呆病例的主要原因,尤其是在老年人群中。VD是老年人痴呆的第二常见的病因,仅次于AD。高血压、糖尿病、高胆固醇血症和高同型半胱氨酸血症是VD的重要风险因素,随着人口老龄化和生活水平的不断提高,VD的发病率也在逐渐上升。然而,目前对于VD的临床治疗仍没有一种特效的方法。
很多植物提取物具有明显的治疗特性。这些化合物对抗神经退化的生物活性主要是由于它们的抗氧化和抗淀粉样蛋白沉积的作用[12-14]。白藜芦醇是一种天然存在的多酚类物质,在许多可食用植物的表皮中存在,可有效对抗真菌感染。白藜芦醇的有益作用是通过多种途径实现的,这些途径包括控制炎症、抗氧化应激、保护线粒体功能和抑制细胞凋亡等[15-17]。 白藜芦醇已被证实能改善各种类型中枢神经系统损伤的组织病理学和行为学结果,包括卒中、创伤性脑损伤、蛛网膜下腔出血和脊髓损伤等[18-20]。虽然VD的确切机制尚不清楚,但大脑慢性低灌注被认为是VD的主要潜在发病机制。 BCCAO能够很好地模拟出大鼠脑慢性低灌注状态,故BCCAO是研究VD相关机制与治疗方案较为理想的模型[21]。本研究结果显示,BCCAO法诱导的VD大鼠的认知功能出现了明显的下降,经过6周的白藜芦醇治疗后,VD大鼠的认知功能得到了明显的改善。表明BCCAO法导致大鼠认知功能出现明显障碍,而白藜芦醇对于VD大鼠认知功能损伤具有良好的调节作用。
突触可塑性长期以来被认为是认知的神经生物学基础。各种系统性研究发现,整合的分子机制和记忆的长期储存均是在突触的水平上开始的[22]。现有的蛋白质被修饰,信号传送回细胞核从而导致特定的基因表达,基因产物被运送回突触,触发新的蛋白质的局部合成,进而促使突触重构、添加和消除[23]。在中枢神经系统中,突触的结构、数量和功能状态与学习和记忆输出密切相关[24-26]。突触可塑性在VD中同样起到了重要作用,神经突触的损伤发生在VD的早期阶段,其损伤程度与认知功能受损程度有关。有研究表明,在VD动物模型中,突触可塑性的损害与VD认知功能的下降密切相关[27-28]。在所有的脑区中,海马的突触结构和分子组成在学习和记忆中起到了至关重要的作用。
突触形态结构和传递功能的改变与神经递质、受体和蛋白质在神经元和突触中的改变有关。突触可塑性相关的结构物质被认为是有助于隐性和显性记忆巩固的一种细胞变化[23]。突触标志物的变化可以反映形态可塑性的变化。PSD-95是位于兴奋性突触后致密物质中的一种丰富的支架蛋白质,是突触后信号复合物的中心组织者,包括谷氨酸受体、离子通道、信号酶和附着蛋白[29]。PSD95具有重要的功能,它控制着突触传递、突触可塑性、学习和记忆[30]。PSD95复合体在精神分裂症、自闭症和智力障碍中发生了突变。有研究证实,PSD95与NMDA受体子单元相互作用,参与信息存储过程[31],而PSD95表达的增多可以促使突触活性的增加。SYN是最丰富的突触前囊膜跨膜蛋白,位于突触前膜,已被广泛用于研究突触功能学。SYN调节突触前小泡蛋白的释放及突触密度的信号。有研究显示,SYN的表达和分布可以间接反映出突触的密度[32]。 海马体是与认知相关的最重要的大脑区域之一,也被认为是最易受内外变化影响的区域。海马突触可塑性在学习和记忆以及神经退化性疾病的发展过程中扮演着重要的角色。本研究结果显示,BCCAO法诱导的VD大鼠海马突触可塑性相关蛋白SYN和PSD95的表达明显减少,白藜芦醇治疗后海马SYN和PSD95的表达明显增多。表明白藜芦醇治疗改善VD大鼠认知功能可能是通过改善海马突触可塑性实现的。
综上所述,白藜芦醇治疗可明显改善VD大鼠认知功能障碍,增加VD大鼠海马突触可塑性相关蛋白SYN和PSD95的表达,其发挥神经保护作用的机制可能与改善受损的突触可塑性密切相关。本研究为VD及各种类型痴呆的有效治疗提供了更多的理论支持。
[参考文献]
[1] Reijmer YD,van Veluw SJ,Greenberg SM. Ischemic brain injury in cerebral amyloid angiopathy[J]. J Cereb Blood Flow Metab,2016,36(1):40-54.
[2] Sinclair LI,Tayler HM,Love S. Synaptic protein levels altered in vascular dementia[J]. Neuropathol Appl Neurobiol,2015,41(4):533-543.
[3] Thomas T,Miners S,Love S. Post-mortem assessment of hypoperfusion of cerebral cortex in Alzheimer′s disease and vascular dementia[J]. Brain,2015,138(Pt 4):1059-1069.
[4] Barker R,Ashby EL,Wellington D,et al. Pathophysiology of white matter perfusion in Alzheimer′s disease and vascular dementia[J]. Brain,2014,137(Pt 5):1524-1532.
[5] Brandenburg S,Müller A,Turkowski K,et al. Resident microglia rather than peripheral macrophages promote vascularization in brain tumors and are source of alternative pro-angiogenic factors[J]. Acta Neuropathol,2016,131(3):365-378.
[6] Malhotra A,Bath S,Elbarbry F. An organ system approach to explore the antioxidative,anti-inflammatory,and cytoprotective actions of resveratrol[J]. Oxid Med Cell Longev,2015,2015:803971.
[7] Singh N,Agrawal M,Doré S. Neuroprotective properties and mechanisms of resveratrol in in vitro and in vivo experimental cerebral stroke models[J]. ACS Chem Neurosci,2013, 4(8):1151-1162.
[8] Liu FC,Tsai HI,Yu HP. Organ-protective effects of red wine extract,resveratrol,in oxidative stress-mediated reperfusion injury[J]. Oxid Med Cell Longev,2015,2015:568634.
[9] Ma T,Tan MS,Yu JT,et al. Resveratrol as a therapeutic agent for Alzheimer′s disease[J]. Biomed Res Int,2014,2014:350516.
[10] Oliveira NR,Marques SO,Luciano TF,et al. Treadmill training increases SIRT-1 and PGC-1αprotein levels and AMPK phosphorylation in quadriceps of middle-aged rats in an intensity-dependent manner[J]. Mediators Inflamm,2014,2014:987017.
[11] Szal rdy L,Z
rdy L,Z dori D,Klivényi P,et al. Electron transport disturbances and neurodegeneration:From Albert Szent-Györgyi′s Concept(Szeged) till novel approaches to boost mitochondrial bioenergetics[J]. Oxid Med Cell Longev,2015,2015:498401.
dori D,Klivényi P,et al. Electron transport disturbances and neurodegeneration:From Albert Szent-Györgyi′s Concept(Szeged) till novel approaches to boost mitochondrial bioenergetics[J]. Oxid Med Cell Longev,2015,2015:498401.
[12] Pérez-Hern ndez J,Zaldívar-Machorro VJ,Villanueva-Porras D,et al. A potential alternative against neurodegenerative diseases:phytodrugs[J]. Oxid Med Cell Longev,2016,2016:8378613.
ndez J,Zaldívar-Machorro VJ,Villanueva-Porras D,et al. A potential alternative against neurodegenerative diseases:phytodrugs[J]. Oxid Med Cell Longev,2016,2016:8378613.
[13] Fischer R,Maier O. Interrelation of oxidative stress and inflammation in neurodegenerative disease:role of TNF[J]. Oxid Med Cell Longev,2015,2015:610813.
[14] You SP,Zhao J,Ma L,et al. Preventive effects of phenylethanol glycosides from Cistanche tubulosa on bovine serum albumin-induced hepatic fibrosis in rats[J]. Daru,2015,23:52.
[15] Rege SD,Kumar S,Wilson DN,et al. Resveratrol protects the brain of obese mice from oxidative damage[J]. Oxid Med Cell Longev,2013,2013:419092.
[16] Lin CJ,Chen TH,Yang LY,et al. Resveratrol protects astrocytes against traumatic brain injury through inhibiting apoptotic and autophagic cell death[J]. Cell Death Dis,2014,5:e1147.
[17] Girbovan C,Plamondon H. Resveratrol downregulates type-1 glutamate transporter expression and microglia activation in the hippocampus following cerebral ischemia reperfusion in rats[J]. Brain Res,2015,1608:203-214.
[18] Girbovan C,Morin L,Plamondon H. Repeated resveratrol administration confers lasting protection against neuronal damage but induces dose-related alterations of behavioral impairments after global ischemia[J]. Behav Pharmacol,2012,23(1):1-13.
[19] Shao AW,Wu HJ,Chen S,et al. Resveratrol attenuates early brain injury after subarachnoid hemorrhage through inhibition of NF-κB--dependent inflammatory/MMP-9 pathway[J]. CNS Neurosci Ther,2014,20(2):182-185.
[20] Ates O,Cayli S,Altinoz E,et al. Effects of resveratrol and methylprednisolone on biochemical,neurobehavioral and histopathological recovery after experimental spinal cord injury[J]. Acta Pharmacol Sin,2006,27(10):1317-1325.
[21] Li YW,Li QY,Wang JH,et al. Contribution of p38 MAPK to the Ameliorating effect of enriched environment on the cognitive deficitsinduced by chronic cerebral hypoperfusion[J]. Cell Physiol Biochem,2016,40(3/4):549-557.
[22] Bailey CH,Kandel ER,Harris KM. Structural Components of Synaptic Plasticity and Memory Consolidation[J]. Cold Spring Harb Perspect Biol,2015,7(7):a021758.
[23] Bourne JN,Harris KM. Nanoscale analysis of structural synaptic plasticity[J]. Curr Opin Neurobiol,2012,22(3):372-382.
[24] Li H,Xin X. Nitrogen dioxide(NO(2)) pollution as a potential risk factor for developing vascular dementia and its synaptic mechanisms[J]. Chemosphere,2013,92(1):52-58.
[25] Zhang N,Xing M,Wang Y,et al. Hydroxysafflor yellow A improves learning and memory in a rat model of vascular dementia by increasing VEGF and NR1 in the hippocampus[J]. Neurosci Bull,2014,30(3):417-424.
[26] Dong Y,Wu X,Zhang G,et al. Isoflurane facilitates synaptic NMDA receptor endocytosis in mice primary neurons[J]. Curr Mol Med,2013,13(4):488-498.
[27] Wang F,Chang GM,Yu Q,et al. The neuroprotection of repetitive transcranial magnetic stimulation pre-treatment in vascular dementia rats[J]. J Mol Neurosci,2015,56(1):198-204.
[28] Dong J,Zhao J,Lin Y,et al. Exercise improves recognition memory and synaptic plasticity in the prefrontal cortex for rats modelling vascular dementia[J]. Neurol Res,2018,40(1):68-77.
[29] Fern ndez E,Collins MO,Uren RT,et al. Targeted tandem affinity purification of PSD-95 recovers core postsynaptic complexes and schizophrenia susceptibility proteins[J]. Mol Syst Biol,2009,5:269.
ndez E,Collins MO,Uren RT,et al. Targeted tandem affinity purification of PSD-95 recovers core postsynaptic complexes and schizophrenia susceptibility proteins[J]. Mol Syst Biol,2009,5:269.
[30] Nithianantharajah J,Komiyama NH,McKechanie A,et al. Synaptic scaffold evolution generated components of vertebrate cognitive complexity[J]. Nat Neurosci, 2013,16(1):16-24.
[31] Purcell SM,Moran JL,Fromer M,et al. A polygenic burden of rare disruptive mutations in schizophrenia[J]. Nature,2014,506(7487):185-190.
[32] Gardoni F,Marcello E,Di Luca M. Postsynaptic density-membrane associated guanylate kinase proteins(PSD-MAGUKs) and their role in CNS disorders[J]. Neuroscience,2009,158(1):324-333.