肝癌为我国最常见的恶性肿瘤之一,其病死率为肿瘤相关性疾病中第3位。我国为乙型肝炎大国,约95%肝癌患者为乙型肝炎病毒(hepatitis B virus,HBV)感染伴或不伴肝纤维化[1]。目前对肝癌的治疗有多种方法,如动脉化疗栓塞、肝射频消融术、分子靶向治疗、肝部分切除术等,手术治疗仍是肝癌患者的主要治疗方法[2]。但围手术期及术后易发生肝衰竭已成为乙型肝炎肝癌患者围手术期死亡的主要原因。研究表明,肝硬化是肝切除术患者出现严重肝衰竭及死亡的一项独立危险因素[3]。究其原因可能为肝硬化后肝脏储备功能下降,行肝切除术后患者残存肝脏体积不足,肝功能不能满足机体所需而出现肝衰竭,严重者则出现死亡[4]。目前针对有无肝硬化肝癌患者围手术期肝衰竭等并发症的研究较少。本研究回顾性对比分析乙型肝炎相关肝硬化肝癌与无肝硬化肝癌患者相关临床资料,旨在探讨患者围术期情况及肝衰竭危险因素。
1 资 料 与 方 法
1.1 一般资料 选择2016年1月—2017年4月在我院住院行肝癌切除术的乙型肝炎患者160例,根据有无合并肝硬化分为2组:乙型肝炎合并肝硬化肝癌患者90例为研究组,男性79例,女性11例,年龄48~70岁,平均(62.3±7.3)岁;乙型肝炎无肝硬化肝癌患者70例为对照组,男性59例,女性11例,年龄50~73岁,平均(60.2±6.9)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
患者均签署知情同意书。
1.2 纳入及排除标准 纳入标准:①乙型肝炎表面抗原(hepatitis B surface antigan,HbsAg)阳性;②Child-Pugh分级均为A或B级,且肝储备功能良好;③术后经病理组织学检查均确诊为肝癌;④肝癌仅侵及周围邻近器官,均无远处转移;⑤心肺功能良好,均能耐受手术;⑥术前均未行动脉化疗栓塞、射频消融术、外科手术切除等治疗。排除标准:①HbsAg阴性;②Child-Pugh分级为C或D级;③术后病理组织学检查证实非肝癌;④有肝外器官转移或侵犯,或同期合并其他恶性肿瘤;⑤心肺功能不全或患其他严重疾病,不能耐受手术;⑥术前出现肝癌破裂出血;⑦非肝癌所致的梗阻性黄疸;⑧合并糖尿病、其他肝炎病毒或HIV感染。
1.3 方法 选用全身麻醉,常规消毒、铺巾,在腹部选取倒“T”或反“L”形切口,在腹腔内游离肝周的韧带,根据术前CT、MRI及超声检查明确肿瘤部位、大小、周围血供、与胆管的位置等,根据肿瘤数目、位置、大小、范围、患者一般情况、有无肝硬化等,选择肝脏切除的范围;确定范围后由肝表面开始用电刀及钳夹法切除,根据术中情况用Pringle法行肝门阻断,每次阻断时间最长约15 min,若需要再次阻断应间隔5 min。若围手术期血红蛋白<70 g/L时需输悬浮红细胞治疗。术后将患者送至重症监护室密切监测生命体征,待患者病情平稳后再转至普通病房。肝衰竭标准:术后第5天,总胆红素(total bilirubin,TBil)>50 μmol/L且凝血酶原活动度(prothrombin time activity,PTA)<40%。
1.4 观察指标 ①术中情况(术中出血量、手术时间、肝门阻断率、输血率);②术后情况(并发症发生率、围手术期病死率、术后住院天数);③根据患者年龄、性别、白蛋白(albumin,ALB)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、 丙氨酸转氨酶(alanine aminotransferase,ALT)、TBil、血小板(platelet,PLT)、PTA、Child-Pugh分级、术中出血量、手术时间、肝门阻断、输血、肿瘤数目和直径、肝切除范围及是否合并肝硬化分析乙型肝炎肝癌患者围手术期发生肝衰竭的危险因素。
1.5 统计学方法 应用SPSS 17.0统计学软件处理数据。偏态分布的计量资料比较采用秩和检验;计数资料比较采用χ2检验;危险因素分析采用Logistie回归模型。P<0.05为差异有统计学意义。
2 结 果
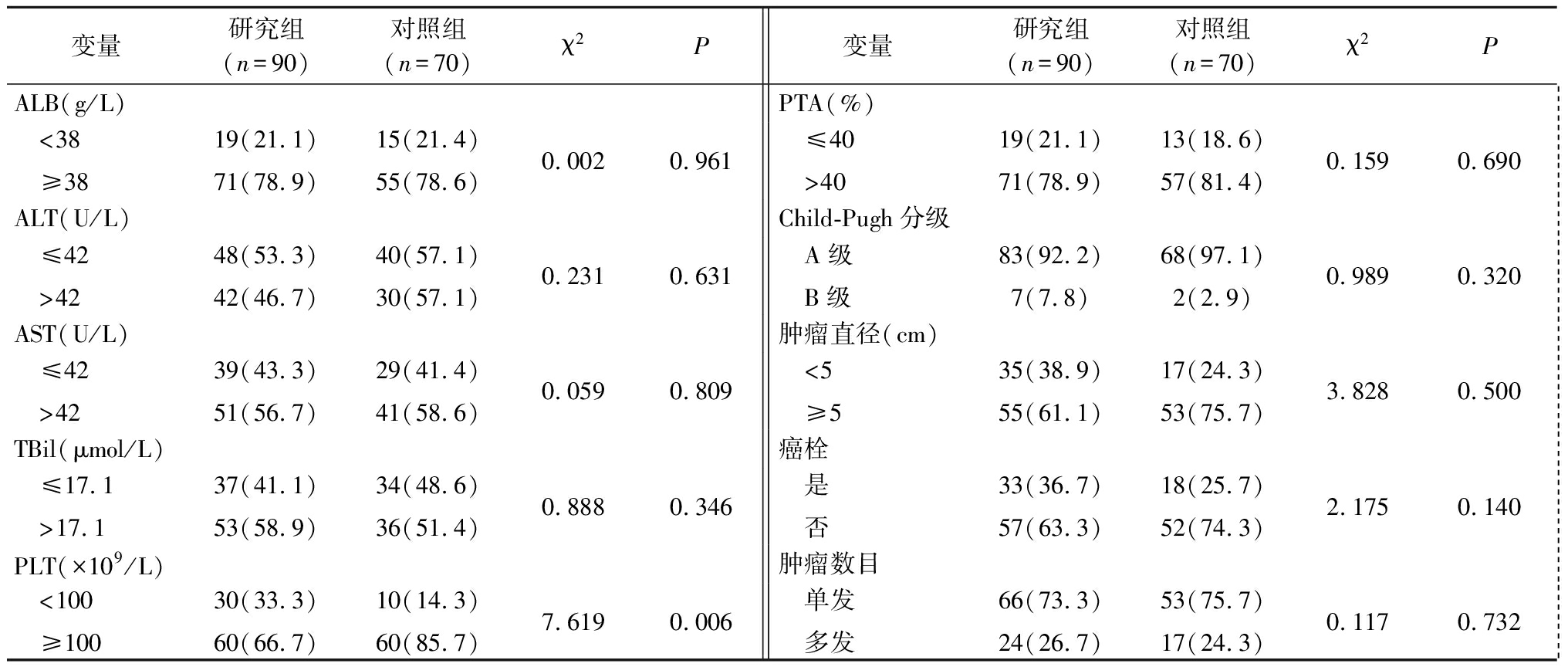
2.1 2组临床资料比较 2组ALB、ALT、AST、TBil、PLT、PTA、Child-Pugh分级、肿瘤直径、有无癌栓及肿瘤数目比较差异均无统计学意义(P>0.05),见表1。
表1 2组临床资料比较
Table 1 Comparison of clinical data between two groups (例数,%)
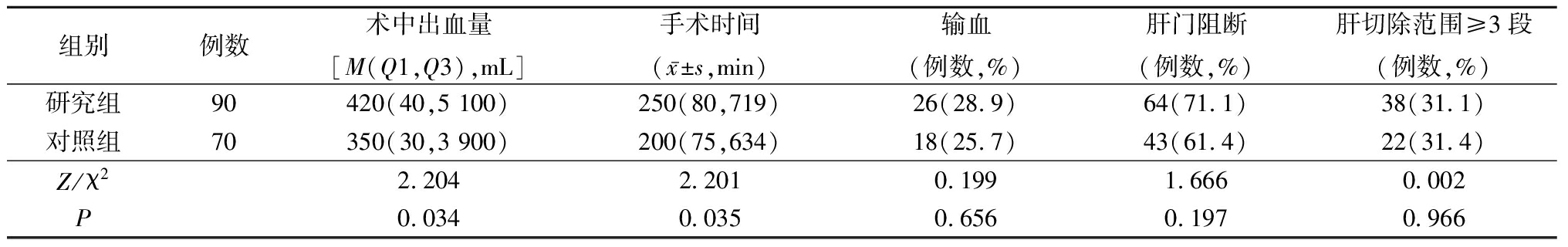
2.2 2组术中情况比较 与对照组比较,研究组患者术中出血量多,手术时间长,差异有统计学意义(P<0.05);2组术中输血率和肝门阻断率差异无统计学意义(P>0.05)。见表2。
表2 2组术中情况比较Table 2 Comparison during surgery between two groups
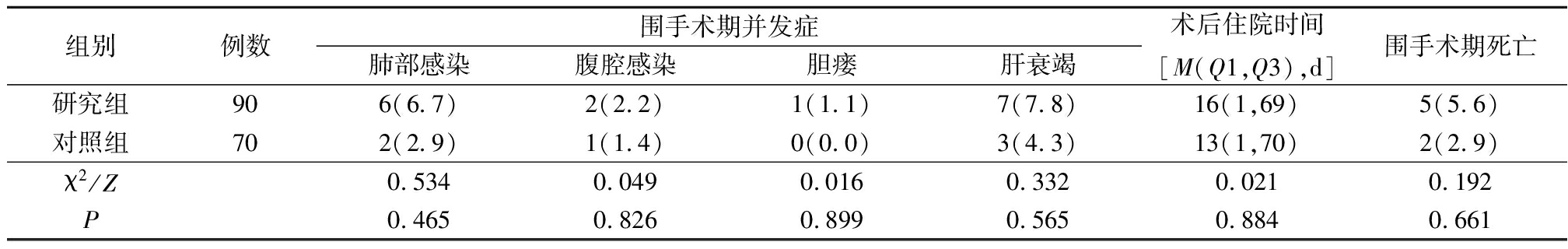
2.3 2组术后情况比较 2组围手术期并发症肺部感染、腹腔感染、胆瘘和肝衰竭发生率以及术后住院时间、围手术期死亡差异均无统计学意义(P>0.05),见表3。
表3 2组术后情况比较
Table 3 Comparison of after surgery between two groups (例数,%)
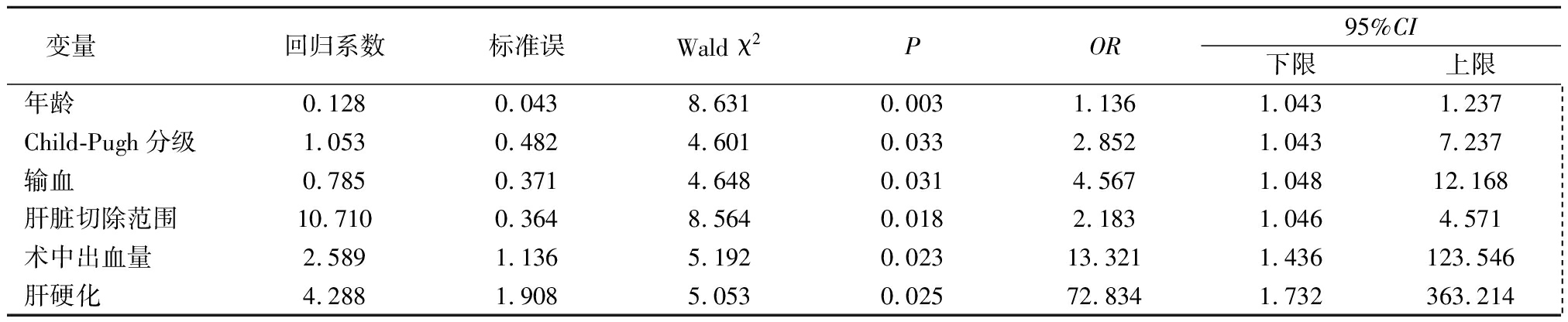
2.4 围手术期发生肝衰竭危险因素分析 160例患者围手术期发生肝衰竭10例,发生率为6.25%,其中7例死亡。以是否发生肝衰竭为因变量,以性别、年龄、ALB、ALT、AST、PTA、Tbil、PLT、Child-Pugh分级、手术时间、术中出血量、输血、肝脏切除范围、肿瘤直径、肝门阻断、肝硬化为自变量进行进行多因素Logistic回归分析,结果显示年龄、Child-Pugh分级、输血、肝脏切除范围、术中出血量、肝硬化为乙型肝炎肝癌患者围手术期发生肝衰竭的危险因素,见表4,5。
表4 赋值表
Table 4 Assignment table
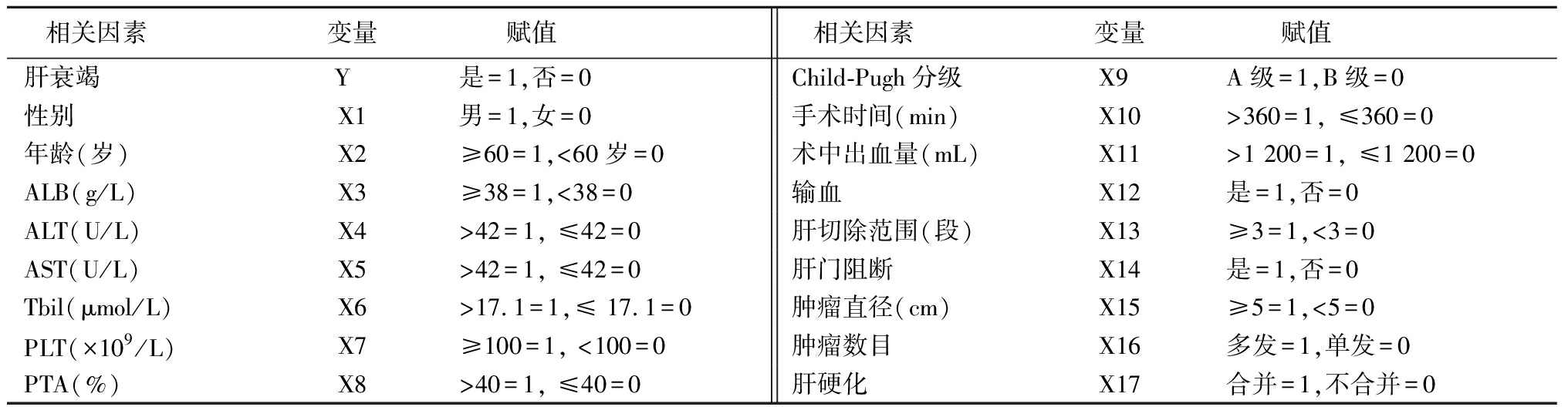
表5 乙型肝炎肝癌患者围手术期发生肝衰竭的危险因素分析
Table 5 Risk factors for perioperative liver failure in patients with hepatitis B and hepatocellular carcinoma
3 讨 论
目前对于乙型病毒性肝炎肝癌患者治疗方法主要为外科手术治疗,随着临床技术的进步,肝切除术技术水平及肝切除术后的安全性也不断提升,但并发症仍不可避免,其中术后常见且较严重的并发症为肝衰竭[5-6]。长久以来,肝脏手术后肝衰竭等并发症一直困扰着临床医生,尤其是合并肝硬化的患者[7]。
本研究结果显示,年龄为影响乙型肝炎肝硬化肝癌患者围手术期肝衰竭的一独立危险因素。其原因可能为高龄患者器官功能减退,肝细胞再生能力下降,并合并基础疾病[8-9]。高龄患者肝切除术后可能诱发或加重基础疾病,而这些基础疾病可能反过来增加肝脏负担,故行肝癌手术在围手术期易发生肝衰竭。
ALB为体现肝脏合成功能及近期机体营养状况的指标,且为评价Child-Pugh分级中的一项,若手术前ALB偏低,则可能出现低蛋白血症不宜手术[10-12]。Poon等[13]关于1 222例肝脏切除术患者的研究显示,术前ALB偏低为影响乙型肝炎肝硬化肝癌患者围手术期发生肝衰竭的危险因素。手术前出现低蛋白血症可通过优质蛋白饮食和(或)静脉滴注人血白蛋白纠正,这对降低肝硬化肝癌患者围手术期肝衰竭发生率有重要意义[14]。Child-Pugh分级能客观地评估肝脏的功能,肝功能Child-Pugh分级越高,患者肝硬化程度越重,越易出现低氧血症,同时手术创伤及入肝血流阻断将进一步加重肝细胞的缺氧程度。本研究结果显示,Child-Pugh分级是术后发生肝衰竭的危险因素。因此,对术前肝功能Child-Pugh分级较高的患者应采取积极的治疗以改善肝功能,提高其手术耐受性,增加手术安全性,减少术后肝衰竭的发生[15]。
肝脏为合成部分凝血因子的场所,乙型肝炎肝癌患者肝脏功能减退,术后因手术创伤及肝组织减少致肝功能急剧下降。因此,术前需纠正肝功能及凝血功能。当乙型病毒性肝炎合并肝癌患者行手术治疗时,术中大量出血可致患者机体有效循环血容量的不足,使血液再分布,机体在应激状态下易出现全身炎症反应而增加肝衰竭风险[16]。有研究发现术中出血量1 000~1 250 mL为肝癌患者围手术期肝衰竭临界值[17]。本研究结果显示,术中出血量在1 200 mL以上时,患者出现围手术期肝衰竭风险明显增大。术中输血不利于肝癌患者围手术期恢复,其原因可能与肝脏大量缺血后再灌注损伤或机体免疫反应相关。肿瘤直径较大可能存在血供更丰富、卫星灶数目增多、恶性程度增加,且患者肝脏肿瘤直径≥5 cm较<5 cm患者预后更差,故手术需要切除的肝脏体积变大[18]。本研究结果显示,肝切除范围为乙型肝炎肝癌患者围手术期发生肝衰竭的独立危险因素。
国外有研究显示,肝硬化是肝癌患者在围手术期出现肝衰竭、死亡的独立危险因素[19-20]。国内相关报道比较少见。本研究结果显示,与对照组比较,研究组术中出血量多、手术时间长(P<0.05);术中输血率和肝门阻断率稍高,但差异无统计学意义(P>0.05);合并肝硬化是乙型肝炎肝癌患者围手术期发生肝衰竭的独立危险因素。原因可能是合并肝硬化的患者肝组织坏死范围大,肝功能及凝血功能明显减退,造成手术中切除范围增大,手术损伤大,从而增加了发生肝衰竭的危险。
本研究因病例数较少可能会使结论的可信度削弱,且为回顾性研究;需进一步行随机对照或前瞻性队列研究。
综上所述,肝硬化为肝癌患者围手术期发生肝衰竭的独立危险因素,肝硬化肝癌患者较无肝硬化肝癌患者出现围手术期肝衰竭的风险高,且危险因素不同。
[参考文献]
[1] 罗凤球,何剪太,彭健,等.腹腔镜与开腹肝癌切除手术疗效的Meta分析[J].重庆医学,2012,41(24):2477-2480.
[2] 戚诚,刘博,胡宁,等.吲哚菁绿排泄试验与肝癌患者肝动脉化疗栓塞术后肝衰竭的相关性分析[J].河北医科大学学报,2015,36(12):1400-1403.
[3] 郁文博,王超.肝癌干细胞表面标志物研究进展[J].中华消化杂志,2015,35(9):643-645.
[4] 刘怀军,马宁.重组人干扰素α-1b联合苦参素治疗慢性乙型肝炎的临床研究[J].河北医科大学学报,2014,35(3):319-321.
[5] 余昆,熊伟,李云峰,等.肝尾状叶肿瘤的手术治疗[J].山东医药,2012,52(18):54-55.
[6] 吴健雄,王黎明,刘立国,等.肝区域血流选择性适时阻断在肝中央型大肿瘤切除中的应用[J].中华肿瘤杂志,2012,34 (11):850-854.
[7] 王运兵,龚建平.腹腔镜肝切除术治疗肝癌的现状与国内应用前景[J].局解手术学杂志,2015,24(3):336-338.
[8] Zhang Y,Zhang H,Elizabeth A,et al. Epidemiology of hepatitis B and associated liver diseases in China [J]. Chin Med Sci J,2013,27(4):243-248.
[9] 白杨,孙璐,郭爱桃,等.肝恶性血管周上皮样细胞肿瘤4例临床病理分析[J].诊断病理学杂志,2014,21(2):73-75,79.
[10] Kim JM,Kwon CH,Joh JW,et al. Differences between hepatocellular carcinoma and hepatitis B virus infection in patients with and without cirrhosis[J]. Ann Surg Oncol,2014,21(2):458-465.
[11] Chow WB,Rosenthal RA,Merkow RP,et al. Optimal preoperative assessment of the geriatric surgical patient:a best practices guideline from the American College of Surgeons National Surgical Quality Improvement Program and the American Geriatrics Society[J]. J Am Coll Surg,2012,215(4):453-466.
[12] 向伦建,李建伟,陈健,等.腹腔镜肝切除术治疗84例大肝癌的临床疗效[J].中华消化外科杂志,2014,13(6):464-467.
[13] Poon RT,Fan ST,Lo CM,et al. Improving perioperative outcome expands the role of hepatectomy in management of benign and malignant hepatobiliary diseases:analysis of 1 222 consecutive patients from a prospective database[J]. Ann Surg,2004,240(4):698-710.
[14] 中国抗癌协会肝癌专业委员会.肝切除术围手术期过度炎症反应调控的多学科专家共识(2014版)[J].中华消化外科杂志,2014,13(10):751-755.
[15] Massimino KP,Kolbeck KJ,Enestvedt CK, et al. Safety and efficacy of preoperative right portal vein embolization in patients at risk for postoperative liver failure following major right hepatectomy[J]. HPB (Oxford),2012,14(1):14-19.
[16] Nanashima A,Abo T,Arai J,et al. Functional liver reserve parameters predictive for posthepatectomy complications[J]. J Surg Res,2013,185(1):127-135.
[17] 朱迎,董健,王万里,等.青年原发性肝癌的临床病理特征及肝切除术后的生存分析[J].西安交通大学学报:医学版,2014,35(3):419-422.
[18] 杨涛,孙轶飞,王立伟,等.KIF14过表达与肝细胞肝癌手术预后密切相关[J].河北医科大学学报,2014,35(3):263-265.
[19] Torre LA,Bray F,Siegel RL,et al. Global cancer statistics,2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[20] Itoh S,Uchiyama H,Kawanaka H,et al. Characteristic risk facors in cirrhotic patients for posthepatectomy complications:comparison with noncirrhotic patients[J]. Am Surg,2014,80(2):166-170.