高分级动脉瘤性蛛网膜下腔出血(poor-grade aneurysmal subarachnoid hemorrhage,PaSAH)是严重损伤中枢神经系统并对全身多个器官产生病理影响的急性脑血管病[1],病死率为30.5%~35%[2]。除神经系统本身损害之外,导致不良预后的主要原因为严重并发症引起,呼吸功能障碍是发生率较高的并发症之一,并且是影响患者预后的重要因素。神经源性肺水肿(neurogenic pulmonary edema,NPE)是指在没有原发性心、肺、肾等疾病的情况下,继发于中枢神经系统损害所导致的突发性颅高压并引起急性肺水肿,如蛛网膜下腔出血、颅脑外伤、癫痫大发作等[3]。既往的回顾性研究发现约22%的动脉瘤性蛛网膜下腔出血患者中存在NPE,发生率为2%~42.9%[4-5]。近年来随着动脉瘤性蛛网膜下腔出血血管内介入治疗的普及及神经重症监护室中机械通气的广泛应用,对于PaSAH患者的治疗往往需要先行开颅动脉瘤夹闭或者动脉瘤血管内治疗以避免其再次破裂出血,然后行侧脑室穿刺外引流缓解脑积水导致的颅高压,如果患者有重度呼吸障碍则需要积极使用呼吸机辅助呼吸,多种治疗措施的使用提高了患者的治疗效果。本研究旨在探讨呼气末正压通气(positive end expiratory pressure,PEEP)对PaSAH合并呼吸功能障碍患者颅内压的影响。
1 资 料 与 方 法
1.1 一般资料 选择2016年1月—2017年12月在河北省石家庄市第一医院神经外科住院的需呼吸机辅助呼吸患者 30例,按有无合并症分为合并NPE组(A组)19例,男性10例,女性9例。年龄42~69岁,平均(52.0±10.2)岁,高血压10例,糖尿病3例,冠心病2例,动脉瘤位于前循环15例;未发生NPE组(B组)11例,男性5例,女性6例,年龄38~72岁,平均(56.0±11.1)岁,高血压7例,糖尿病2例,冠心病1例,动脉瘤位于前循环9例,2组性别、年龄、既往史、吸烟、动脉瘤位置差异均无统计学意义(P>0.05),具有可比性。
患者均签署知情同意书;本研究经医院伦理委员会同意。
1.2 入选标准和排除标准 入选标准:①经头CT证实为自发性蛛网膜下腔出血;②经头数字减影血管造影证实为颅内动脉瘤破裂出血所致蛛网膜下腔出血,并急诊行动脉瘤血管内治疗术;③急诊行侧脑室钻孔外引流术;④发病24 h内,有重度呼吸功能障碍急性肺损伤(acute lung injury,ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrom,ARDS),呼吸频率≥28次/min,氧分压≤60 mmHg,PaO2/FiO2≤200 mmHg,X线胸片双肺均有斑片状阴影,肺动脉嵌顿压≤18 mmHg;⑤有床旁胸片检查,有呼吸困难行气管插管呼吸机辅助呼吸,机械通气采用SMIV+PS模式,设置潮气量8~10 mL/kg,呼吸频率14~20次/min,氧浓度为40%,PEEP每个患者均分别采用0、6、12 cmH2O 3个参数。排除标准:①脑死亡;②有心肌梗死、心肌病或充血性心力衰竭病史者;③合并严重心、肺、肝、肾等脏器功能不全者。
1.3 器械材料 ①颅内压监测探头:ICP monitor, Codman,Johnson&Johnson, USA。②压力传感器:Medex公司MX9505T型压力传感器套装。③中心静脉导管:ARROW 牌ES-04301型号中心静脉导管包。④脑室外引流器:山东百多安医疗器械有限公司生产的一次性使用脑室外引流器。
1.4 监护方法与结果判定 直接采取双侧侧脑室分流,置入带引流装置的颅内压探头。缓慢平稳释放脑脊液,将颅内压维持在15 mmHg左右,并持续监测记录。①中心静脉压数据判定及处理:以5~10 cmH2O(3.68~7.35 mmHg)为正常中心静脉压范围,保持在5~8 cmH2O为理想中心静脉压,低于5 cmH2O增加补液量,高于8 cmH2O减慢输液速度或暂缓输液,高于10 cmH2O则给予利尿脱水药物。有心功能不全者,给予强心利尿治疗。补液晶胶比为1.5~2.0∶1,胶体液选择白蛋白、血浆、聚明胶肽等。②颅内压数据判定与处理:以5~15 mmHg为正常范围,当颅内压≥20 mmHg时,实施降颅压治疗,脱水药用甘露醇快速静脉滴注。
1.5 观察指标 在患者生命体征相对稳定的情况下,分别设置PEEP为0、6、12 cmH2O 3种模式,每种PEEP持续2 h后行血气分析,同时记录患者生命体征变化,如心率、血压、中心静脉压及颅内压等参数。在调整PEEP参数的过程中,如出现SpO2低于90%、血压下降15%即停止继续调整。
1.6 统计学方法 应用SPSS 19.0统计软件处理数据,计量资料比较分别采用F检验和SNK-q检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 3种PEEP对未合并NPE的PaSAH患者的影响 3种PEEP模式下,未合并NPE的PaSAH患者的生命体征指标心率、氧分压和平均动脉压差异均无统计学意义(P>0.05)。 PEEP=12 cmH2O时,颅内压和中心静脉压高于PEEP=0 cmH2O和PEEP=6 cmH2O时,脑灌注压低于PEEP=0 cmH2O时,差异均有统计学意义(P<0.05)。见表1。
表1 不同PEEP对未合并NPE的PaSAH患者的影响
Table 1 Effects of different PEEP on PaSAH patients without NPE ![]()
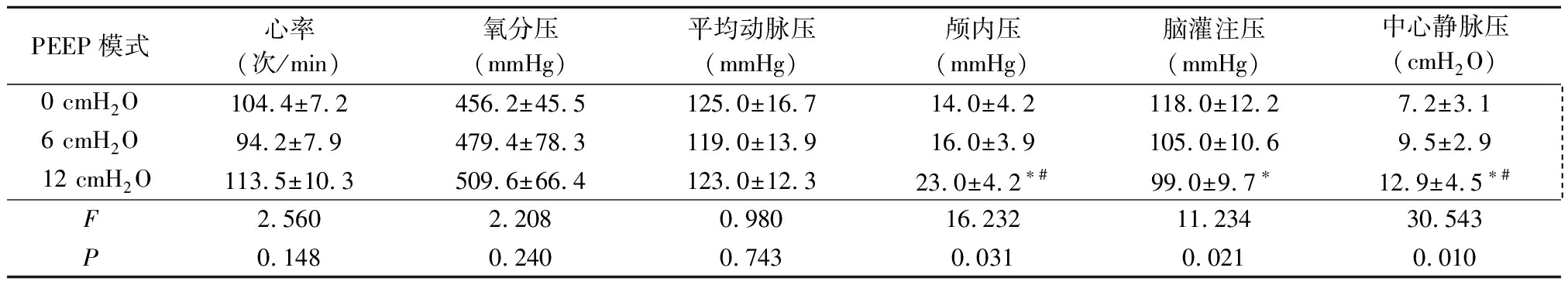
*P<0.05与0 cmH2O比较 #P<0.05与6 cmH2O比较(SNK-q检验)
2.2 3种PEEP对合并NPE的PaSAH患者的影响 3种PEEP模式下,合并NPE的PaSAH患者的生命体征指标心率、氧分压、平均动脉压差异均无统计学意义(P>0.05)。PEEP=12 cmH2O时,颅内压和中心静脉压高于PEEP=0 cmH2O和PEEP=6 cmH2O 时,脑灌注压低于PEEP=0 cmH2O时,差异均有统计学意义(P<0.05)。见表2。
表2 不同PEEP对合并NPE的PaSAH患者的影响
Table 2 Effects of different PEEP on PaSAH patients with NPE ![]()
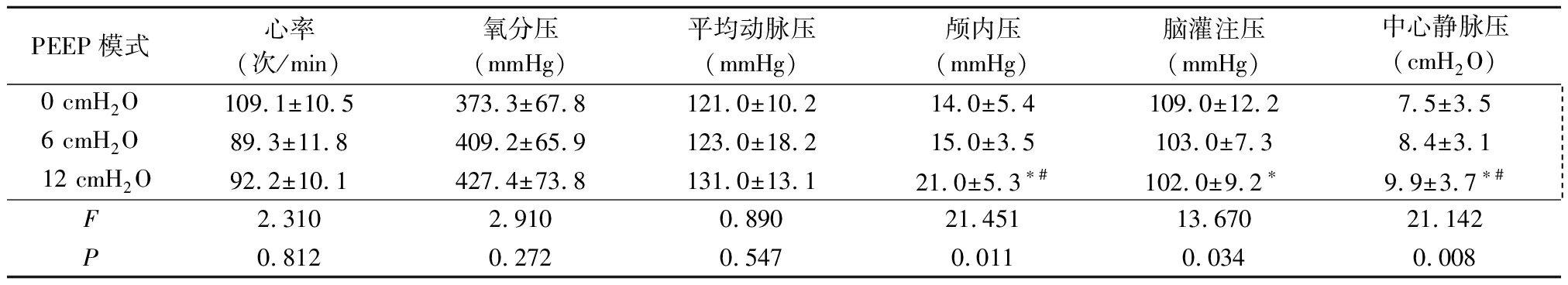
*P<0.05与0 cmH2O比较 #P<0.05与6 cmH2O比较(SNK-q检验)
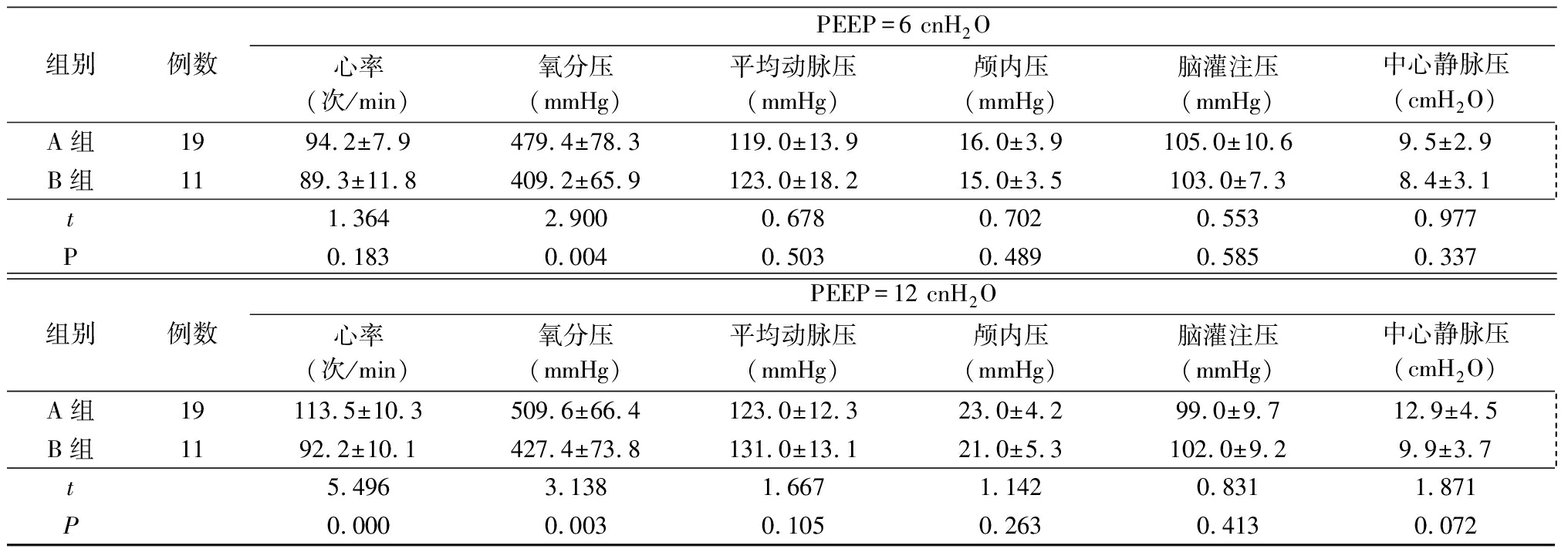
2.3 2组不同PEEP下相关指标比较 3种PEEP模式下,B组氧分压均低于A组,差异有统计学意义(P<0.05),而2组平均动脉压、颅内压、脑灌注压及中心静脉压差异无统计学意义(P>0.05)。见表3。
表3 2组不同PEEP下相关指标比较
Table 3 Comparison of two groups of related indexes under difference PEEP ![]()
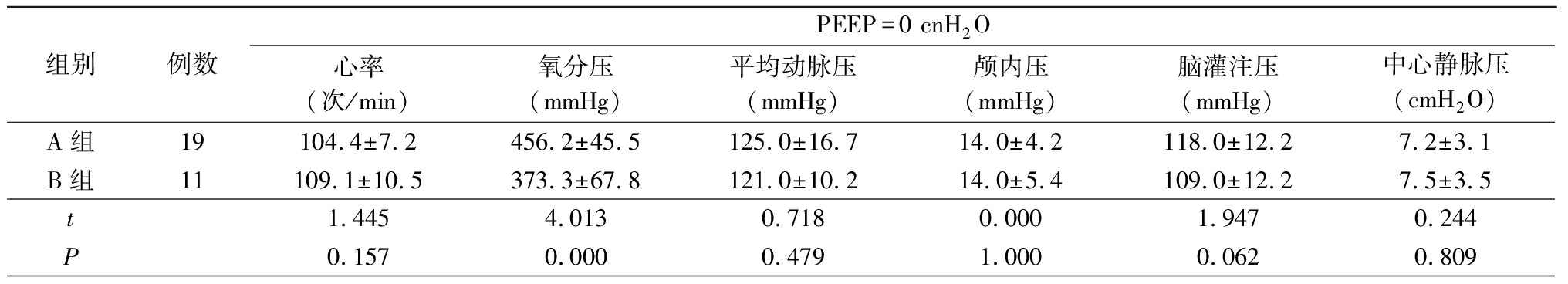
表3 (续)
3 讨 论
蛛网膜下腔出血是临床常见病和多发病,尤其是动脉瘤破裂出血所致的自发性蛛网膜下腔出血发病急,病情进展迅速,是严重威胁患者生命的急症脑血管疾病,这些患者30天内病死率高达45%,其中30%的幸存者中留有严重功能障碍,一半的患者中遗留明显心理认知功能障碍[6-8]。临床通常采用Hunt-Hess分级法和世界神经外科医师联盟(World Federation of Neurological Societies,WFNS)分级标准对动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)患者的严重程度进行分级。临床研究表明,0~Ⅱ级患者症状相对较轻,经积极救治,病死率低于1%,属轻型aSAH,而Ⅲ级以上的患者,通常称之为PaSAH或重症蛛网膜下腔出血,患者再出血率和脑血管痉挛的发生率高,总体病死率不低于50%[7-11]。目前,随着脑血管造影的普及以及开颅动脉瘤夹闭、动脉瘤血管内治疗技术的广泛开展和成熟,该病大多数患者及时治疗后预后良好,但仍有三分之一的患者预后不良,尽管采用最现代的治疗方法,但病死率及病残率仍然很高。其中死亡患者中90%为PaSAH患者,此类患者约占所有自发性蛛网膜下腔出血患者的20%~30%[12]。
PaSAH是神经外科的危重症,而呼吸功能障碍是呼吸系统疾病,特别是严重呼吸功能障碍,直接影响了患者的预后。在目前医学高度专科化的条件下,神经外科医生对呼吸功能障碍的理解与认识不足,而呼吸科医生亦不能很好地处理神经外科的临床问题。因此,PaSAH患者呼吸功能障碍后既要考虑到呼吸机参数的设置对肺部情况的改善,又要考虑到使用呼吸机后对患者颅内压有无影响。本研究通过设定3种PEEP模式观察颅内压、脑灌注压及中心静脉压的变化,PEEP值越高,颅内压也随之升高,但PEEP在12 cmH2O时才对患者颅内压、脑灌注压及中心静脉压有显著影响。提示PEEP值不要>12 cmH2O,这对临床有显著的指导意义。
国外的研究表明,呼吸系统并发症在PaSAH患者中很常见,约22%[4-5,13]。最常见的并发症类型包括心源性肺水肿或NPE、吸入性及感染性肺炎、肺不张等。这些并发症均会造成不同程度的呼吸功能障碍,引起低氧血症,伴有或不伴有二氧化碳潴留,其最终结局则会造成大脑组织的缺血缺氧性改变,加重原发的脑组织损伤。呼吸系统并发症是PaSAH患者常见的并发症,其终末期均会表现出ALI或ARDS。以往有研究发现PEEP设置在低区间后对NPE心肺功能的影响较小[14],但>10 cmH2O后影响有多大尚不清楚。本研究提示PEEP>12 cmH2O后会导致颅内压显著升高、脑灌注压下降及中心静脉压升高。
NPE多见于PaSAH患者,以往的研究发现伴有NPE的PaSAH患者中病死率达90%以上,而没有伴发NPE的患者NPE病死率不足一半[5]。可见NPE可能是导致PaSAH患者严重预后不良的主要因素。PaSAH患者神经系统病理生理过程有两大主要矛盾,其一是蛛网膜下腔出血后的颅内压增高;其二是在蛛网膜下腔出血之后发生的脑血管痉挛。这2个临床问题,在患者并发呼吸功能障碍并需要进行临床干预时,临床医生则要权衡神经系统与呼吸系统之间的获益和风险的平衡。如胸腔内压力升高,会导致上腔静脉回流减少,通过颈内静脉压力的传递,颅内压随之升高。已有研究表明,PEEP设置的越高,腹腔压力随之逐渐升高,导致胃肠功能下降[15]。而严重呼吸功能障碍,特别是发生ALI或ARDS,呼吸机支持需要应用较高的PEEP水平,尤其是PEEP 为12 cmH2O时,明显改善ARDS患者生存率[14,16],但高PEEP水平会引起胸腔内压力的升高,继而影响上腔静脉回流,这必然会导致颅内压升高,加重神经系统的损伤。那么,对于这样的患者,PEEP设置在多少范围内才能尽量降低对颅内压的影响呢?本研究结果显示,PEEP值的大小对患者生命体征的心率、氧分压及平均动脉压影响不明显,但对颅内压、脑灌注压及中心静脉压均有显著影响,在PEEP值为12 cmH2O时,患者的颅内压及中心静脉压明显升高,而灌注压明显降低。这与以往针对NPE患者的研究结果相一致[14]。提示在临床工作中尽量不要应用过高PEEP值,以减少对颅内压、灌注压及中心静脉压的影响;PEEP在6 cmH2O时对颅内压、中心静脉压影响小,可能是比较适合此类患者的理想PEEP值。本研究显示合并NPE的患者,高PEEP值会明显增加患者心率和氧分压,这可能与此类患者因氧合能力差而给予的吸入氧浓度高有关,而对患者颅内压、脑灌注压及中心静脉压影响不大。
脑血管痉挛是PaSAH后常见的临床现象,是以脑血管的可逆性缩窄为形态特征,导致脑血流减少、脑组织缺血缺氧损害为后果的并发症。抗脑血管痉挛的核心治疗策略是通过积极扩容、稀释血液、升高血压[17]治疗预防脑血管痉挛的发生,然而过多的循环血容量必然会增加心肺功能衰竭的风险,同时监测中心静脉压及颅内压可以平衡两者之间的关系。这与于作华等[18]研究重型颅脑损伤中使用的方法相一致。在ARDS时,常常需要限制总的液体入量控制前后负荷[17]。什么样的扩容量才是恰当的?既达到保持脑血流有效的灌注,又不至于导致呼吸功能障碍时肺水肿加重,这种临床治疗措施要求能够同时监测脑血管痉挛的程度以及血管内容量负荷,特别是对肺水肿进行同步监测。对脑血管痉挛的监测,床旁经颅多普勒超声(transcranial Doppler,TCD)监测脑血管血液流速,判断血管痉挛的存在和严重程度,是目前的常规方法。对容量的监测,临床最常用的是中心静脉压测量,中心静脉压能较准确地反映全身容量负荷情况。对于PaSAH发生严重肺水肿的患者,通过TCD、中心静脉压同步监测可提高临床容量干预的目的性和准确性,以便在临床中找到较理想的容量管理方案。本研究仍缺乏可靠的脑血管痉挛的监测手段,在以后的研究中需要进一步完善。本研究的意义在于临床可以根据患者呼吸功能障碍发生的不同临床特征,在疾病早期进行预防和干预,并改善临床干预措施的有效性,以提高PaSAH患者临床治愈率、降低病死率。
[参考文献]
[1] Connolly ES Jr,Rabinstein AA,Carhuapoma JR,et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke,2012,43(6):1711-1737.
[2] 钟鸣,赵兵.全国高分级动脉瘤性蛛网膜下腔出血诊疗策略高峰论坛纪要[J].中国脑血管病杂志,2010,7(2):112.
[3] Chen S,Li Q,Wu H,et al. The harmful effects of subarachnoid hemorrhage on extracerebralorgans[J]. Biomed Res Int,2014,2014:858496.
[4] Garg R,Bar B. Systemic Complications following aneurysmal subarachnoid hemorrhage[J]. Curr Neurol Neurosci Rep,2017,17(1):7.
[5] Saracen A,Kotwica Z,Wožniak-Kosek A,et al. Neurogenic pulmonary edema inaneurysmal subarachnoid hemorrhage[J]. Adv Exp Med Biol,2016,952:35-39.
[6] Zhao B,Rabinstein A,Murad MH,et al. Surgical andendovascular treatment of poor-grade aneurysmal subarachnoid hemorrhage:a systematic reviewand meta-analysis[J]. J Neurosurg Sci,2017,61(4):403-415.
[7] Gaasch M,Schiefecker AJ,Kofler M,et al. Cerebral autoregulation in the prediction of delayed cerebral ischemia and clinical outcome in poor-grade aneurysmal subarachnoid hemorrhage patients[J]. Crit Care Med,2018,46(5):774-780.
[8] Han Y,Ye F,Long X,et al. Ultra-early treatment for poor-grade aneurysmal subarachnoid hemorrhage:a systematic review and meta-analysis[J]. World Neurosurg,2018[Epub ahead of print].
[9] Tykocki T,Czyž M,Machaj M,et al. Comparison of the timing of intervention and treatment modality of poor-grade aneurysmal subarachnoid hemorrhage[J]. Br J Neurosurg,2017,31(4):430-433.
[10] 王跃飞,孟亮,余小祥,等.高分级动脉瘤性蛛网膜下腔出血的早期手术治疗[J].中国现代医学杂志,2017,27(21):99-103.
[11] 李则群,郑匡,赵兵,等.颅内高分级动脉瘤性蛛网膜下腔出血外科干预的随访研究[J].中华神经外科杂志,2016,32(2):136-139.
[12] 丁璇.高分级动脉瘤性蛛网膜下腔出血的外科干预[D].济南:山东大学,2012.
[13] Inouye S,Jin D,Cen S,et al. Trends in the use of pulmonary artery catheterization in the aneurysmal subarachnoid hemorrhage population[J]. J Clin Neurosci,2016,31:133-136.
[14] 龚志翔,胡海涛,周有发,等.不同呼气末正压通气对神经源性肺水肿患者心肺功能的影响[J].临床麻醉学杂志,2014,30(9):916-917.
[15] 康军阳,袁小芬,刘静,等.蛛网膜下腔出血栓塞术后呼气末正压对患者腹腔压力的影响[J].临床合理用药杂志,2017,10(22):136-137.
[16] 马春林,梁道业,郑福奎.高呼气末正压在神经源性肺水肿机械通气中的作用[J].中华危重病急救医学,2014,26(5):339-342.
[17] Engquist H,Rostami E,Ronne-Engström E,et al. Effect of HHH-therapy on regional CBF after severe subarachnoid hemorrhage studied by bedside Xenon-Enhanced CT[J]. Neurocrit Care,2017,22(2):120-123.
[18] 于作华,王强,唐亮,等.中心静脉压与颅内压联合监测在复合性重型颅脑损伤治疗中的应用[J].中华神经外科杂志,2013,29(7):734-735.