随着人们健康意识的提高和电子纤维结肠镜筛查的普及,越来越多的无症状结直肠肿瘤被发现[1]。类癌具有与癌相类似的组织结构,但却拥有与癌不相同的生物学行为[2]。类癌可发生于全身各个脏器,但超过半数以上发生在消化系统,在我国直肠类癌最为常见[3]。直肠类癌又称直肠神经内分泌肿瘤,多发生于肠黏膜腺体的嗜银细胞,早期即延伸至黏膜下,为灰白色或黄色质地硬隆起型黏膜及黏膜下肿物,多呈局部性浸润性生长而少有远处转移。随着内镜技术的发展,治疗直肠肿瘤的微创手术方式越来越多。本研究对应用较多的经肛门微创手术(transanal endoscopic microsurgery,TEM)和内镜黏膜下剥离术( endoscopic submucosal dissection,ESD)2种治疗方式进行对比,报告如下。
1 资 料 与 方 法
1.1 一般资料 选择2011年9月—2016年9月在河北省唐山市人民医院就诊的结直肠肿瘤患者89例,按病情需要分为2组。TEM组54例,男性26例,女性28例,年龄35~70岁,平均(52.8±11.7)岁;肿瘤距肛缘距离56~69 mm, 平均(61.3±3.4) mm;肿瘤大小6.5~10.8 mm,平均(8.9±0.9) mm。ESD组35例,男性21例,女性14例,年龄38~67岁,平均(51.4±10.8)岁;肿瘤距肛缘距离52~68 mm, 平均(60.4±4.6) mm;肿瘤大小6.5~11 mm,平均(8.6±0.8) mm。2组性别、年龄、肿瘤距肛缘距离、肿瘤大小差异均无统计学意义(P>0.05),具有可比性。
1.2 入选和排除标准 入选标准:①术前均经结肠镜行活组织病理检查确诊;②行超声内镜和盆腔磁共振成像确诊为早期直肠神经内分泌肿瘤(肿瘤分级G1和G2);③经硬直肠镜检查明确单发直肠神经内分泌肿瘤距肛缘≤7 cm,且肿瘤直径<2 cm;④经胸、腹部CT,腹部超声,盆腔MRI或PET-CT检查除外远处脏器转移者。排除标准:①局域性淋巴结转移;②肿瘤直径≥2 cm;③肿瘤分级G3;④远处脏器转移者;⑤严重心、肺、肝、肾及血液性疾病者。
1.3 治疗方式
1.3.1 ESD组 术前准备:①患者术前3 d流质饮食,手术当天给予口服复方聚乙二醇电解质散清洁肠道,禁食水。②患者均于术前签署手术知情同意书并完成术前相关检查。操作步骤:①明确病变范围并标记;②Dual刀于病变外缘0.5~1.0 cm处环周标记;③在标记点外侧黏膜下多点注射含有0.2%靛胭脂和0.1%肾上腺素的甘油果糖使病变区域隆起,黏膜层与肌层分开;④自病变边缘标记点外周切开黏膜,沿间隙逐层剥离,并及时止血;⑤标本置于10%福尔马林溶液中保存并送病理。
1.3.2 TEM组 术前准备:①患者术前3 d流质饮食,术前1 d给予口服复方聚乙二醇电解质散清洁肠道,手术当日禁食水;②患者均于术前签署手术知情同意书并完成术前相关检查。操作步骤:①直肠前壁肿瘤患者取俯卧折刀位,后壁肿瘤患者取截石位,右侧及左侧壁肿瘤分别采取右侧、左侧卧位;②全身麻醉成功后常规消毒、铺单;③轻柔扩肛后自肛门置入TEM直肠镜,调节位置并固定,连接各种线路后向直肠腔内注入CO2气体,气压保持在12~15 mmHg;④从直肠镜后面板插入针形电刀和组织钳,在瘤体的四周用电刀电凝出切除的标记线,切线应距肿瘤边缘1 cm以外,手术从瘤体的右侧缘切开黏膜直至肠壁外脂肪层,用组织钳轻轻牵起切开的瘤体侧,然后沿标记线将瘤体包括整块肠壁完整切除;⑤取出标本后,用可吸收滑线将直肠创面作横向行进的连续缝合。
1.4 统计学方法 应用SPSS 19.0统计软件处理数据。计数资料比较采用χ2检验;计量资料比较采用独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
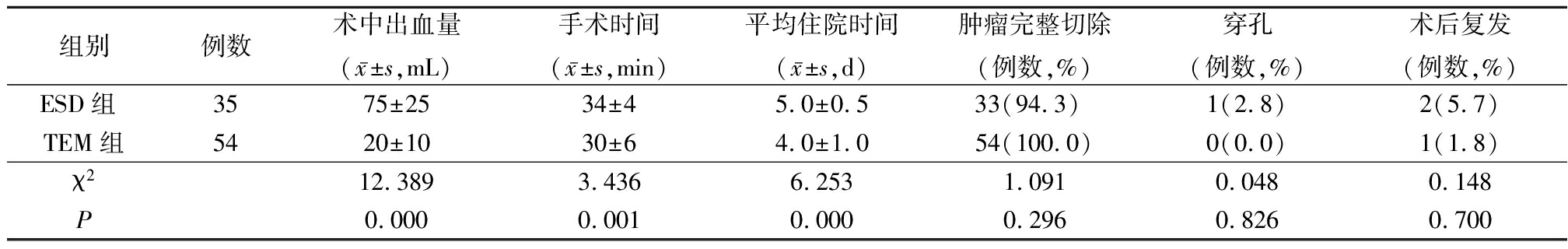
TEM组术中出血量少于ESD组,手术时间和平均住院时间少于ESD组,差异有统计学意义(P<0.05)。随访5年, 2组肿瘤完全切除、穿孔和术后复发率差异均无统计学意义(P>0.05)。见表1。
表1 2组围手术期情况比较
Table 1 Comparison of the perioperative period between two groups
3 讨 论
神经内分泌肿瘤,也称类癌瘤,因其可产生小分子多肽或肽类激素,属低度恶性的神经内分泌肿瘤[4]。与其他身体部位组织神经内分泌肿瘤不同的是,直肠神经内分泌肿瘤鲜见类癌综合征表现。直肠神经内分泌肿瘤近年来在一般人群中的发病率呈迅速上升,在过去35年中直肠神经内分泌肿瘤发病率增加了约10倍[5]。大多数情况下,直肠神经内分泌肿瘤为局部较小的肿瘤病变,经常在行肠镜检查时被发现[6]。不同于直肠腺癌,直肠神经内分泌肿瘤患者多无特异性症状,其就诊原因多为排便次数及形状改变,腹痛,腹泻或血便等[7]。临床上约有80%的直肠神经内分泌肿瘤直径在1 cm以内,这样体积小的类癌多表现为良性的生物学行为,一般认为采取局部切除即能根治。目前直肠神经内分泌肿瘤治疗选择的主要依据是肿瘤大小和浸润深度,两者均可在术前进行评估确定[6]。直径<1 cm的直肠神经内分泌肿瘤被认为优先选择行内镜下局部切除,因为它们中有0.7%~2%可能发生局部淋巴结和远处转移[8]。直径1~2 cm的直肠神经内分泌肿瘤,其恶性程度可能较1 cm以下者高,具有更高的转移风险,须经术前仔细评估决定手术方式,以防术后复发和转移的出现[2]。TEM手术具有直观、便捷、定位准确等优点,借助腔镜成像系统使病灶很容易固定在术野范围,有利于完整切除病灶。
随着电子结肠镜的普及,越来越多的直肠神经内分泌肿瘤患者于健康体检中被发现,患者越来越重视手术的创伤、术后的恢复以及康复后的生活质量等问题。而有学者认为,内镜对于早期结直肠癌的治疗效果与外科手术治疗基本等同[9]。内镜手术技术因其创伤小、恢复快,越来越受到人们的欢迎和重视,ESD治疗早期直肠癌已广泛用于临床[10]。ESD具有整体切除病灶的特点,其所取得的病理标本足够得到准确的病理诊断与评估[11],不需要麻醉,能有效缩短治疗周期,减少患者的住院费用。但ESD要求在黏膜下对病灶组织进行剥离,故其穿孔率和出血率均较高,穿孔与出血成为ESD失败的主要原因。操作者的技术在ESD治疗中至关重要。在选则使用ESD之前应该严格进行术前检查及体查,严格把握其适应证,及时发现术中出血、穿孔并及时处理是ESD成功的关键。ESD术中极易导致病灶破碎、切除不完整,影响术后病理检测。所以,术中应准确定位、标记,严防病变残留等情况的发生。
TEM可以更清晰地显露病变部位及其周围组织,从而使操作更加精确,能够获得更好的肛门功能,并可提供更加完整的病理标本[12]。结合TEM适应证及诊疗规范,该手术方式既可用于对早期结直肠肿瘤的基本治疗,也可在其他治疗失败时进行补救。同时对于术中出血、穿孔等情况TEM可以及时处理。因此,TEM较ESD的适用范围更广,并发症更少,成功率更高。由于TEM需要在全身麻醉下进行,术后常需住院治疗并观察,且TEM的设计是针对较高位的直肠肿瘤,在距肛门8~10 cm的直肠肿瘤的治疗中,其优点更加突出[13]。本研究观察到TEM对于低位直肠肿瘤的治疗效果也很可靠。TEM对术者腔镜操作技术要求较高,而进行低位肿瘤的切除则要求更高,且其设备相对昂贵,其普及尚需时间,但TEM对于早期结直肠肿瘤的治疗地位不会因此而改变。此外,本研究回顾性分析的病例选择可能存在偏颇,如内镜医师更倾向于选择肿瘤病灶较小的病例,而对相对较大的肿瘤更倾向于实施TEM,这也充分说明TEM可以作为内镜治疗神经内分泌肿瘤的有效补充。
综上所述,相对于ESD,TEM更具普及优势,结合国外学者意见[14-15],考虑到直肠神经内分泌肿瘤普遍较小,肿瘤进展缓慢,有必要建立长期随访的术后病例数据库,以便于评估内镜治疗方法的相对有效性。
[参考文献]
[1] 徐涛,李巍,于淑霞,等.无症状体检者859例结肠镜检查结果分析[J].重庆医学,2017,46(增刊Ⅰ):224-225.
[2] 范永田,刘卓,陈贵平.直肠类癌的诊治进展[J].浙江临床医学,2015,17(6):1027-1028.
[3] 申玉翠,韩冰,徐建华,等.1990例社区结直肠癌筛查高危人群的结肠镜检查结果分析[J].中华消化杂志,2015,35(3):179-182.
[4] Lee L,Edwards K,Hunter IA,et al. Quality of local excision for rectal neoplasms using transanal endoscopic microsurgery versus transanal minimally invasive surgery:a multi-institutional matched analysis[J]. Dis Colon Rectum,2017,60(9):928-935.
[5] Chen WJ,Wu N,Zhou JL,et al. Full-thickness excision using transanal endoscopic microsurgery for treatment of rectal neuroendocrine tumors[J].World J Gastroenterol,2015,21(30):9142-9149.
[6] Sekiguchi M, Sekine S,Sakamoto T,et al. Excellent prognosis following endoscopic resection of patients with rectal neuroendocrine tumors despite the frequent presence of lymphovascular invasion[J]. J Gastroenterol,2015,5(12):1184-1189.
[7] 董爱莲.直肠类癌15例临床病理分析[J].实用医技杂志,2016,23(10):1132-1133.
[8] Yang DH,Park Y,Park SH,et al. Cap-assisted EMR for rectal neuroendocrine tumors:comparisons with conventional EMR and endoscopic submucosal dissection(with videos)[J]. Gastrointest Endosc,2016,83(5):1015-1022.
[9] Lee D,Lee M,Lee K,et al. Asymmetric training using virtual reality reflection equipment and the enhancement of upper limb function in stroke patients:a randomized controlled trial[J]. J Stroke Cerebrovasc Dis,2014,23(6):1319-1326.
[10] 李青科,何立芳,耿学辰,等.经肛门内镜显微手术联合放疗治疗早期直肠癌的效果分析[J].河北医科大学学报,2017,38(4):461-464,封三.
[11] Kim JB,Lee HS,Lee HJ,et al. Long-term outcomes of endoscopic versus surgical resection of superficial submucosal colorectal cancer[J]. Dig Dis Sci,2015,60(9):2785-2792.
[12] Hompes R,Ashraf SQ,Gosselink MP,et al. Evaluation of quality of life and function at 1 year after transanal endoscopic microsurgery [J]. Colorectal Dis,2014,17(2):O54-61.
[13] O′Neill CH,Platz J,Moore JS,et al. Transanal endoscopic microsurgery for early rectal cancer:a single-center experience [J]. Dis Colon Rectum,2017,60(2):152-160.
[14] Judd S,Nangia S,Levi E,et al.Rectal carcinoid tumor:a delayed localized recurrence 23 years after endoscopic resection [J] . Endoscopy,2014,46(Suppl 1):E555-556.
[15] Kim SH,Yang DH,Lee JS,et al.Natural course of an untreated metastatic perirectal lymph node after the endoscopic resection of a rectal neuroendocrine tumor[J].Intest Res,2015,13(2):175-179.