2013版中国心血管病报告显示,在我国缺血性卒中是人群首位死亡原因[1]。20%~30%脑卒中是颈动脉狭窄性病变进行性发展所致,缺血性卒中与颈动脉粥样硬化易损斑块的发生和发展密切相关[2]。一般易损斑块的不稳定性主要取决于极薄的纤维帽、大的脂质核和斑块内出血[3]。斑块内新生血管的形成是易损斑块研究较多的发病机制[4]。当颈动脉检测出易损斑块时,表明冠状动脉及其主要分支同时发生病变的可能大[5]。斑块内新生血管内皮细胞组成单一,通透性高,周围缺乏支持组织,脆弱易破,致使斑块极不稳定,易破裂出血。新生血管还可使炎性细胞进入斑块,刺激产生细胞因子进一步激活巨噬细胞和平滑肌细胞,生成纤维帽加重斑块粥样硬化。所以,早期预测及评估动脉粥样硬化斑块内新生微血管的存在和发展极为重要。血浆脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)是一种新型炎症标志物,对炎症的特异性高,而生物差异性低。研究证实,Lp-PLA2参与了动脉粥样硬化斑块形成及破损的过程[6]。在此背景下,本研究通过超声声学造影计算不同类型斑块内新生血管的增强强度及增强密度值,探讨Lp-PLA2与颈动脉粥样硬化斑块内新生血管的相关性。
1 资 料 与 方 法
1.1 一般资料 收集2016年1月—2017年6月就诊于河北北方学院附属第一医院心内科门诊行颈动脉超声检查确定为颈动脉粥样硬化斑块患者58例为观察组,男性34例,女性24例,年龄45~83岁,平均(60.6±10.5)岁。纳入标准:①颈总动脉或颈内动脉有斑块者;②未服用降脂药;③按勇强等[7]建议分为低度风险斑块(斑块厚度<2 mm 的低回声斑块或低回声为主的混合回声斑块、高回声或高回声为主混合的回声斑块)、中度危高风险斑块(斑块厚度为2~3 mm的低回声或低回声为主的混合回声斑块)、高度风险斑块(厚度>3 mm、长度>15 mm的低回声或低回声为主的混合回声斑块)。排除标准:既往缺血性卒中史及糖尿病、恶性肿瘤、结核、血液系统疾病、肝肾疾病、风湿免疫病、严重炎症反应。另选取健康体检者30例为对照组,男性20例,女性10例,年龄51~79岁,平均(63.7±10.1)岁。
所有入选者均签署知情同意书。
1.2 方法
1.2.1 Lp-PLA2检测 待受检者禁食10~12 h后,空腹采集肘静脉血,采用酶联免疫吸附测定法检测Lp-PLA2浓度。
1.2.2 颈动脉彩色多普勒超声检查 应用Toshiba Aplio500彩色多普勒超声诊断仪,随机配备反向编码造影成像技术(coded phased inversion,CPI),线阵探头,频率3~10 MHz,嘱患者平卧,充分暴露颈部,头部远离检查侧,按照颈动脉检查标准化流程[8],依次检查双侧颈总动脉、颈内外动脉,记录有无斑块及斑块形状、大小、回声,储存图像。
1.2.3 颈动脉超声造影检查 记录二维超声数据后,选择最佳切面清晰显示斑块位置。在医师指令下推注造影剂(用瑞士Bracco公司生产的声诺维SonoVue 59 mg冻干粉与2 mL生理盐水剧烈振荡20 s),同步计时,观察造影全过程,图片保存至软件。斑块增强程度分级:0级,不增强,1级,仅外膜增强;2级,斑块内少量点状增强;3级,线状增强伸入至斑块内部;4级,斑块内弥漫增强。启动定量分析软件,生成斑块内时间-强度曲线(time-intensity curve,TIC),计算出增强强度值,依据超声造影结果描绘感兴趣区(region of interest,ROI)和作为参考的另一感兴趣区ROI*,记录 ROI、ROI*平均面积值,按照公式(增强密度值=增强强度值/面积)计算得出斑块内新生血管的增强密度值。
1.3 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较分别采用t检验、F检验和SNK-q检验;相关性采用Pearson直线相关分析。P<0.05为差异有统计学意义。
2 结 果
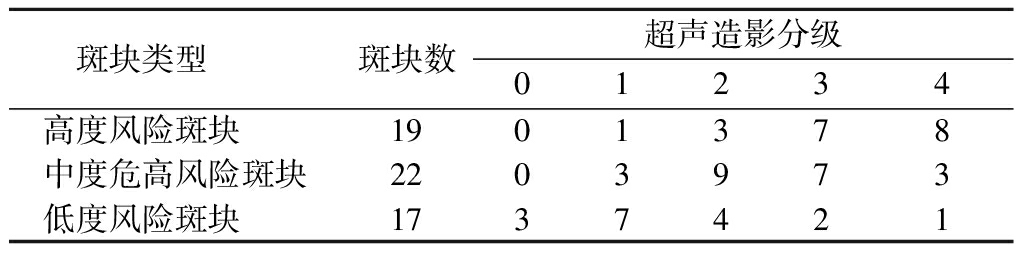
2.1 超声造影结果 58例患者中50例为单侧斑块,8例为双侧斑块。双侧斑块者若风险等级不同,以相对高风险侧斑块记录并行超声造影;若斑块风险等级相同,以较厚侧行超声造影。低度风险斑块中有3个超声造影等级为0未行定量分析,见表1。
表1 不同类型斑块超声造影分级 (斑块数)
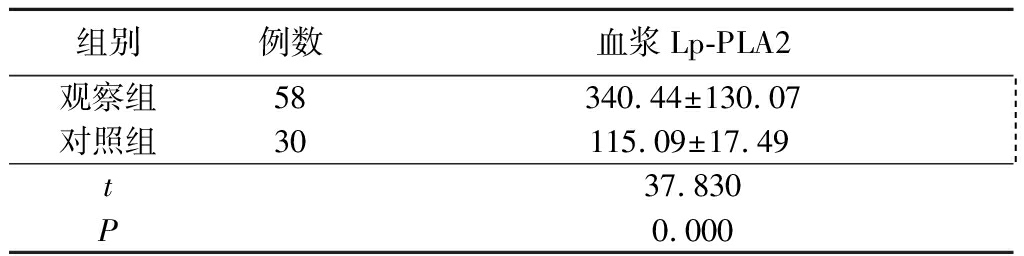
2.2 观察组与对照组血浆Lp-PLA2水平比较 观察组血浆Lp-PLA2水平显著高于对照组,差异有统计学意义(P<0.05),见表2。
表2 观察组与对照组血浆Lp-PLA2水平比较 ![]()
2.3 不同类型斑块造影参数和血浆Lp-PLA2浓度比较 不同类型斑块血浆Lp-PLA2浓度和斑块内新生血管的增强强度、增强密度值差异均有统计学意义(P<0.05),见表3。
表3 不同类型斑块造影参数和血浆Lp-PLA2浓度比较 ![]()

*P<0.05与高度风险斑块比较 #P<0.05与中度危高风险斑块比较(SNK-q检验)
2.4 Lp-PLA2与增强密度值的相关性 Pearson相关分析显示,血浆Lp-PLA2水平与斑块内新生血管的增强密度值呈正相关(r=0.860,P<0.05)。
3 讨 论
在动脉硬化斑块里有很多高通透性的滋养血管,使血脂沉积于斑块内,进一步加速粥样硬化斑块的形成、聚积脂质,不稳定易损斑块的主要特征之一就是动脉粥样硬化斑块内的新生血管生成。斑块内新生血管形成并参与动脉粥样硬化斑块的发生发展,使其进一步破裂、出血,趋于不稳定[9]。颈动脉粥样硬化斑块的稳定性与斑块内新生血管的生成程度有关,新生血管越多,斑块的稳定性越差[10]。宁彬等[11]纳入颈动脉内膜切除术患者超声造影表现为增强回声,术后病理显示组织学可观察到新生血管分布。说明超声声学造影可以动态观察斑块内新生血管,量化评估新生血管的组织学密度。本研究借助超声造影技术,探讨血浆Lp-PLA浓度与颈动脉粥样硬化斑块内新生血管密度的相关性,旨在为Lp-PLA评估颈动脉粥样硬化易损斑块提供科学依据。
勇强等[8]研究证实,易损性斑块内的新生血管密度为稳定性斑块的2倍,对斑块易损性的评估意义深远。表明相比稳定性斑块,易损斑块内新生血管明显增多,通过检测新生血管的密度可进一步明确斑块的稳定性。本研究不同类型的斑块内血浆Lp-PLA2浓度、新生血管增强强度和增强密度值由低到高分别为低度风险斑块、中度危高风险斑块、高度风险斑块,间接说明总体上高度风险斑块内新生血管丰富,血浆Lp-PLA2浓度高,易损性可能更明显。本研究结果显示,不同回声类型斑块的血浆Lp-PLA2浓度与超声造影参数增强密度值呈正相关。表明血浆Lp-PLA2水平可反映斑块超声声学造影增强密度值,间接评估新生血管情况。一项按照斑块厚度分组行超声造影的研究表明,低回声、等回声颈动脉斑块的厚度与新生血管密度呈正相关[12]。张云华等[13]纳入急性脑梗死患者和非急性脑梗死患者,通过检测血浆Lp-PLA2水平及同步监测颈动脉斑块内新生血管证实,斑块内新生血管的显影分级与血浆 Lp- PLA2 水平呈正相关。本研究结果与相关报道一致。
越来越多的证据表明,炎症在动脉粥样硬化中起着重要的作用,炎症介质参与了粥样硬化斑块的开始、过程和最终破裂。Lp-PLA2作为一种新型的炎症标志物,参与了动脉粥样硬化斑块形成、发展和最终破裂各个阶段,在动脉粥样硬化中扮演着重要角色。Lp-PLA2主要由一些炎性细胞(如巨噬细胞、泡沫细胞等)合成和分泌,水解氧化型低密度脂蛋白,产生氧化型游离脂肪酸和溶血卵磷脂,二者引发动脉粥样硬化,与动脉粥样硬化密切相关[14-15]。一方面促使血管壁内皮细胞发生功能障碍,同时诱导内皮细胞表达黏附分子,使得巨噬细胞以及T淋巴细胞进入内膜,起动动脉硬化的发展过程,增生的内膜相对缺氧,外膜滋养血管促进新生血管形成[16];另一方面促使巨噬细胞表达促炎介质诸如白细胞介素6、肿瘤坏死因子α等,激活炎症反应,生成泡沫细胞、形成坏死核[17],此时慢性炎症、氧化脂质和蛋白酶可能进一步促进新生血管形成[16]。正因为调脂药物可通过抑制炎症介质控制炎症反应[18],故本研究所有入选患者均未服用降脂药物。
综上所述,Lp-PLA2是通过氧化低密度脂蛋白发生内皮细胞功能障碍和表达促炎介质的,从而导致动脉硬化过程的发生和促进新生血管形成。血浆Lp-PLA2水平可能是判断颈动脉粥样硬化易损斑块的一个生物学指标。但本研究样本量小,缺乏斑块内新生血管的组织学对比,故仍需进一步探讨。
[参考文献]
[1] 陈伟伟,高润霖,刘力生,等.中国心血管病报告2013概要[J].中国循环杂志,2014,29(7):487-491.
[2] 吴国斌,严臻泉,朱明,等.颈动脉斑块与缺血性脑卒中危险因素分析[J].河北医科大学学报,2015,36(1):91-93.
[3] 曲旸,赵振美,夏章勇,等.颈动脉粥样硬化斑块病理与磁共振成像技术研究进展[J].中华老年心脑血管病杂志,2014,16(8):889-892.
[4] 蒋彦彦,朱建平,孙立.超声造影评价颈动脉斑块内新生血管的应用研究[J].中国超声医学杂志,2016,32(9):776-779.
[5] 杨文慧,何燕,魏云鸿,等.超声检测颈动脉粥样硬化对冠心病的预测价值[J].中华老年心脑血管病杂志,2014,16(8):880-882.
[6] 王智军,白蓉.血清脂蛋白相关磷脂酶A2与动脉粥样硬化性脑梗死的相关性分析[J].中国实用神经疾病杂志,2017,20(2):22-24.
[7] 勇强,张蕾,王丽娟,等.颈动脉斑块风险等级的超声评价[J].血管与腔内血管外科杂志,2016,2(4):278-281.
[8] 勇强,张蕾,田菊,等.颈动脉斑块检查标准化流程[J].血管与腔内血管外科杂志,2016,2(4):269-273,268.
[9] 勇强,张蕾,冯立群,等.超声评价颈动脉易损斑块的价值[J/CD].中华医学超声杂志:电子版,2015,12(8):583-586.
[10] 陈娜燕,朱建平,周初勋,等.超声造影对不同回声类型颈动脉斑块内新生血管的分析[J].中国动脉硬化杂志,2016,24(11):1109-1114.
[11] 宁彬,何文,张东,等.斑块内新生血管分布特征的超声造影与病理对照[J].中国医学影像技术,2015,31(5):655-658.
[12] 薛红元,叶玉泉,高丽,等.应用超声造影技术对不同厚度颈动脉斑块内新生血管的评价[J].中国超声医学杂志,2016,32(6):491-493.
[13] 张云华,李杰.颈动脉斑块内新生血管显影程度及血浆Lp-PLA2水平对急性脑梗死的临床诊断价值[J].山东大学学报:医学版,2017,55(3):112-116.
[14] Bonnefont-Rousselot D. Lp-PLA2,a biomarker of vascular inflammation and vulnerability of atherosclerosis plaques[J]. Ann Pharm Fr,2016,74(3):190-197.
[15] 刘冉,郝洪军,刘琳琳,等.动脉粥样硬化斑块易损性炎性标志物及其临床意义[J].中国现代神经疾病杂志,2016,16(9):566-572.
[16] Camaré A, Pucelle M, Nègre-Salvayre A,et al. Angiogenesis in the atherosclerotic plaque[J]. Redox Biology,2017,12:18-34.
[17] 李铁威,丛祥凤,陈曦.心血管疾病生物标志物——脂蛋白相关磷脂酶A2的临床应用价值[J].中国循环杂志,2016,31(4):410-413.
[18] 解冰川,刘惠苗,时军,等.20 mg阿托伐他汀钙对无症状颈动脉不稳定斑块患者hsCRP、MMP-9的影响[J].河北医科大学学报,2016,37(7):753-756.