遗传性运动感觉神经病(hereditary motor sensory neuropathy,HMSN),又称夏科-马里-图斯病(Charcot-Marie-Tooth disease)、腓骨肌萎缩症,是遗传性周围神经病中最常见的类型,每2 500人中就有1例发病[1]。 根据临床特点、神经电生理及基因分型,将其分为Ⅰ型、Ⅱ型、Ⅳ型及Ⅹ型[2]。其临床特点为慢性进行性以双下肢为主的四肢远端肌肉无力和萎缩,无或仅有轻微的感觉障碍,其遗传方式主要为常染色体显性遗传,少数为常染色体隐性遗传、X连锁遗传。本研究对我院收治的10例HMSN患者的临床及神经电生理特点进行分析,报告如下。
1 资 料 与 方 法
1.1 一般资料 选择2010年12月— 2017年6月我院收治和确诊的HMSN患者10例,以运动发育落后起病,双下肢远端的肌无力和肌萎缩为主要表现。其中男性4例,女性6例;年龄1岁2个月~10岁,中位年龄4.6岁;病程6个月~9年。
1.2 神经电生理检查 应用丹麦Dantec公司Keypoint肌电图仪,室内安静、恒温(22~25 ℃)条件下进行周围神经传导速度及针极肌电图测定。神经传导速度检查包括:左侧正中神经、尺神经、腓总神经和右侧胫神经的运动神经传导测定;左侧正中神经和右侧腓肠神经的感觉神经传导测定。针极肌电图检查选择左侧肱二头肌、股四头肌和胫前肌。运动神经刺激部位及记录部位分别为正中神经(肘、腕,外展拇短肌)、尺神经(肘、腕,外展小指肌)、腓总神经(腘、踝,伸趾短肌)、胫神经(腘、踝,外展拇短肌)。感觉神经刺激部位及记录部位分别为正中神经(掌心,腕)、腓肠神经(小腿下部,外踝)。
1.3 基因检测 获得知情同意后,抽取患者及其父母肘部静脉血3 mL,送康旭基因检测公司。基因检测公司应用多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)、二代测序(next generation sequencing,NGS)检测技术采取panel的捕获方式进行HMSN基因检测。
2 结 果
2.1 临床表现 10例患儿均因运动发育落后、双下肢无力就诊,均为慢性起病,缓慢进展。首发症状:2例独坐晚于1岁,2岁会扶走,3岁不能独走;6例走路姿势异常,易摔跤;1例仅表现为跑跳差;1例1岁2个月能扶站,不能扶走。查体均有双下肢肌张力减低、跟腱反射消失,6例膝腱反射消失,4例双下肢远端肌肉萎缩、弓形足,2例双手肌肉萎缩,2例脊柱侧凸。智力发育均正常,4例有家族史。见表1。
表1 10例患儿的临床表现
Table 1 Clinical manifestations of 10 children

2.2 神经电生理检查结果 10例患者感觉神经均未引出反应,3例下肢及上肢运动神经均未引出反应,1例下肢运动神经未引出反应、上肢运动神经波幅减低, 3例运动神经潜伏期延长,4例上肢运动神经波幅减低,能引出反应者运动神经传导速度均明显减慢(<38 m/s),见表2。
针极肌电图显示,检30块肌肉中1块肌肉轻收缩时运动单位电位时限延长,29块肌肉轻收缩时运动单位电位时限大致正常。
表2 10例患儿的神经电生理表现
Table 2 Neural electrophysiological manifestations of 10 children

表2 (续)
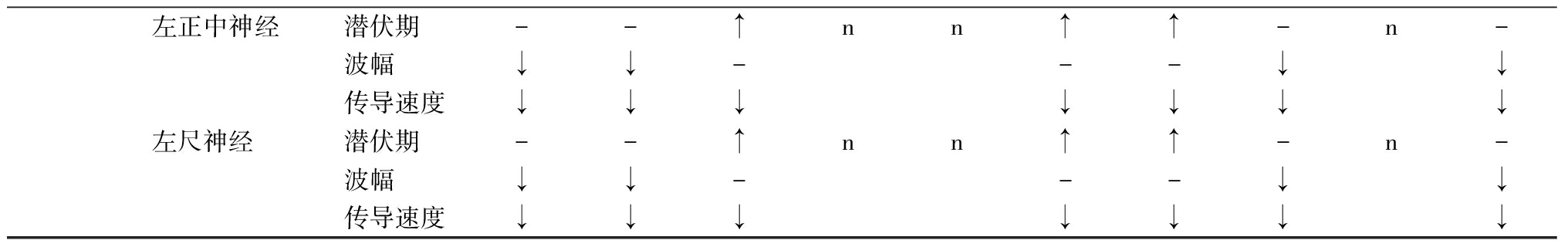
注:n未引出反应;-无明显异常;↑潜伏期延长;↓波幅减低或传导速度减慢
2.3 基因检查结果 病例3、4为PMP22基因点突变,突变方式为错义突变,其父母无相应的临床表现及基因突变(图1);病例2、8、9、10为PMP22基因重复突变,病例2、10基因突变来自于母亲,病例8、9基因突变来自于父亲,且有相似的临床表现。
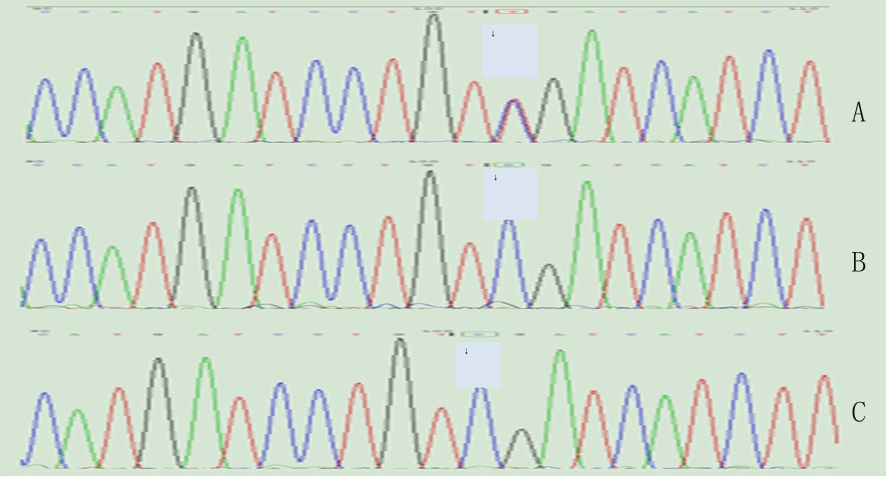
图1 病例3家系PMP22测序图,先证者出现c.215C>T的杂合核苷酸变异(↓),先证者父母未见PMP22基因突变(↓)
A.先证者;B.先证者之父;C.先证者之母
Figure 1 Case 3 family PMP22 sequence diagram, proband exhibited heterozygous nucleotide variation of c.215C>T (↓),first parents of witnesses did not have mutations in the PMP22 gene (↓)
3 讨 论
HMSN是一组遗传异质性疾病,是慢性进行性发展的神经肌肉病,可致患儿行走、跑跳等功能障碍,在某些情况下,在以后的生活中需要使用拐杖或轮椅,严重影响患儿的生活质量[3]。肌电图是重要的辅助诊断,是临床查体的延伸[4],根据尺神经的运动神经传导速度分为脱髓鞘型(HMSNⅠ型)、轴索型(HMSNⅡ型)和中间型[5]。其中,HMSNⅠ型最为常见,根据家系分子生物学又将HMSNⅠ型分为Ⅰa、Ⅰb、Ⅰc型,其中HMSNⅠa型最常见,约占70%,其与17号染色体短臂(17p11.2~12)双拷贝重复有关,此区含有PMP22的基因编码蛋白,该蛋白是位于髓鞘致密部的跨膜蛋白,占周围神经系统髓鞘蛋白的2%~5%,是其结构的一部分,能调节细胞的增殖过度表达,可抑制雪旺细胞的增殖并阻断成纤维细胞的生长,故认为PMP22基因是HMSNⅠa型的致病基因[6]。典型HMSNⅠa型者有2个发病高峰,分别是儿童期和青春期[7],慢性起病,发病年龄主要在20岁之前,尤其是10岁以前[8],主要临床表现为以双下肢为主的慢性进行性四肢远端肌肉无力和萎缩[9],典型者呈“鹤腿样”改变、弓形足和足下垂[10-11],伴无反射,走路及跑跳困难[11],下肢重于上肢,可有家族史[2,12]。其中足部畸形是HMSNⅠa患者的一个主要特征,高达90%患者表现为高足弓[7]。最初跟腱反射消失,随后其他反射相继减弱或消失。4%~35%患者出现脊柱骨骼畸形(脊柱后侧凸)[8]。虽然HMSNⅠa型是一种影响周围神经系统的疾病,但最近有关15例患者的报道描述了中枢神经系统受累,其中 73%患者白质减少,77%患者认知功能障碍[8]。说明同一基因突变可导致临床表现不同[13]。HMSNⅠa型患者腓肠神经电镜活组织检查显示,部分髓鞘肿胀、脱失,板层结构紊乱,形成葱球样结构,轴索空泡变性,说明髓鞘和轴索均有损害,以髓鞘损害为主;HMSNⅠa型可能是髓鞘形成障碍而不是脱髓鞘,即髓鞘形成延迟,髓鞘形成永远不会发生;HMSNⅠa型电生理改变为运动和感觉神经传导速度减慢,由于髓鞘生成障碍和轴索功能障碍的共同影响,上肢感觉神经动作电位波幅减低,下肢感觉神经动作电位甚至消失[14]。糖尿病和慢性炎症性脱髓鞘性多发性神经病(chronic inflammatory demyelinating polyradiculoneuropathy,CIDP)周围神经也可以呈节段性脱髓鞘样改变,应予以鉴别。通常,CIDP表现为亚急性或波动性过程,临床上CIDP肌无力更明显,无明显肌肉萎缩称“鹤腿样”表现,无高足弓表现,家族史阴性,脑脊液中蛋白水平升高[15]。病理上除周围神经节段性脱髓鞘外,尚有炎性细胞浸润,轴索多无损害或损害较轻,电生理学表现为多灶性脱髓鞘改变,用激素或丙种球蛋白治疗可有缓解。糖尿病性神经病变通常为轴索型,但也可表现出电生理学上的脱髓鞘改变[15]。与HMSN相反,糖尿病性神经病主要有感觉和自主神经表现。当HMSNⅠa型与糖尿病共患时周围神经病变的症状更加明显[16],故应注意控制血糖。既往HMSN患者多依靠神经电生理、腓肠神经活组织检查诊断。随着基因检测技术的出现及不断改进,基于基因检测的诊断更被医生和患者接受,应该在早期进行NGS分析,该分析涉及许多不同基因的并行测序,现在可用于常规诊断及早期诊断[17-20]。通过临床特点、神经电生理及基因检测相结合发现,HMSNⅠa型与PMP22基因的突变相关,最常见的是PMP22重复突变。近几年也有发现点突变的报道[21],10%的HMSNⅠa型可能发生新生突变,PMP22点突变可比重复或无义突变产生更严重的影响[6]。
本研究10例患儿中位年龄4.6岁,起病隐匿,缓慢进展,均表现运动发育落后,智力发育正常,查体双下肢肌张力减低,跟腱反射消失,6例膝腱反射消失,4例双下肢远端肌肉萎缩、弓形足,2例双手肌肉萎缩、手拿筷子及写字困难,2例脊柱侧凸,符合HMSNⅠa型的临床表现。其中足部畸形所占比例40%明显低于国外文献90%的水平[8],可能与家长对疾病越来越重视,患儿就诊早、病程短有关,长期随访有助于我国具体数据的统计。HMSNⅠa型感觉障碍不明显,可以是轻微的,通常呈手套、袜套样感觉异常,腿部比臂部更明显。大纤维感觉受累导致本体感觉丧失,造成平衡困难。小纤维感觉丧失表现为肢端冷、少汗或紫绀。本研究10例患儿均无明显感觉障碍,可能与患儿年龄尚小表述困难或病程短感觉症状轻微未引起注意有关。其中4例有家族史,致病基因分别遗传自父亲或母亲一方。神经电生理示右侧腓肠及左侧正中感觉神经均未引出反应,运动神经传导速度明显减慢,均<38 m/s,4例右侧胫神经及左侧腓总神经运动神经传导速度未引出反应,3例左侧正中及尺神经运动神经传导速度未引出反应,1例下肢运动神经未引出反应,上肢运动神经波幅减低、传导速度减慢。总结神经电生理特点为神经性损害,感觉神经受累重于运动神经受累,运动神经中下肢重于上肢。同心圆针极肌电图所检查30块肌肉中1块肌肉轻收缩时运动单位电位时限延长,29块肌肉轻收缩时运动单位电位时限大致正常。本研究10例患儿中8例双上肢无临床症状,但是神经电生理已有明显的改变,说明神经电生理改变早于临床症状出现,通过神经电生理检查可以更早地发现问题,更有利于疾病的早期诊断,避免漏诊、误诊及延误病情。由于患儿年龄小,腓肠神经活组织检查难于配合,而目前基因检测技术趋于成熟、成本降低、痛苦小,争得家长同意,其中6例患儿及其父母进行基因检测,结果发现,均为PMP22基因突变,其中4例为重复突变,突变基因遗传自其父母一方,2例为点突变,其父母基因检测未发现相关位点突变,受检者PMP22基因出现c.215C>T的杂合核苷酸变异,该变异导致p.Ser72Leu,该变异致病性已经文献报道[21]。因此,对于起病早期临床症状不典型者,神经电生理及基因检测是十分必要的,可以帮助早期诊断HMSNⅠa型。MLPA与NGS检测技术相结合可以提高基因检测的灵敏度和准确度[22]。尽管整个外显子组和全基因组测序策略有能力进一步阐明HMSN的遗传学,但仍需要不断的技术进步[22]。随着基因检测技术更广泛的应用,会有更多的病例被及时、精准地诊断,以便早期发现HMSN患者并及时进行干预,如营养神经、康复训练等治疗,对延缓病情发展、改善患儿预后、提高患儿生活质量及基因治疗方面的研究等至关重要。如果将基因检测技术应用于人类遗传的咨询,做好产前筛查和诊断,避免病儿的出生,对整个家庭及社会亦有重大的意义。
[参考文献]
[1] Miller LJ,Saporta AS,Sottile SL,et al. Strategy for genetic testing in Charcot-Marie-disease[J]. Acta Myol,2011,30(2):109-116.
[2] Fridman V,Bundy B,Reilly MM,et al. CMT subtypes and disease burden in patients enrolled in the Inherited Neuropathies Consortium natural history study:a cross-sectional analysis[J]. J Neurol Neurosurg Psychiatry,2015,86(6):873-878.
[3] Werheid F,Azzedine H,Zwerenz E,et al. Underestimated associated features in CMT neuropathies: clinical indicators for the causative gene? [J].Brain Behav,2016,6(4):e00451.
[4] 曹亚坤,郭卫东,王立民,等.高频超声与肌电图诊断尺神经肘管综合征的临床研究[J].河北医科大学学报,2016,37(9):1051-1054,1059.
[5] 朱梦楚.腓骨肌萎缩症相关致病基因初步研究[J].医药前沿,2016,6(19):105-106.
[6] Hara T,Hashimoto Y,Akuzawa T,et al.Rer1 and calnexin regulate endoplasmic reticulum retention of a peripheral myelin protein 22 mutant that causes type 1A Charcot-Marie-Tooth disease[J]. Sci Rep,2014,4:6992.
[7] 董庆,李海峰,陈彤,等. 中西医结合治疗腓骨肌萎缩症1例[J].实用中医药杂志,2015,31(5):463.
[8] Bienfait HM,Verhamme C,van Schaik IN,et al. Comparison of CMT1A and CMT2: similarities and differences[J]. J Neurol,2006,253(12):1572-1580.
[9] 郭司文,安英俊,李平,等.腓骨肌萎缩症导致呼吸衰竭1例[J].中国实用医药,2016,11(24):215-216.
[10] Timmerman V,Strickland AV,Züchner S. Genetics of Charcot-Marie-Tooth(CMT) disease within the frame of the human genome project success[J]. Genes(Basel),2014,5(1):13-32.
[11] Ekins S,Litterman NK,Arnold RJ,et al. brief review of recent Charcot-Marie-Tooth research and priorities[J]. F1000Res,2015,4:53.
[12] van Paassen BW,van der Kooi AJ,van Spaendonck-Zwarts KY,et al. PMP22 related neuropathies:Charcot-Marie-Tooth disease type 1A and Hereditary Neuropathy with liability to Pressure Palsies[J]. Orphanet J Rare Dis,2014,9:38.
[13] Eggermann K,Gess B,Häusler M,et al.Hereditary Neuropathies[J]. Dtsch Arztebl Int,2018,115(6): 91-97.
[14] Verhamme C,King RH,ten Asbroek AL,et al. Myelin and axon pathology in a long-term study of PMP22-overexpressing mice[J]. J Neuropathol Exp Neurol,2011,70(5):386-398.
[15] Latov N.Biomarkers of CIDP in patients with diabetes or CMT1[J]. J Peripher Nerv Syst,2011,16(Suppl 1):14-17.
[16] Ursino G,Alberti MA,Grandis M,et al.Influence of comorbidities on the phenotype of patients affected by Charcot-Marie-Tooth neuropathy type 1A[J]. Neuromuscul Disord,2013,23(11):902-906.
[17] Rudnik-Schoneborn S,Auer-Grumbach M,Senderek J. Hereditary neuropathies: update 2017[J].Neuropediatrics,2017,48(4):282-293.
[18] Bansagi B,Griffin H,Whittaker RG,et al. Genetic heterogeneity of motor neuropathies[J]. Neurology,2017,88(13):1226-1234.
[19] Kurth I. Sensory and autonomic neuropathies and pain-related channelopathies[J]. Schmerz,2015,29(4):445-457.
[20] Rudnik-Schöneborn S,Tölle D,Senderek J,et al. Diagnostic algorithms in Charcot-Marie-Tooth neuropathies: experiences from a German genetic laboratory on the basis of 1206 index patients[J]. Clin Genet,2016,89(1):34-43.
[21] Baets J,Deconinck T,de Vriendt E,et al.Genetic spectrum of hereditary neuropathies with onset in the first year of life[J]. Brain,2011,134(Pt 9):2664-2676.
[22] Hoyle JC,Isfort MC,Roggenbuck J,et al. The genetics of Charcot-Marie-Tooth disease: current trends and future implications for diagnosis and management[J]. Appl Clin Genet,2015,8:235-243.