多发性骨髓瘤(multiple myeloma,MM)是B细胞起源的恶性浆细胞克隆增生性疾病,中老年人多见,其病因至今尚不清楚,发病迅速,预后亦较差。因此,对MM开展系统研究,提高其诊断效率,讨论影响预后的因素,已成为血液科近年研究的热点。MM的诊断主要依靠骨髓形态学、血清免疫球蛋白并结合临床表现确诊。由于骨髓瘤细胞表面分化抗原表达呈现高度异质性[1],骨髓瘤细胞在骨髓中分布不均匀,有些患者的临床表现不典型,这均给临床诊断带来了一定的困难。通过在MM诊断中的应用,流式细胞术免疫表型分析越来越受到广大研究者的关注。它能快速、准确、客观地反映骨髓瘤细胞的生物学特性,提高MM的诊断水平,从而有利于临床治疗。本研究对97例MM患者骨髓细胞的免疫表型特点及其与血清免疫球蛋白分型、临床分期、年龄及预后关系进行探讨,以期为临床提供正确的早期诊断、制定合理的治疗措施及为判断预后提供依据。
1 资 料 与 方 法
1.1 一般资料 选择2005年1月—2016年6月在河北医科大学第二医院血液科收治的MM患者97例。诊断均符合张之南《血液病诊断及疗效标准》[2]。其中男性61例,女性36例,年龄27~81岁,中位年龄61岁,诊断时27~50岁21例(21.7%),>50~65岁46例(47.4%),>65岁30例(30.9%)。
1.2 细胞形态学及免疫分型 标本的采集:根据细胞形态学基本原理,对无菌条件下采集的骨髓液进行观察分析,对用抗凝管分离的单个核细胞进行免疫分型。流式细胞仪检测:应用FACSCantoⅡ型流式细胞仪(美国BD公司生产)检测CD38、CD19、CD56、CD138、CD20、CD117抗原表达情况。阳性判断标准:骨髓瘤细胞表面抗原表达>20%。
1.3 疗效标准 总体生存时间(overallsurvival,OS)定义为自确诊时间至死亡或末次随访时间为止。无事件生存时间(event-freesurvival,EFS)定义为自确诊时开始至复发、死亡时间为止,无上述事件发生者计算至末次随访时间。未达完全缓解的患者无事件生存时间定义为自确诊日开始计算至疾病进展或死亡时间为止。总反应率(overall response rate,ORR)=[完全缓解(complete response,CR)+非常好的部分缓解(very good partial response,VGPR)+部分缓解(partial response,PR)]例数/总例数。病例随访截止时间:2016年12月1日。
1.4 统计学方法 应用SPSS 20.0统计学软件分析数据。计数资料比较采用χ2检验;生存分析采用Kaplan-Meier生存曲线,双侧Log-rank检验分析不同组间生存情况。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 97例MM患者,男性61例(62.9%),女性36例(37.1%),其中IgG型46例(47.4%)、IgA型25例(25.8%)、轻链型18例(18.6%)、IgD型8例(8.2%)。诊断时临床分期:Ⅰ期8例(8.2%)、Ⅱ期18例(18.6%)、Ⅲ期71例(73.2%)。骨髓瘤细胞免疫表型分析及遗传学:CD38阳性MM 95例(97.9%)、CD138阳性MM 95例(97.9%)、CD19阳性MM 6例(6.2%)、CD56阳性MM患者62例(63.92%)、CD117+MM 30例(30.9%)。
2.2 骨髓瘤细胞免疫表型与不同M蛋白类型关系 IgG型最高、IgA型及轻链型次之、IgD型最低。不同M蛋白类型的MM患者CD56阳性率表达差异有统计学意义(P<0.05),提示IgG型MM的CD56阳性表达率最高;骨髓瘤细胞免疫表型CD38、CD138、CD19、CD117阳性表达率在不同M蛋白类型之间无明显差别(P>0.05)。见表1。
表1 免疫表型阳性表达率与M蛋白类型关系
Table 1 The relationship between the positive expression of immune phenotype and the type of monoclonal protein (例数,%)
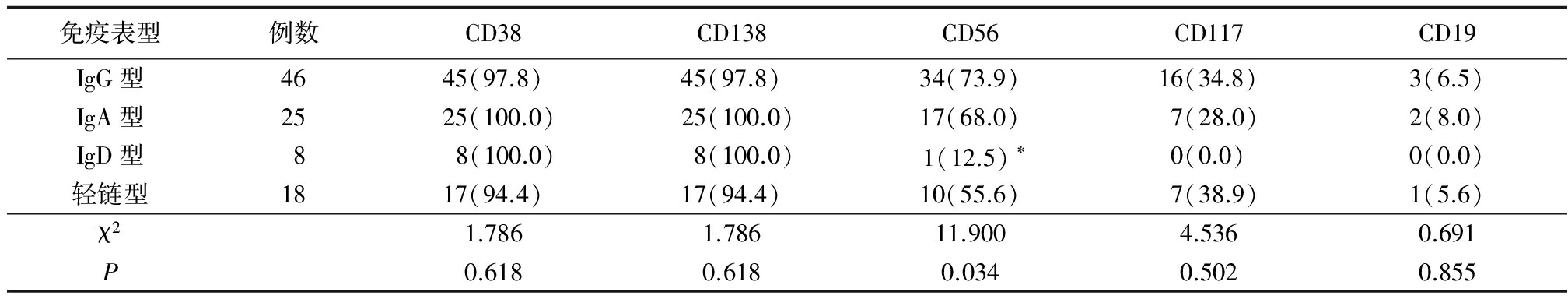
*P<0.05与IgG型比较(χ2检验)
2.3 骨髓瘤细胞CD56表达情况与生存分析 随访截至时间:2016年12月1日,随访时间4~78个月,中位随访时间29个月。
2.3.1 CD56阳性和阴性患者OS和EFS分析 CD56阳性是预后良好指标,CD56阳性MM患者3年OS率、EFS率(60.7%、45.1%)均高于CD56阴性MM患者(25.2%、15.2%),差异有统计学意义(P<0.05),见图1,2。
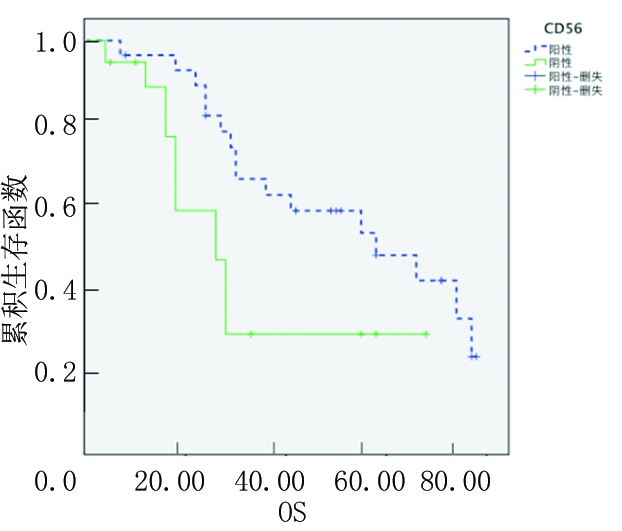
图1 CD56阳性和阴性患者OS的Kaplan-Meier生存曲线
Figure 1 The Kaplan-Meier survival curves of OS in patients with CD56 positive and negative
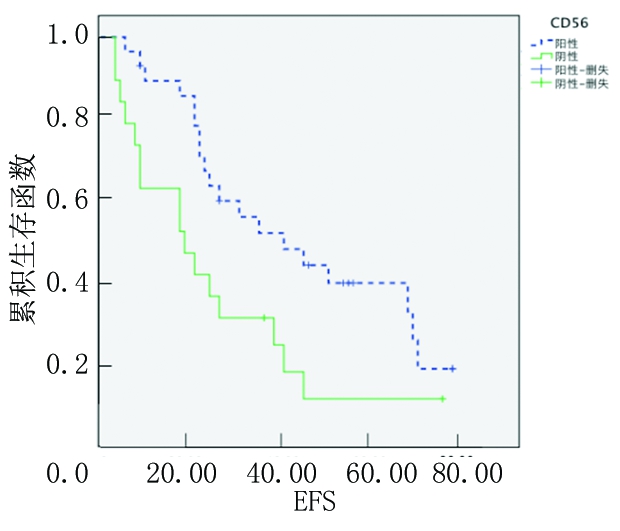
图2 CD56阳性和阴性患者EFS的Kaplan-Meier生存曲线
Figure 2 The Kaplan-Meier surival curves of EFS in patients with CD56 positive and negative
2.3.2 按年龄分组CD56阳性和阴性患者OS分析 将所有患者按照年龄>60岁、≤60岁分为2组。年龄>60岁组CD56阳性MM患者3年OS率(60.9%)高于CD56阴性MM患者(20.0%),差异有统计学意义(P<0.05);而年龄≤60岁组二者3年OS率差异无统计学意义(P>0.05)。见图3,4。
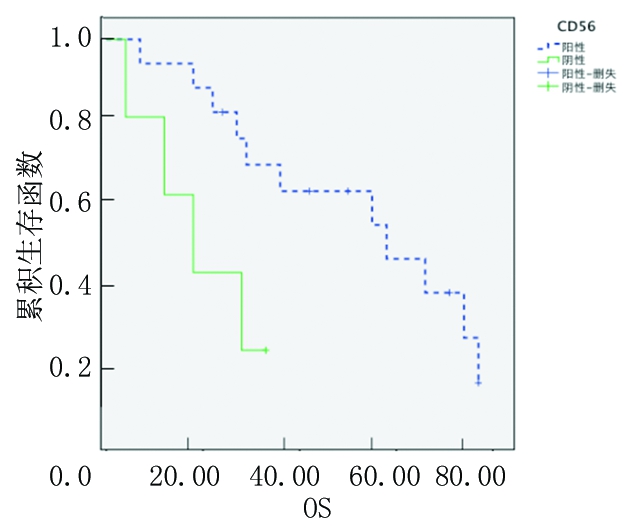
图3 CD56阳性和阴性中年龄>60岁组患者OS的Kaplan-Meier生存曲线
Figure 3 The Kaplan-Meier survival curves of OS in>60 years old group patients with CD56 positive and negative
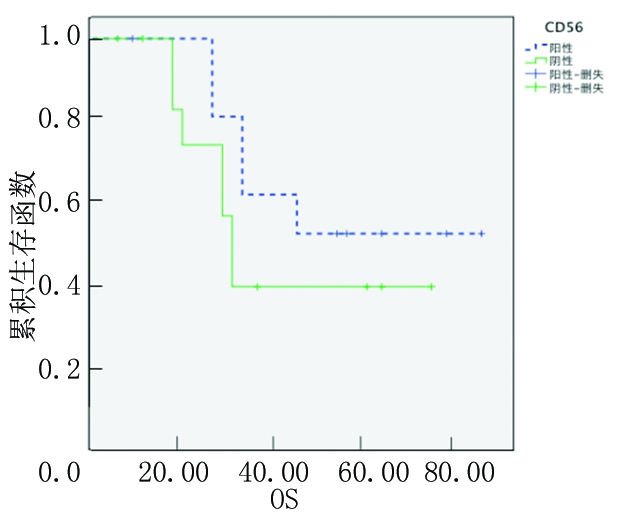
图4 CD56阳性和阴性中年龄≤60岁组患者OS的Kaplan-Meier生存曲线
Figure 4 The Kaplan-Meier survival curves of OS in≤60 years old group patients with CD56 positive and negattive
2.3.3 按分期分组CD56阳性和阴性患者OS分析 按照Ⅲ期、Ⅱ期将患者分为2组,Ⅲ期CD56阳性MM患者3年OS率(48.3%)高于CD56阴性MM患者(18.3%),差异有统计学意义(P<0.05);而Ⅱ期二者3年OS率差异无统计学意义(P>0.05)。见图5,6。
2.4 骨髓瘤细胞CD117表达情况与生存分析 随访截至时间:2016年12月1日,中位随访时间23个月。其中CD117阳性9例,CD117阴性23例。CD117阳性MM患者3年OS率、EFS率(65.2%、44.4%)均高于CD117阴性MM患者(25.3%、10.6%),差异有统计学意义(P<0.05),见图7,8。
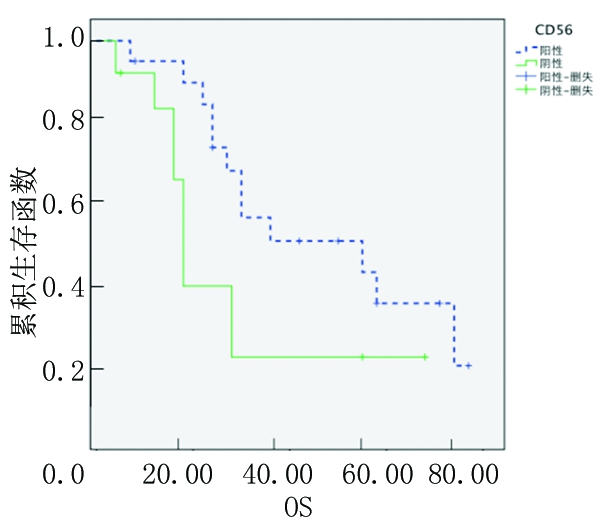
图5 CD56阳性和阴性Ⅲ期患者的Kaplan-Meier生存曲线
Figure 5 The Kaplan-Meier survival curves of phase Ⅲ in patients with CD56 positive and negative
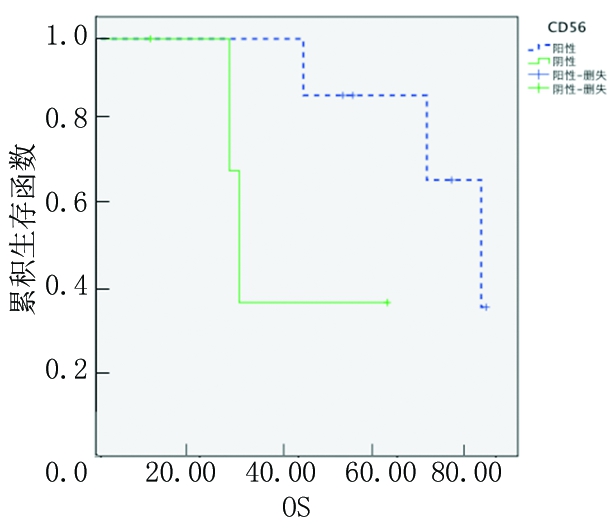
图6 CD56阳性和阴性Ⅱ期患者的Kaplan-Meier生存曲线
Figure 6 The Kaplan-Meier survival curves of phase Ⅱ in patients with CD56 positive and negative
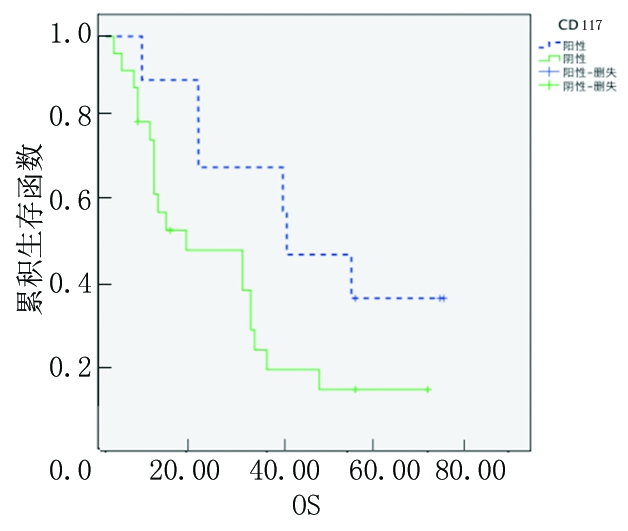
图7 CD117阳性和阴性患者OS的Kaplan-Meier生存曲线
Figure 7 The Kaplan-Meier surival curves of OS in patients with CD117 positive and negative
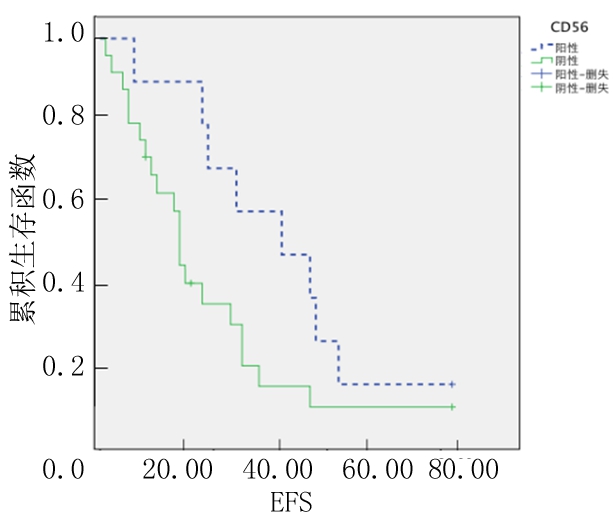
图8 CD117阳性和阴性患者EFS的Kaplan-Meier生存曲线
Figure 8 The Kaplan-Meier survival curves of EFS in patients with CD117 positive and negative
3 讨 论
MM的特点是单克隆的浆细胞在骨髓中异常增殖,并广泛浸润骨骼和软组织,破坏骨髓造血功能,分泌单克隆免疫球蛋白或轻链,正常多克隆浆细胞增生和多克隆免疫球蛋白分泌受到抑制,引起一系列临床表现。其常见于中、老年人,其中以50~60岁者为多,并且男性多于女性。其病因至今尚不清楚,发病迅速,预后亦较差。伴随着人口老龄化的进程,MM的发病率和病死率亦有明显增加的趋势[3-4]。近年来,随着单克隆抗体在临床的应用及流式细胞术的快速发展,流式细胞术已经成为MM诊断和分型的重要依据,它能快速、准确、客观地反映骨髓瘤细胞的生物学特性,提高MM的诊断水平,同时指导治疗和提示预后[5]。
本研究中97例MM患者肿瘤细胞CD38、CD138强表达,66.7%MM表达CD56,约1/3表达CD117,仅少数表达CD19、CD20,其中CD56阳性表达率在IgG型MM最高。如张金巧等[6]认为CD138是最特异的骨髓瘤细胞表面标记物。冯睿婷等[7]报道MM的浆细胞主要表达CD138,比正常浆细胞表达水平更高。He等[8]证实MM患者CD138在骨髓瘤细胞表达率几乎达100%。本研究结果与相关报道一致。CD56是免疫球蛋白超家族的重要成员。有研究显示,CD56在MM患者瘤细胞的表达率约60%,其介导了瘤细胞的归巢,并且在疾病治疗过程中可上调或下调[9-12]。Gupta等[13]报道约78%MM患者表达CD56,而来源于正常骨髓或淋巴结的正常浆细胞均无CD56的表达,并指出CD56阴性MM临床进展往往具有更强的侵袭性;与CD56阳性MM相比,CD56阴性MM具有尿本周蛋白及血浆β2微球蛋白较高、血小板减少、多伴有肾功能不全、易出现贫血(60% vs 36%)、髓外浸润多见(47% vs 7%)及易进展的特点,OS明显短暂(分别为22个月和63个月,P=0.000)。表明CD56阴性是更有意义的一项负相关预后指标,CD56阳性预后好于CD56阴性。
本研究中CD56阳性MM患者中位OS、3年OS率及3年EFS率(58个月、60.7%、45.1%)均长于或高于CD56阴性MM患者(26个月、25.2%、15.2%)。表明CD56阳性是预后良好因素,与相关文献结论相符。但从年龄层面分析,对于年龄>60岁患者,CD56阳性MM患者3年OS率较高,是预后较好指标;而对于年龄≤60岁患者,CD56表达与否与预后无关。从分期层面分析,对于Ⅲ期患者,CD56阳性MM患者3年OS率较高,是预后较好指标;而对于Ⅱ期患者,CD56表达与否与预后无关。这可能与就诊时年龄较大、多数处于Ⅲ期、Ⅱ期样本量较少、患者个体异质性大、对化疗敏感有关。
CD117是一种酪氨酸激酶,其表达与酪氨酸激酶的活化相性。CD117在正常浆细胞不表达,约在30%的骨髓瘤患者中异常表达[14]。按照CD28和CD117的表达情况可将预后分为3个层次:CD28阳性CD117阴性预后差;CD28阴性CD117阴性或CD28阳性CD117阳性预后中等;CD28阴性CD117阳性预后良好。由此可见,CD117阳性是预后良好的标志,这与Bila等[15]及Butrym等[16]的研究结果相符合。
本研究中CD117阳性MM患者中位OS、3年OS率及3年EFS率(45个月、65.2%、44.4%)均长于或高于CD117阴性MM患者(20个月、25.3%、10.6%)(P<0.05)。表明CD117阳性预后较好,与相关文献结果相符。此外,CD117表达与临床分期、免疫球蛋白分型及疗效均无关,这与唐海龙等[17]和Zang等[18]研究结果一致。
流式细胞术免疫表型分型广泛应用于血液系统恶性肿瘤的诊断和预后评价,可以准确识别骨髓瘤细胞的免疫表型特点[19-21],有助于MM的诊断、分型、预后判断等,在MM基础研究与临床实践中不可或缺,其弥补了传统形态学诊断的不足,揭示了多种抗原表达的异质性及生物学特性,对不同阶段个体化治疗有很大的指导意义。国内外的研究者还没有对流式细胞术检测MM形成统一的认识,导致检测结果千差万别,这给MM的诊断带来了很大的麻烦。因此,亟待研究者开展相关课题研究,一旦拥有了统一的技术标准体系,流式细胞术必将会拥有更为广阔的应用前景。MM患者免疫表型的评估可联合CD20、CD28等抗原,并动态监测骨髓瘤细胞抗原表达的变化,这对临床预后判断及临床治疗有重要指导意义。
本研究结果表明:①MM患者瘤细胞有B细胞抗原表达,但所占比重不大;②就CD56表达阳性率而言,IgG型最高,不同临床分期、不同年龄对骨髓瘤细胞免疫表型阳性表达率影响不大;③CD56阳性者预后良好,特别是对于老年患者或者临床分期较高的MM,CD56阳性是预后较好指标;④CD117阳性患者生存率较高,预后良好。
[参考文献]
[1] 侯健,傅卫军.多发性骨髓瘤及其相关疾病[M].上海:上海科学技术出版社,2002:6-10.
[2] 张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2012:232-235.
[3] 张金巧,方洁,王娟,等.新诊断多发性骨髓瘤556例骨科误诊的流行病学分析[J].河北医科大学学报,2013,34(8):944-945.
[4] 郭晓楠,王园园,李琰,等.多发性骨髓瘤发病时伴或不伴骨痛患者临床及实验室特征的流行病学调查[J].河北医科大学学报,2013,34(8):946-947.
[5] Tavares SMQMC,Junior WLB,Silva MRL. Normal lymphocyte immunophenotype in an elderly population[J]. Revista Brasileira de Hematologiae Hemoterapia,2014,36(3):180-183.
[6] 张金巧,方洁,王园园,等.多发性骨髓瘤影像学误诊分析[J].河北医科大学学报,2013,34(8):949-950.
[7] 冯睿婷,李秀明,赵继智.流式细胞术在多发性骨髓瘤诊断中的应用研究[J].临床医药文献杂志,2015,2(5):824-827.
[8] He HY,Fu WJ,Jiang H,et al. The clinical characteristics and prognosis of IGH deletion in multiple myeloma[J]. Leukemia Res,2015,39(5):515-519.
[9] Furuzawa-Carballeda J,Bostock IC,Lima G,et al. Immunophenotyping of peripheral immunoregulatory as well as Th17A and Th22 cell subpopulations in kidney transplant recipients under belatacept or cyclosporine treatment[J]. Transpl Immunol,2014,30(2):107-113.
[10] Gale G,Östman S,Saalman R,et al. Immunophenotypes in orofacial granulomatosis with and without Crohn′s disease[J]. Med Oral Patol Oral Cir Bucal,2014,19(6):e584-591.
[11] Hou JM,Lin JL,Wen JP,et al. Immunohistochemical identification of osteoclasts and multinucleated macrophages[J]. Cell Immunol,2014,292(1):53-56.
[12] Silva JES,Grano FG,Melo GDD ,et al. Immunophenotyping of CD3+ CD4- CD8- T Lymphocytes in Lymph Nodes of Dogs with Visceral Leishmaniasis[J]. J Comp Pathol,2014,150(1):102.
[13] Gupta N,Khan R,Kumar R,et al. Versican and its associated molecules: Potential diagnostic markers for multiple myeloma[J]. Clin Chim Acta,2015,442(10):119-124.
[14] Waack N,Borghesi J,Will S,et al. Culture and immunophenotyping of yolk sac progenitor cells of Cavia porcellus(Rodentia,Caviidae)[J]. Placenta,2014,35(9):A94.
[15] Bila J,Jelicic J,Djurasinovic V,et al. Prognostic Effect of Comorbidity Indices in Elderly Patients With Multiple Myeloma[J]. Cl Lymph Myelom Le,2015,15(7):416-419.
[16] Butrym A,Rybk J,Lacina P,et al. Polymorphisms within beta-catenin encoding gene affect multiple myeloma development and treatment[J]. Leukemia Res,2015,9(12):1462-1466.
[17] 唐海龙,舒汨汨,董宝侠,等.CD117 表达对多发性骨髓瘤患者化疗反应的影响[J].中国实验血液学杂志,2015,23(5):1346-1351.
[18] Zang MR,Li ZJ,Liu LT,et al. Anti-tumor activity of the proteasome inhibitor BSc2118 against human multiple myeloma[J]. Cancer Lett,2015,366(2):173-181.
[19] Shpilberga KA,Esses SJ,Fowkes ME,et al. Imaging of extraosseous intracranial and intraspinal multiple myeloma,including central nervous system involvement[J]. Clin Imag,2015,39(2):213-219.
[20] Kawamura K,Takamatsu H,Ikeda T,et al. Cord Blood Transplantation for Multiple Myeloma: A Study from the Multiple Myeloma Working Group of the Japan Society for Hematopoietic Cell Transplantation[J]. Biol Blood Marrow Tr,2015,21(7):1291-1298.
[21] Yavasoglu I,Sargin G,Kadikoylu G,et al. Immunohistochemical evaluation of CD20 expression in patients with multiple myeloma[J]. Revista Brasileira de Hematologiae Hemoterapia,2015,37(1):34-37.