近年来,不孕不育夫妇的数量日益增多,人类辅助生殖技术在临床上得到广泛的应用,促进卵母细胞发育、成熟等生理过程,仍是辅助生殖技术中重要的一环。骨发生形态蛋白9(bone morphogenetic protein-9,BMP-9)是BMP家族中的一种,在大鼠颗粒细胞中BMP-9对类固醇激素生成存在一定作用,BMP-9对颗粒细胞卵泡刺激素(follicle-stimulating hormone,FSH)诱导的孕酮(progesterone,P)的分泌有抑制作用,但对颗粒细胞FSH诱导的雌二醇(estradiol,E2)的分泌无明显作用。前期实验已证实,BMP-9 mRNA及蛋白在人类卵巢颗粒细胞中均有表达。BMP-9高表达可提高优质胚胎率、卵子利用率,说明BMP-9参与了生殖系统的调节,可以调控卵母细胞成熟,提高卵母细胞质量。在卵母细胞发育、成熟过程中,颗粒细胞类固醇激素起着重要的作用。本研究旨在探讨BMP-9对颗粒细胞E2、P分泌功能的影响。
1 资 料 与 方 法
1.1 标本来源 选择2017年4—5月于河北医科大学第四医院生殖中心接受常规体外受精-胚胎移植(in vitro fertilization embryo transfer,IVF-ET)助孕治疗,采用卵泡期长方案控制性促排卵治疗的120例患者为研究对象。
本研究经医院伦理委员会审批通过并备案;患者均签署知情同意书。
1.2 纳入标准和排除标准 纳入标准:①符合不孕症的诊断,有IVF指征;②不孕的原因主要是女方输卵管因素;③月经周期规律,排卵功能正常,月经来潮第2~3 d基础FSH水平<10 U/L,基础黄体生成激素水平<10 U/L;④适合长方案治疗者,即年龄<38周岁的育龄期妇女,前次常规刺激获得卵子>3个,窦卵泡数≥7个。排除标准:①卵巢低反应者(博洛尼亚标准),即高龄(≥40岁)或具备卵巢低反应的任何危险因素,前次常规刺激获得卵子≤3个,卵巢储备下降(窦卵泡数<7个),或抗苗勒管激素<0.5 μg/L;②排除高血压、糖尿病、甲状腺疾病等内分泌疾病;③排除子宫畸形、子宫内膜异位症、子宫黏膜下肌瘤;④患有其他器质性疾病;⑤夫妇一方出现染色体异常。
1.3 颗粒细胞的分离、培养 行IVF-ET患者在超声引导下经阴道取卵。因每例患者卵泡液中颗粒细胞数量有限,实验选择收集当日所有符合标准的卵泡液,混合后进行分离与培养。将收集的全部卵泡液放置于50 mL离心管中,3 000 r/min离心10 min,弃去上清液,将细胞悬液缓慢加入装有等体积Percoll分离液的试管中,1 500 r/min离心30 min。吸取白色絮状的颗粒细胞转移至另一离心管中,加入等体积PBS进行漂洗,1 000 r/min离心10 min,弃去上清液。用0.25%胰蛋白酶液悬浮沉淀,置于37 ℃、体积分数5%CO2培养箱中孵育10 min;加入含体积分数10%牛血清的DMEM/F12培养液(含100 U/mL青/链霉素)培养液终止消化。3 000 r/min离心5 min,弃上清液,收集颗粒细胞。用DMEM/F12培养液(不含牛血清)制成单细胞悬液,台盼蓝染色计数活细胞,证明颗粒细胞的存活率>90%时,以50×104/m2的密度将颗粒细胞按要求接种于24孔板内;在37 ℃、体积分数为5%及完全饱和湿度条件下的CO2培养箱中培养24 h,观察细胞贴壁情况。
1.4 颗粒细胞的纯度鉴定 依据FSH受体仅在人颗粒细胞中表达这一特性,采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)法观察FSH受体阳性细胞所占比例,阳性细胞胞质呈现出棕黄色,当所提取的人颗粒细胞纯度约为90%时符合实验要求,可用于后续实验。
1.5 培养液中E2、P的测定 向24孔板中各加入1 mL颗粒细胞悬液进行接种,培养细胞待其贴壁后,随机加入1 mL含不同浓度的BMP-9(0、3、6、12 μg/L)单独或与FSH 75 U/mL联合培养的DMEM/F12培养液(不含牛血清),每组各设3个复孔。放入培养箱中继续培养,培养72 h后取上清液。上述实验在不同时间重复操作4次。所收集的上清液冻存,待全部收集后同期采用酶联免疫吸附测定法测定各组上清液中的E2、P的浓度,每组样本量为12。
1.6 E2生成相关因子芳香酶化P450(aromatase P450,P450 arom)蛋白、P生成相关因子类固醇急性调节蛋白(steroidogenic acute regulatory protein,StAR)蛋白的表达 在颗粒细胞中加入细胞裂解液,放置冰上 40 min。4 ℃离心8 800 r/min离心10 min,收集上清液,即为蛋白质。用蛋白定量测定试剂盒进行蛋白浓度测定,总蛋白上样量50 μg,计算出上样量。置备10%的SDS-PAGE分离胶,将蛋白质(50 μg)加入5×上样缓冲液中,100 ℃加热10 min,使蛋白变性。冷却后将蛋白加入加样孔内进行SDS-PAGE电泳。用湿式电转移法将蛋白转移至PVDF膜上。丽春红染色观察转膜情况。转膜完毕后取出PVDF膜,室温置于含5%脱脂奶粉的TBST封闭液中2 h。TBST洗膜10 min,重复3次。将封闭后的PVDF膜分别加入兔抗人P450 arom抗体(1∶500)、兔抗人StAR抗体(1∶1 000)及β-actin抗体(1∶3 000),摇床室温孵育1 h,4 ℃过夜。将PVDF膜放入TBST中,室温洗膜15 min,重复3次。将PVDF膜放入过氧化物酶标记的二抗(1∶1 000)溶液中,摇床室温孵育2 h。TBST室温洗膜5 min,重复3次。显色、定影及显影。双色红外激光扫描器进行扫描。
1.7 统计学方法 应用SPSS 21.0统计软件处理数据。计量资料比较分别采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 黄素化颗粒细胞的鉴定 FSH受体阳性染色定位于细胞膜和细胞质,呈棕黄色着染,细胞核呈深蓝色(图1),镜下可见FSH受体的阳性率>90%。表明分离培养的卵泡颗粒细胞纯度达到90%以上。
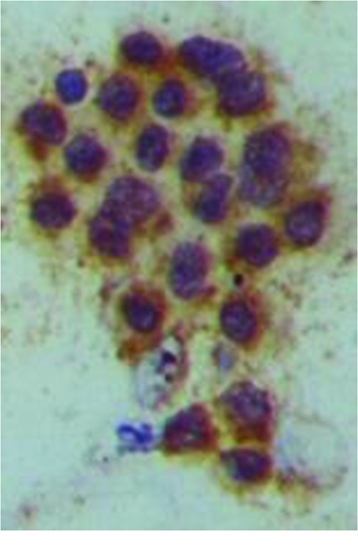
图1 对颗粒细胞的鉴定(SP ×400)
Figure 1 Identification of granulosa cells(SP ×400)
2.2 FSH对不同浓度BMP-9组分泌E2和P浓度的影响 单独BMP-9培养时,BMP-9各浓度组分泌的E2和P浓度变化不大,差异均无统计学意义(P>0.05);加入FSH后,BMP-9各浓度组分泌的E2变化不大, 而P浓度则随着BMP-9浓度的增加,出现下降趋势,各浓度组间差异均有统计学意义(P<0.05)。见表1。
表1 不同浓度BMP-9单独及与FSH共培养下黄素化颗粒细胞培养上清液中E2、P水平
Table 1 Level of E2 and P in culture supernatants of lypxified granules cultured with different concentrations of BMP-9 alone and co-cultured with FSH ![]()
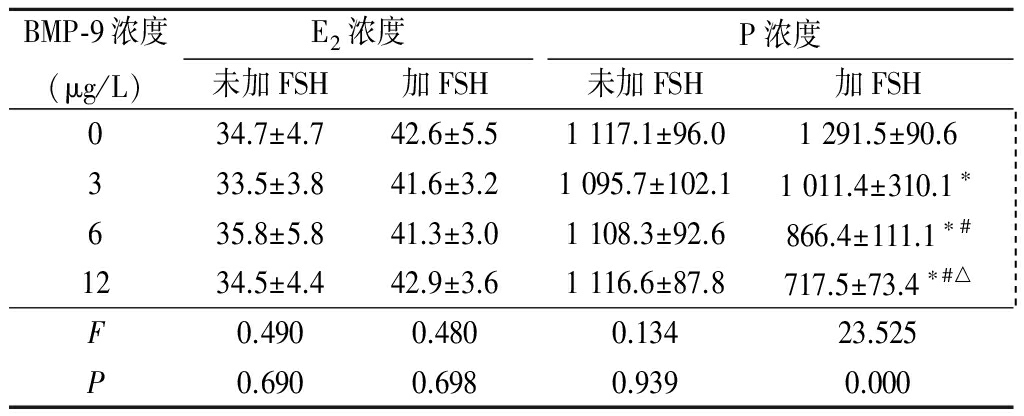
*P<0.05与0 μg/L比较 #P<0.05与3 μg/L比较 △P<0.05与6 μg/L比较(SNK-q检验)
2.3 FSH对不同浓度BMP-9分泌P450 arom蛋白和StAR蛋白的影响 单独BMP-9培养时,E2生成相关因子P450 arom蛋白、P生成相关因子StAR蛋白表达水平在BMP-9各浓度组变化不大,各组间差异无统计学意义(P>0.05);加入FSH后,BMP-9各浓度组分泌的P450 arom蛋白变化不大, 而StAR蛋白浓度则随着BMP-9浓度的增加,出现下降趋势,各浓度组间差异均有统计学意义(P<0.05)。见表2,图2,3。
表2 不同浓度BMP-9单独培养时对P450 arom、StAR蛋白表达水平的影响
Table 2 Effects of different concentrations of BMP-9 on the expression of P450 arom and StAR Proteins ![]()
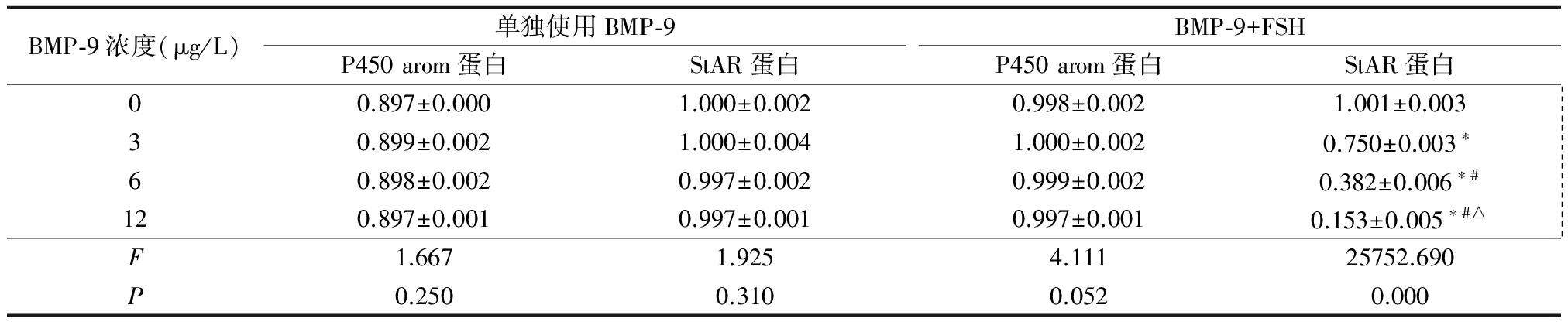
*P<0.05与0 μg/L比较 #P<0.05与3 μg/L比较 △P<0.05与6 μg/L比较(SNK-q检验)
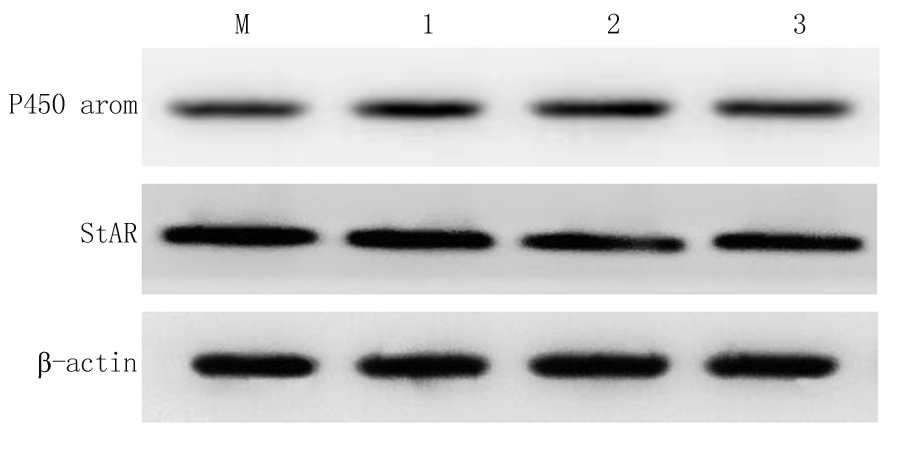
图2 不同浓度BMP-9单独培养下P450 aron、StAR的相对表达量
M.0 μg/L;1.3 μg/L;2.6 μg/L;3.12 μg/L
Figure 2 The relative expression of P450 aron and StAR cultured with different concentrations of BMP-9
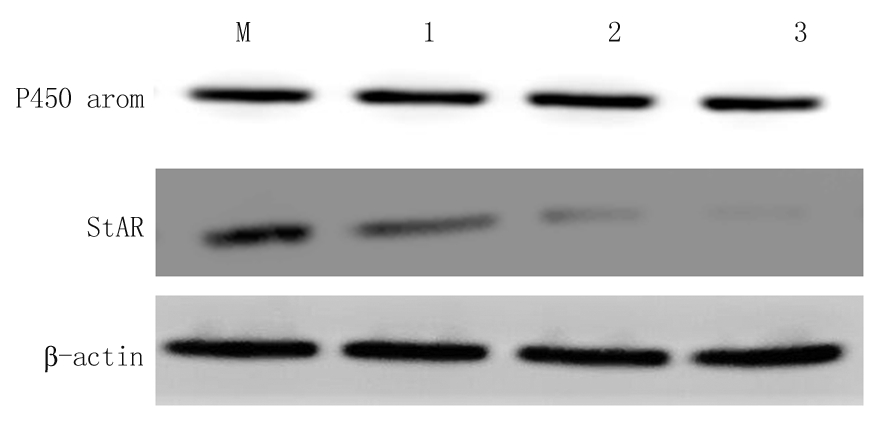
图3 不同浓度BMP-9联合FSH共培养下P450 arom、StAR的相对表达量
M.0 μg/L;1.3 μg/L;2.6 μg/L;3.12 μg/L
Figure 3 The relative expression of P450 arom and StAR under the co-culture of different concentrations of BMP-9 and FSH
3 讨 论
女性卵巢的核心功能单位是卵泡,卵母细胞与颗粒细胞、卵丘细胞间以及卵丘颗粒细胞和壁层颗粒细胞间都存在着广泛的缝隙连接,相互进行信息交流,构成了一个统一的整体[1]。颗粒细胞伴随卵母细胞完成激活、生长发育、成熟排卵等生理过程,并在这个过程中发挥重要作用[2-3]。
体外培养的细胞首先应该做细胞的鉴定,有文献报道卵巢颗粒细胞是女性体内唯一表达FSH受体的细胞,并且FSH受体的数量与受精率、卵裂率和妊娠率相关。因此,本研究以FSH受体的表达作为颗粒细胞的鉴定标准。在培养的细胞中,FSH受体阳性率可达到90%以上,使获得的实验数据更加可信。
BMP是转化生长因子β(transforming growth actor-β,TGF-β)超家族的多效性成员[4],除BMP-1外,其他所有BMP均属于TGF-β[5],BMP家族各成员生物活性基本相同,属于高度保守的糖蛋白[6],以自分泌或旁分泌的方式起作用[7],涉及包括增殖、分化和存活等生物活性,故在胚胎学,组织再生和癌症中起重要作用[8-9]。BMP家族广泛作用于卵巢生殖细胞并呈特异性,在卵泡生长发育和黄体形成中呈动态变化[10]。已知FSH对卵泡的生长、募集及排卵前阶段分化的刺激作用非常重要,但单纯FSH尚不足以促进卵泡发育直至排卵,FSH必须与胰岛素样生长因子1、TGF-β及活化素等相互作用,进行优势卵泡的选择。
在目前已知的BMP家族中,BMP-9是成骨能力最强的骨形态发生蛋白[11]。BMP-9与其他BMP家族成员的区别在于其不与BMP共受体血幼素或可溶性BMP拮抗剂头蛋白结合[12],BMP-9与其前体蛋白复合,具有生物活性[13]。BMP-9主要在肝脏中表达[14],可调节葡萄糖代谢[15]、脂肪酸代谢[16]、铁代谢[17-18]。相关研究显示BMP-9与卵巢的分化和凋亡、癌细胞增殖、甲状腺和前列腺组织有关[10]。BMP-9对于类固醇激素的生成有调节作用,故对卵泡的发育和调控起着关键的作用。Hosoya等[10]研究显示,在大鼠颗粒细胞中有BMP-9 mRNA的表达,而在卵母细胞中未发现BMP-9 mRNA的表达;BMP-9可以显著抑制大鼠颗粒细胞FSH诱导的P的分泌,但对颗粒细胞FSH诱导的E2的分泌无明显影响;BMP-9还可以调节FSH信号传导机制,抑制FSH诱导的环磷酸腺苷合成及FSH诱导的类固醇合成因子。前期实验已证实,BMP-9 mRNA及蛋白在人类卵巢颗粒细胞中均有表达。本研究探讨BMP-9对体外培养人卵巢黄素化颗粒细胞FSH调控下E2、P分泌的影响,结果显示在基础状态下颗粒细胞能分泌一定量的E2、P,单独BMP-9培养时,BMP-9各浓度组分泌的E2和P浓度变化不大,差异均无统计学意义,说明BMP-9不能直接促进人卵巢黄素化颗粒细胞分泌E2、P;加入FSH后,BMP-9各浓度组分泌的E2变化不大,而P浓度则随着BMP-9浓度的增加,出现下降趋势,各浓度组间差异均有统计学意义,说明BMP-9可调控颗粒细胞FSH诱导的E2、P的分泌。P450 arom可催化睾酮转变为E2,是E2生物合成的关键酶[19-20],编码这种酶的基因在卵巢颗粒细胞中表达。P450 arom的水平和活性的调节决定了E2的水平。本研究结果显示,不同浓度的BMP-9单独和与FSH共培养对卵巢黄素化颗粒细胞P450 arom蛋白的表达无影响,与其颗粒细胞E2调节相一致。颗粒细胞中黄体酮的产生对于正常的生殖功能是重要的,卵巢黄体酮最初是由颗粒细胞线粒体中的胆固醇合成的,游离胆固醇被运送至线粒体,通过StAR从线粒体外膜转移到线粒体内膜上,StAR被认为是参与类固醇激素合成的关键调控蛋白[21]。本研究结果显示,BMP-9可抑制FSH刺激下黄素化颗粒细胞StAR蛋白的表达,与其颗粒细胞P调节相一致。说明BMP-9可作为黄素化抑制剂,通过调控StAR蛋白的表达调节FSH诱导的P的分泌,防止卵泡提前黄素化,调控卵泡的发育。
[参考文献]
[1] 黄鑫,郝翠芳.人卵丘细胞及卵母细胞发育成熟的关系[J].生殖与避孕,2012,32(8):546-552.
[2] 吴玉萍,赵茴茴,周玉霞.颗粒细胞在卵母细胞发育成熟中的作用[J].国际生殖健康/计划生育杂志,2017,36(6):503-506.
[3] 赵杰,陈秀娟.颗粒细胞与卵母细胞关系研究进展[J].国际生殖健康/计划生育杂志,2015,34(5):406-409.
[4] S nchez-Duffhues G,Hiepen C,Knaus P,et al. Bone morphogenetic protein signaling in bone homeostasis[J]. Bone,2015,80:43-59.
nchez-Duffhues G,Hiepen C,Knaus P,et al. Bone morphogenetic protein signaling in bone homeostasis[J]. Bone,2015,80:43-59.
[5] Poniatowski LA,Wojdasiewicz P,Gasik R,et al. Transforming growth factor Beta family:insight into the role of growth factors in regulationof fracture healing biology and potential clinical applications[J]. Mediat Inflamm,2015,2015:137823.
[6] 赵敏英,孙东霞,王素改,等.多囊卵巢综合征不孕患者的4种促排卵方案比较[J].河北医科大学学报,2016,37(6):712-715.
[7] Akhurst RJ,Padgett RW. Matters of context guide future research in TGFβsuperfamily signaling[J]. Sci Signal,2015,8(399):re10.
[8] García de Vinuesa A,Abdelilah-Seyfried S,Knaus P,et al. BMP signaling in vascular biology and dysfunction[J]. Cytokine Growth Factor Rev,2016,27:65-79.
[9] Wakefield LM,Hill CS. Beyond TGFβ:roles of other TGFβ superfamily members incancer[J]. Nat Rev Cancer,2013,13(5):328-341.
[10] Hosoya T,Otsuka F,Nakamura E,et al. Regulatory role of BMP-9 in steroidogenesis by rat ovarian granulosa cells[J]. J Steroid Biochem Mol Biol,2015,147:85-91.
[11] Wang JH,Liu YZ,Yin LJ,et al. BMP9 and COX-2 form an important regulatory loop in BMP9-induced osteogenic differentiation of mesenchymal stem cells[J]. Bone,2013,57(1):311-321.
[12] Wu Q,Sun CC,Lin HY,et al. Repulsive guidance molecule (RGM) family proteins exhibit differential binding kinetics for bone morphogenetic proteins(BMPs)[J]. PLoS One,2012,7(9):e46307.
[13] Mi LZ,Brown CT,Gao Y,et al. Structure of bone morphogenetic protein 9 procomplex[J]. Proc Natl Acad Sci USA,2015,112(12):3710-3715.
[14] Breitkopf-Heinlein K,Meyer C,König C,et al. BMP-9 interferes with liver regeneration andpromotes liver fibrosis[J]. Gut,2017,66(5):939-954.
[15] Sosa I,Grubesic A. Putative hormone with anti-obesogenic and insulin-sensitizing effect[J]. Int J Immunopathol Pharmacol,2016,29(1):147-148.
[16] Kim S,Choe S,Lee DK. BMP-9 enhances fibroblast growth factor 21 expression and suppresses obesity[J]. Biochim Biophys Acta,2016,1862(7):1237-1246.
[17] Herrera B,Dooley S,Breitkopf-Heinlein K. Potential roles of bone morphogenetic protein(BMP)-9 in human liver diseases[J]. Int J Mol Sci,2014,15(4):5199-5220.
[18] Lamplot JD,Qin J,Nan G,et al. BMP-9 signaling in stem cell differentiation and osteogenesis[J]. Am J Stem Cell,2013,2(1):1-21.
[19] Ghosh D,Egbuta C,Lo J,et al. Testosterone comlex and non-steroidal ligands of human aromatase[J]. J Steroid Biochem Mol Biol,2018,181:11-19.
[20] Vehmas AP,Marion M,Laajala TD,et al. Liver lipid metabolism is altered by increased circulating estrogen to androgen ratio in male mouse[J]. J Proteomics,2016,133:66-75.
[21] Fang L,Chang HM,Cheng JC,et al. TGF-β1 Downregulates StAR expression and decreases progesterone production through smad3 and ERK1/2 signaling pathways in human granulosa cells[J]. J Clin Endocrinol Metab,2014,99(11):E2234-2243.