肺癌的发病率逐年升高,目前已成为全球肿瘤相关死因首位。近年来受生活方式及环境改变的影响,我国已成为世界第一肺癌大国[1]。非小细胞肺癌是原发型肺癌最常见病理类型,占75%~85%,其中70%~80%的患者就诊时已属晚期,预后较差,其远处转移发生顺序依次为肝、肺其他区域、肾上腺、脑、肾、骨等,肝脏是常见远处转移部位之一,发生率为38%~44%,这类人群大部分就诊时已失去手术机会,约95%需接受全身或局部化疗。有效的化疗方式可以改善患者预后,延长其生存时间,本研究针对这类人群的化疗方案进行对比分析,报告如下。
1 资 料 与 方 法
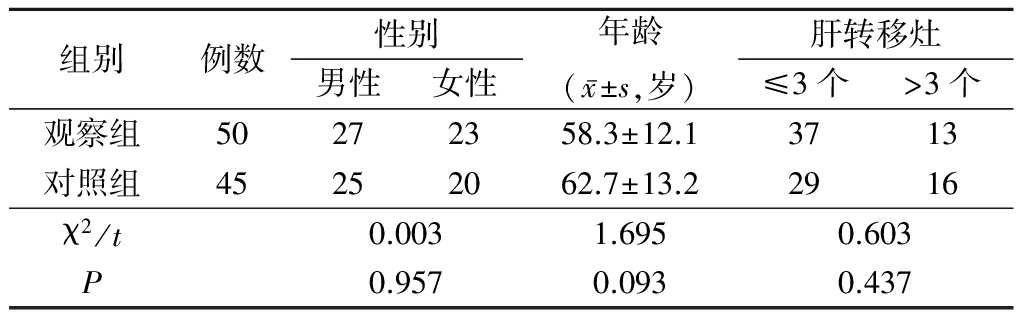
1.1 一般资料 收集2015年1月—2016年1月河北省胸科医院及河北省人民医院就诊的非小细胞肺癌肝转移患者95例,根据化疗方案不同分为脂质体紫杉醇+顺铂组(观察组)、吉西他滨+顺铂组(对照组)。纳入标准:①病理组织学或细胞学确诊为非小细胞肺癌;②CT或MRI等影像学检查证实肝脏转移;③美国东部肿瘤协作组(Eastenn Cooperative Oncology Group,ECOG)体力状态评分0~2分;④预计生存大于6个月;⑤至少完成2周期化疗;⑥实验室检查血常规、肝肾功能、凝血及心电图基本正常;⑦肝功能 Child 分级为 A 或 B 者。排除标准:①没有组织学或细胞学证据;②已使用过含脂质体紫杉醇或吉西他滨的化疗;③ECOG体力状态评分大于3分;④预期生存小于6个月;⑤化疗期间接受经导管动脉化学栓塞、放疗、消融、粒子植入等局部治疗;⑥肝功能 Child 分级为 C 者。2组年龄、性别、肝转移灶等差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 2组一般情况比较
Table 1 Comparison of general data of two groups (例数)
1.2 化疗方案 观察组:脂质体紫杉醇135~175 mg/m2(第1天)+顺铂75 mg/m2(第1天);对照组:吉西他滨1 000 mg/m2(第1天)+顺铂75 mg/m2(第1天),2组化疗周期均为21 d,每周期记录不良反应,每2周期评价疗效,共4~6周期。
1.3 观察指标 ①疗效评价标准:完全缓解(complete remission,CR),所有病灶消失,至少维持4周;部分缓解(partial remission,PR),基线病灶长径总和缩小30%,至少维持4周;进展(progressive disease,PD),基线病灶长径总和增加超过20%或出现新病灶;稳定(stable disease,SD),基线病灶长径总和有缩小但未达PR或有增加但未达PD。②客观有效率(objective response rate,ORR)=(CR+PR)/总例数。③疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数。④无进展生存期(progression-free survival,PFS)。⑤不良反应(分为1~4级)。
1.4 随访 采用门诊复查及电话随访等方式,患者均随访1年以上,截至时间为2017年1月。
1.5 统计学方法 应用SPSS 19.0 统计软件处理数据。计量资料比较采用t检验;计数资料比较采用χ2检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
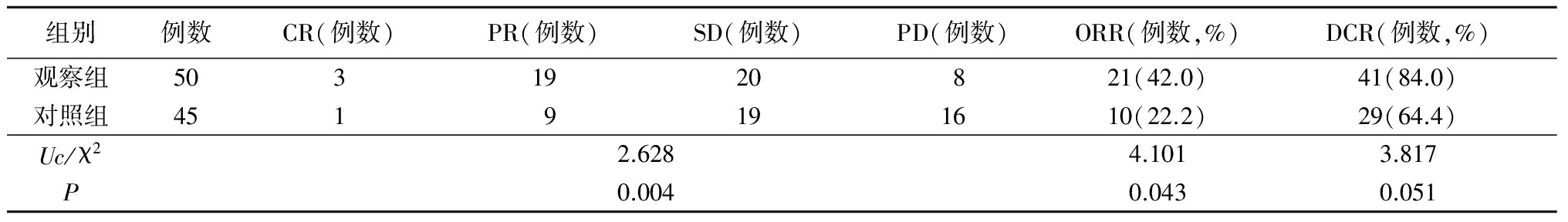
2.1 治疗效果 所有患者均完成2周期以上化疗。2组肺原发灶临床疗效、ORR、DCR、PFS差异均无统计学意义(P>0.05)。观察组肝转移灶临床疗效、ORR优于对照组,差异有统计学意义(P<0.05);但2组DCR差异无统计学意义(P>0.05)。见表2,3。
表2 肺原发灶疗效及ORR、DCR、PFS比较
Table 2 Comparison of the efficiency of lung cancer between two groups
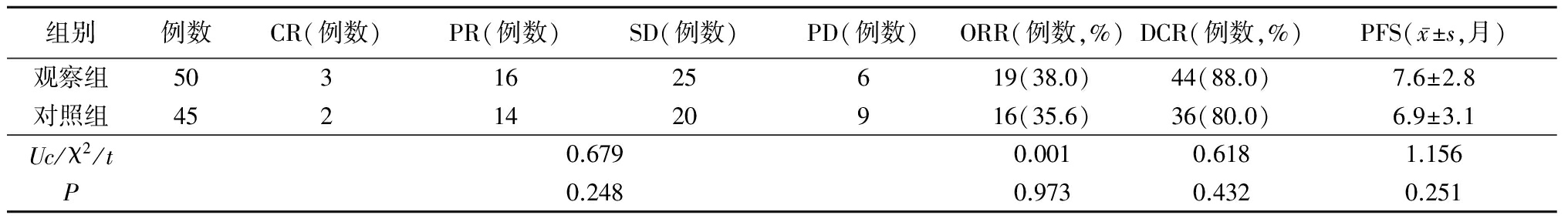
表3 2组肝转移灶疗效及ORR、DCR比较
Table 3 Comparison of the efficiency of hepatic metastases between two groups
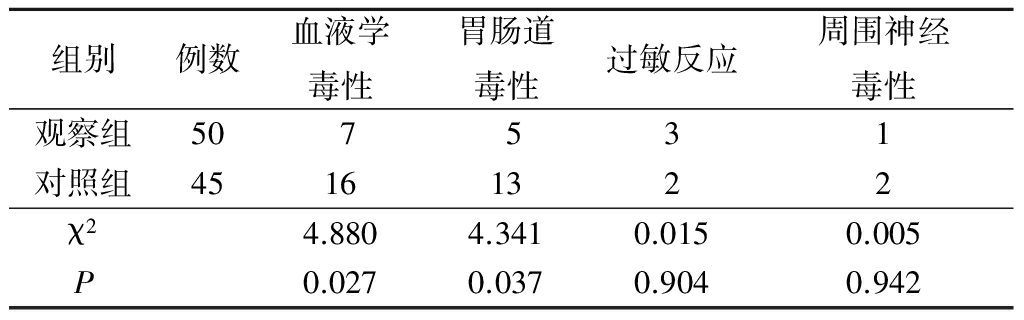
2.2 不良反应 2组均未出现治疗相关性死亡。观察组发生血液学毒性(血小板下降为主)及胃肠道毒性(恶心、呕吐)的例数少于对照组,差异有统计学意义(P<0.05);2组发生过敏反应、周围神经毒性的例数差异无统计学意义(P<0.05)。见表4。
表4 2组不良反应比较
Table 4 Comparison of adverse reactions between two groups (例数)
3 讨 论
非小细胞肺癌是我国发病率及病死率上升最快的恶性肿瘤,预测到 2020 年,我国将有多达 550 万新发肺癌病例,死亡40万例[2]。肺癌的发病原因尚不明确,包括吸烟、室内室外空气污染、职业病、遗传等因素[3-4]。其早期症状不明显,多表现为刺激性干咳、痰中带血或血痰、气促、胸痛、体重下降等非特异性症状,多为体检行胸片、CT检查时发现[5]。早期肺癌的治疗手段主要是手术切除,进行精确的TNM分期,再进行术后综合治疗。而对于不适合手术或拒绝手术治疗的早期肺癌患者,立体定向放射治疗也是有效的根治性治疗手段。在术后辅助治疗中,含铂两药化疗方案仍为标准辅助治疗方案,并不推荐靶向药物为辅助治疗。
因症状就诊的患者大部分为晚期,晚期肺癌可出现咯血、发热、气促等症状,当肿瘤侵犯周围组织时可出现声音嘶哑、上腔静脉压迫综合征、Horner综合征、胸腔积液等表现,出现远处转移如脑、骨、肝等器官时,可出现相应占位表现[6],且部分患者还会出现副肿瘤综合征,如抗利尿激素分泌综合征、异位促肾上腺皮质激素综合征、高钙血症、肥大性骨关节病、类癌综合征等。而晚期肺癌预后不容乐观,中位生存期为8~10个月,经积极抗肿瘤治疗后的1年生存率也不超过40%。肺癌的转移途径有血行转移、淋巴转移、直接扩散,其中血行转移是肺癌不良预后的主要因素,而肝转移又是最常见的血行转移器官,一旦出现肝转移,病情进展快,预后差,总生存期为7~8个月[7]。随着近年分子靶向治疗的飞速进展,晚期肺癌的治疗效果得以显著改善[8]。故对于晚期非小细胞肺癌、腺癌或含腺癌成分的患者常规进行EGFR、ALK基因检测,即便不能取得组织学检测,外周血检测也可用于指导用药[9]。对于EGFR基因突变、ALK基因融合的晚期非小细胞肺癌标准治疗方案为靶向治疗。对于驱动基因阴性的晚期非小细胞肺癌患者,仍以紫杉醇、吉西他滨、多西他赛、长春瑞滨等联合铂类二联化疗为的标准一线治疗方案。对于一线治疗达到疾病控制的患者,在传统化疗基础上进行单药维持治疗,有助于改善预后,可选择维持化疗药物培美曲塞(非鳞癌)和吉西他滨[10]。对于晚期非小细胞肺癌患者,随着免疫治疗研究的快速进展,免疫检查点抑制剂(PD1/PDL1单克隆抗体)的临床研究结果陆续发表,其中2015年食品药品监督管理局批准了 Nivolumab用于含铂双药联合化疗失败的非小细胞肺癌的二线治疗。并且更多的一线研究正在进行当中,免疫治疗正在逐渐改变肺癌治疗的综合模式,其治疗前景也是令人瞩目的[11]。
选择伴有肝转移的非小细胞肺癌一线化疗方案,对改善预后至关重要。本研究对脂质体紫杉醇与吉西他滨进行疗效和毒性的对比观察,希望能对化疗药物的选择提供参考。紫杉醇是一种广谱抗肿瘤药,为从红豆杉属植物中提取的次生代谢产物,主要机制为促进微管聚合,抑制解聚,从而使细胞分裂收到阻碍,使恶性肿瘤细胞中止于G2和M期[12-13]。由于紫杉醇注射液溶解性差,不溶于水,目前一般选择聚氧乙基代蓖麻油与无水乙醇混合剂作为溶媒,而聚氧乙基代蓖麻油极容易引起机体产生过敏反应,故使用前需应用大剂量激素进行预处理,这在一定程度上限值了其临床应用,而脂质体紫杉醇是它的一种新型制剂[14]。脂质体是由磷脂为骨架膜材料制成的双分子层结构,具有良好组织相容性和细胞亲和性,进入人体迅速被单核-巨噬细胞系统识别吞噬,主要分布于网状内皮系统发达的器官,如肺、肝、淋巴结等。新型制剂缓慢释放紫杉醇,提高了药物稳定性,降低了药物毒性[15]。吉西他滨是细胞周期特异性抗代谢类抗癌药,主要作用于S期,可以特异性抑制肿瘤细胞由G1向S期进展,减少DNA的合成和修复,最终使DNA合成终止,杀灭肿瘤细胞[16]。顺铂为广谱抗肿瘤药物,广泛应用于多种实体瘤,为金属类络合物,属周期非特异性抗肿瘤药,与DNA上的碱基链接,破坏DNA的结构及功能,疗效确切。
本研究结果显示,观察组与对照组肺癌原发灶的疾病控制疗效是一致的,2组ORR、DCR差异均无统计学意义,说明2种化疗药物在肺部浓集及对肿瘤细胞杀伤作用基本一致;但肝转移灶的疗效相比,观察组较对照组拥有较高的ORR,差异有统计学意义,可能与脂质体结构的紫杉醇靶向性聚集于网状内皮系统发达的肝脏相关;不良反应方面,观察
组没有增加过敏反应及周围神经毒性,且在血小板减少及胃肠道不良反应方面较对照组轻,差异有统计学意义。本研究结果表明,对于晚期非小细胞肺癌患者,脂质体紫杉醇与吉西他滨在原发灶的治疗效果相当,但对于肝转移灶的缓解脂质体紫杉醇效果更好,且不良反应的耐受性更好,更能使患者受益,从而让其获得更好的生活质量。
[参考文献]
[1] 王琦,贠利新,徐玉清.脂质体紫杉醇与奈达铂联合治疗老年非小细胞肺癌的临床疗效[J].哈尔滨医科大学学报,2016,50(6):565-568.
[2] 李秋萍,王卫.脂质体紫杉醇联合奈达铂与紫杉醇联合奈达铂一线治疗晚期非小细胞肺癌的临床观察[J].中南医学科学杂志,2017,45(5):513-515.
[3] 何辉龙.单操作孔胸腔镜手术与单纯小切口手术治疗早期肺癌的临床效果比较[J].河南医学研究,2017,26(5):881-882.
[4] 王珊,董丽儒,任会强,等.肺腺癌中PD-1、PD-L1蛋白表达与K-RAS基因突变状态的相关性分析[J].临床与实验病理学杂志,2017,33(7):754-758.
[5] 周英文,周玉福,张莉梅.培美曲塞或紫杉醇联合奈达铂一线治疗肺腺癌临床评价[J].中国医药,2017,26(12):53-55.
[6] 党莹,孙红军,林瑜亮,等.外泌体与肺癌脑转移瘤关系的研究进展[J].中国肿瘤临床,2017,44(8):404-408.
[7] 代水平,周萍,李为民.血清肿瘤标志物与肺癌肝转移的相关性[J].现代肿瘤医学,2016,24(19):3063-3066.
[8] 杨玉华,张永平.厄洛替尼联合紫杉醇加卡铂治疗老年晚期敏感性EGFR突变肺鳞癌的有效性及安全性[J].现代肿瘤医学,2017,25(16):2597-2601.
[9] 杨晓瑞,易善永,冯沛贝,等.液体活检技术在肺癌治疗中的应用[J/CD].中华临床医师杂志:电子版,2017,11(9):1601-1604.
[10] 潘莹,龚五星,梁翠微,等.晚期非小细胞肺腺癌维持化疗临床研究[J].实用医学杂志,2017,33(7):1130-1132.
[11] 康晓艳,刘侠,宋霞.PD-1/PD-L1通路在肺癌中的研究新进展[J].中国药物与临床,2017,17(5):672-674.
[12] 徐继业.紫杉醇联合顺铂与替吉奥联合顺铂治疗中晚期肺癌的对比分析[J].实用癌症杂志,2016,31(10):1631-1633.
[13] 母丹,叶璐,付波.培美曲塞或紫杉醇联合顺铂治疗晚期非鳞非小细胞肺癌的临床观察[J].武警后勤学院学报:医学版,2017,26(6):493-495.
[14] 马超楠.奈达铂与顺铂联合紫杉醇治疗晚期肺鳞癌的临床效果比较[J].河南医学研究,2017,26(19):3605-3606.
[15] 巫云立,黄菁,王巍炜,等.顺铂联合紫杉醇脂质体治疗晚期肺鳞癌的临床观察[J].中国医学创新,2016,13(4):131-133.
[16] 石宇.联用吉西他滨和顺铂与联用紫杉醇和顺铂治疗晚期肺鳞癌的效果对比[J].当代医药论丛,2016,14(19):54-55.