朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)是单核-巨噬细胞系统的朗格汉斯细胞在一个或多个器官或组织中克隆性增生为主要特征的疾病,以往称嗜酸性肉芽肿、组织细胞增生症X[1],是一组病因不明、发病机制尚不完全清楚[2]、病理过程相同但累及范围广的疾病,累及部位有骨、淋巴结、皮肤、肺、肝、脾、外阴、骨髓及中枢神经系统[3-7]。LCH确诊主要依赖组织学和免疫组织化学检查,病变细胞具有特征性朗格汉斯细胞形态及Langerin、CD1a染色阳性,或者电子显微镜下观察到细胞内Birbeck 颗粒。LCH可发生在任何年龄,多见于学龄前儿童,发病率为0.1/10万~1.0/10万,男性较多见,因起病隐匿,临床表现复杂多变,预后不一,主要取决于受累器官的种类、诊断时和诊断后短期内危险器官功能受损情况,以及对化疗等的反应,部分患儿可自愈,部分患儿可死亡[8-9]。LCH易造成临床医师误诊、漏诊。本研究分析河北省儿童医院收治的15例LCH患儿的临床、病理资料,结合文献复习对其临床病理学及分子病理学特征进行总结,以加深对LCH的认识。
1 资 料 与 方 法
1.1 一般资料 收集2012年5月—2017年12月河北省儿童医院病理科经福尔马林固定石蜡包埋组织30例,经免疫组织化学证实15例LCH和15例非LCH的组织细胞疾病(non-Langerhans cell histiocytic disorder,N-LCHD)。15例LCH患儿中,男性8例,女性7例,年龄3个月22天~2岁3个月,平均(1.6±1.2)岁。15例N-LCHD患儿中,男性7例,女性8例,年龄3个月~3岁,平均(1.3±0.7)岁,包括12例幼年性黄色肉芽肿和3例窦组织细胞增生伴巨大淋巴结病。2组性别、年龄差异无统计学意义(P>0.05),具有可比性。
临床资料(临床病史及影像学资料)由医院电子病历资料库取得,病理切片均由高年资病理医师阅片复诊,电话随访患儿预后情况。
1.2 方法 免疫组织化学应用Roche 全自动免疫组织化学仪,所用一抗Langerin、CD1a、S-100、CD68 均购自福建迈新公司,用已知阳性切片作为阳性对照,PBS液替代一抗作为阴性对照,组织标本经10%甲醛固定,石蜡包埋,制成3 μm切片,按照试剂盒及机器标准程序完成。
1.3 结果判定 免疫组织化学阅片采用双盲阅片法,以细胞质或细胞核内出现棕黄色颗粒为阳性细胞,无背景染色。其中Langerin及CD1a阳性部位在细胞膜或细胞质,S-100阳性部位在细胞质或细胞核,CD68阳性部位在细胞质,细胞数>25%为阳性。
1.4 统计学方法 应用SPSS 21.0统计软件处理数据,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 诊断结果 LCH患儿中发生于皮肤3例,浅表淋巴结3例,颅骨5例,肺1例,牙槽黏膜1例,椎体(腰椎)2例。15例均为首发病例,其中2例(病例2,6)累及多处器官或组织,余13例为单发病灶,见表1。
表1 15例LCH患儿临床资料
Table 1 The clinical data of 15 LCH children

表1 (续)

2.2 病理学检查 光镜下见朗格汉斯细胞弥漫增生,分布欠均匀,细胞圆形、卵圆形,略大,胞质丰富,嗜酸性,分界不清,核长形、肾性或不规则形,见核沟及核皱褶,核膜薄,光滑,染色质细腻,未见明显核仁,其间可见多核巨细胞反应,核分裂像偶见,并见片状出血、坏死,小血管丰富,见较多嗜酸性粒细胞、淋巴细胞浸润,见图1。
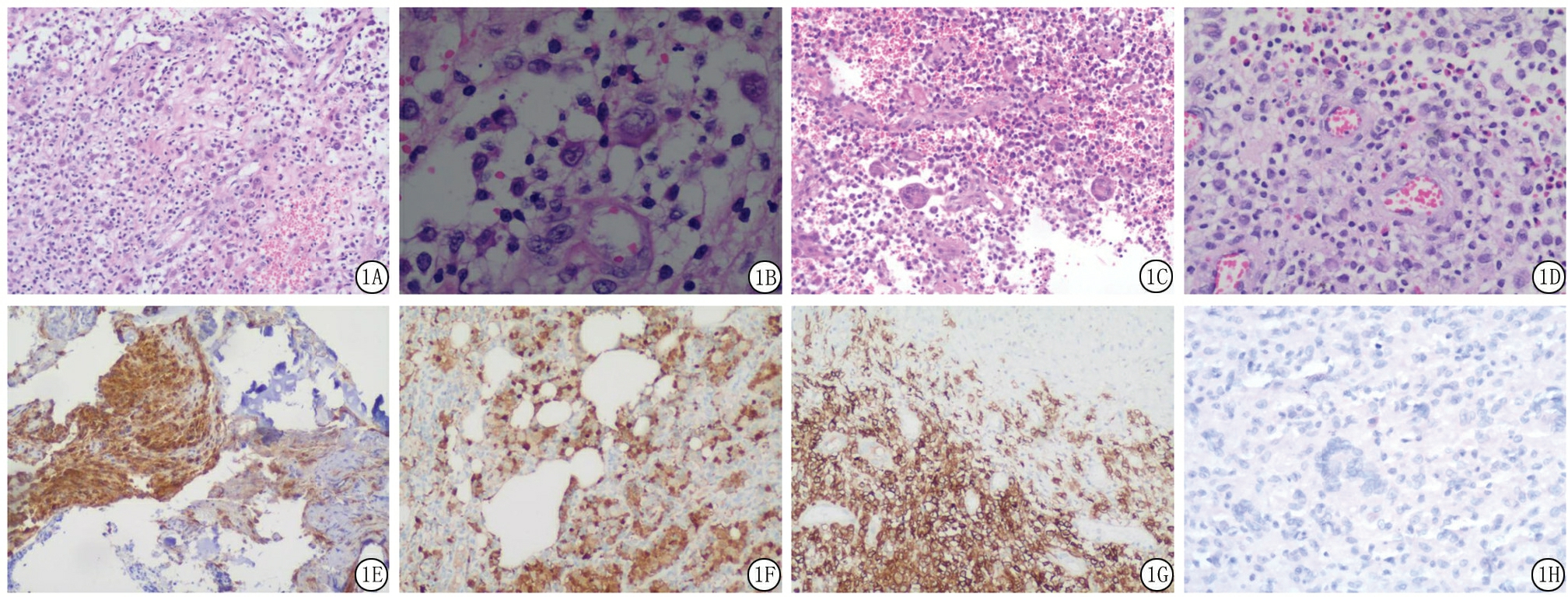
图1 LCH组织学特点
A.朗格汉斯细胞弥漫增生,见灶状出血;B.朗格汉斯细胞核长形、肾性或不规则形,见核沟及核皱褶;C.朗格汉斯细胞间见多核巨细胞反应;D.较多嗜酸性粒细胞浸润;E.LCH颅骨骨组织瘤Langerin胞膜及胞质强阳性表达;F.LCH病变区皮下软组织侵犯颅骨,CD1a胞膜强阳性表达;G.LCH肺组织S-100胞核强阳性表达;H.N-LCHD组织内Langerin不表达
Figure 1 The histological features of LCH
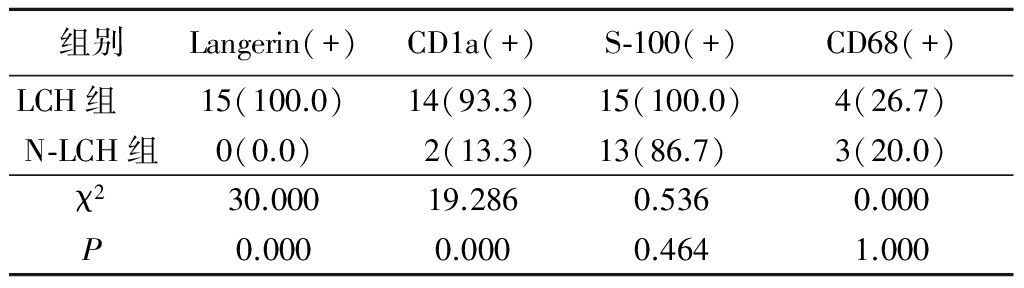
2.3 免疫表型 根据本研究中15例LCH和15例N-LCHD免疫组织化学检测结果,LCH组Langerin阳性率(100%)、CD1a阳性率(93.3%)明显高于N-LCH组的0%和13.3%,差异有统计学意义(P<0.05);2组S-100和CD68阳性表达率差异均无统计学意义(P>0.05)。见表2。
表2 2组Langerin、CD1a、S-100和CD68抗原阳性率比较
Table 2 Comparison of antigen positive rates of Langerin,CD1a,S-100 and CD68 between two groups (n=15,例数,%)
2.4 临床治疗 由于LCH所累及部位不同,临床首发症状、病情轻重不一,故治疗前应进行准确分级评估,以制定最合适的治疗方案。单纯骨损害仅单一局灶病变者应可采用外科手术治疗(病例3,4,6,7,8,10,12,13,14,15),特殊部位如椎体(病例1,9)手术后分期化疗。对于多系统累及的患者(病例2,5),给予多种药物联合化疗+免疫治疗。
2.5 随访 经电话随访,15例LCH患儿中2例(病例2,5)在1年内死亡(年龄<1岁且累及多处器官),其余病例术后1年未见复发,患儿一般情况可,将继续随访观察。
3 讨 论
LCH是一种罕见的树突状细胞和网状细胞系统增生性疾病,其特点是骨髓来源的朗格汉斯细胞异常增生[9],好发于1~3岁婴幼儿,男性发病率高于女性,病因不明,临床表现复杂多变,国际细胞协会根据LCH病变范围将LCH分为单系统和多系统两大临床类型。朗格汉斯细胞为具有树枝状突起的细胞,认为其是树突状细胞发育过程中的不成熟阶段,主要散在分布于皮肤棘层浅层和黏膜基底层,是一种抗原提呈细胞,能捕获抗原物质,引发免疫应答[10]。LCH是一组由朗格汉斯细胞单克隆性增生,在体内一个或多个器官聚集并引起的组织细胞/网状细胞增殖性疾病,以往学者对其归属肿瘤性或反应性疾病有争议,2008年WHO肿瘤分类中将其归为组织细胞/树突状细胞肿瘤中的一类[10]。
LCH病因及发病机制尚未明确,可能与机体免疫功能失调、细胞因子升高、酶代谢功能失调、人疱疹病毒感染等因素相关[11-12]。有学者研究认为朗格汉斯细胞的异常集聚和单克隆增殖主要是免疫失调的结果,其中细胞因子及趋化因子在免疫调节中发挥核心作用[13]。此外,还可能与遗传因素、抑制性T细胞缺陷、原癌基因Braf激活等有关[14]。
LCH临床表现多变,根据累及部位不同将其分为三类:①孤立性嗜酸性肉芽肿(累及单一部位,如颅骨、椎骨、肺等);②Hand-Schuller-Christian综合征(单系统多灶性病变,同一种系统内累及多个部位,多为骨组织);③Letterer-Siwe综合征(多系统多灶病变,可累及骨组织、皮肤、淋巴结、肝、脾等)。LCH于任何年龄段均可发病,高峰发病年龄1~3岁,男女比例约为1.6~2∶1。LCH可累及全身各组织、器官,如淋巴结、皮肤、肝、脾、肺、骨及各种软组织等,最多见于骨组织,其中颅骨占约90%[15],也可侵犯骨髓发展为白血病[16],造成多系统、多灶性损害。本研究15例均为首次发病,其中2例(病例2,6)累及多处器官或组织,余13例为单发病灶。
目前LCH诊断主要依赖于组织病理学及免疫组织化学,必要时还可借助电子显微镜观察。光镜下见朗格汉斯细胞弥漫增生,分布欠均匀,细胞圆形、卵圆形,略大,胞质嗜酸性,核长形、肾形或不规则形,见核沟及核皱褶,未见明显核仁。病灶背景下见较多嗜酸性粒细胞及多核巨细胞浸润。免疫组织化学Langerin、CD1a、S-100在15例患者病灶区均阳性,部分不同程度表达CD68。有研究表明,电镜检查Birbeck颗粒已不是诊断所必需的,Langerin检测甚至可以取代电镜检查[17]。
病理医生在确诊LCH前需与其他相关肿瘤性或炎症性疾病相鉴别。①幼年性黄色肉芽肿:好发于幼儿,头颈部或躯干部多见,皮肤出现小结节,镜下见结节内大量胞浆淡染及泡沫状组织细胞,并有丰富的Touton巨细胞,免疫组织化学CD68和Lysozyme阳性,S-100及CD1a阴性。②Rosai-Dorfman病(窦组织细胞增生伴有大块淋巴结肿大):该病年轻人多见,平均发病年龄20.6岁,1/4病例伴随发热和全身不适,镜下见淋巴结结构几乎消失,特征性成分为窦组织细胞吞噬淋巴细胞及浆细胞,在核周围排列成花环状;免疫组织化学S-100阳性,Langerin及CD1a阴性。③朗格汉斯细胞肉瘤:该病细胞异型性更加显著,核深染,核仁明显,文献报道,核分裂像多见,30~60个/10 HP,病灶背景中偶见嗜酸性粒细胞浸润[18]。④Erdheim-Chester病:是另一种原因不明的“组织细胞增生症”,主要累及中枢神经系统、骨和肺,其组织细胞S-100灶状阳性,Langerin及CD1a阴性,且电镜下缺乏Birbeck颗粒。⑤Kimura病:是一种病因不明的炎症性地方性疾病[19],主要见于中国、日本等国家,表现为头颈部皮下组织或大唾液腺包块,常伴局部淋巴结肿大,有时淋巴结肿大为该病唯一表现;镜下受累淋巴结生发中心常有明显的血管增生并包含多核细胞、间质纤维化和蛋白性物质沉积,周围见嗜酸性粒细胞广泛浸润;有文献报道在1例Kimura病中发现了T细胞受体δ基因重排[20]。
LCH确诊后应在治疗前进行分级评估,以制定最合适的治疗方案[21]。对于多系统累及的患者,应给予多种药物联合化疗、免疫治疗,常规疗效欠佳时,可考虑骨髓造血干细胞移植治疗[22-25]。预后与发病年龄、受累器官多少及功能受损程度、治疗反应等有关。LCH级别越高,年龄越小,受累器官越多,预后越差。
总之,LCH为一种少见疾病,好发于婴幼儿、儿童,发病初期症状隐匿且临床表现多变,及时准确诊断、规范化治疗对提高患儿生存率至关重要。
[参考文献]
[1] Bakry OA,Samaka RM,Kandil MA,et al. Indeterminate cell histiocytosis with naive cells[J]. Rare Tumors,2013,5(1):e13.
[2] 许霞,聂秀.朗格汉斯细胞组织细胞增生症发病机制的研究进展[J].临床与实验病理学杂志,2015,31(12):1392-1395.
[3] 邢焕英,孙小英.肋骨朗格汉斯细胞组织细胞增生症误诊1例[J].河北医科大学学报,2014,34(8):896-896,903.
[4] 张艳华,郝冀洪,郭欣,等.先天性自愈性朗格汉斯细胞组织细胞增生症1例[J].临床荟萃,2014,29(9):1064-1066.
[5] 曾丽华,彭学标.外阴朗格汉斯细胞组织细胞增生症1例[J].皮肤性病诊疗学杂志,2016,23(5):333-334.
[6] 王旭,陈虹.朗格汉斯细胞组织细胞增生症导致肝功能衰竭行肝移植一例[J].中华器官移植杂志,2017,38(10):623.
[7] 周云,刘秋玲.朗格汉斯细胞组织细胞增生症的发病机制及诊疗进展[J].中华灾害救援医学,2017,5(2):106-110.
[8] 袁新宇,李素荣.儿童朗格汉斯细胞组织增生症病理与影像学等诊断研究进展[J].武警医学,2015,26(6):541-544.
[9] 于士柱.组织细胞增生性病变病理学特点与鉴别要点[J].中国现代神经疾病杂志,2015,15(4):256-262.
[10] 张嘉,王旖旎,王昭.朗格汉斯细胞源性肿瘤研究进展[J].中国实验血液学杂志,2012,20(4):1042-1046.
[11] Lourda M,Olsson-Akefeldt S,Gavhed D,et al. Detection of IL-17A-producing peripheral blood monocytes in langerhans cell histiocytosis patients[J]. Clin Immunol,2014,153(1):112.
[12] Murakami I,Matsushita M,Iwasaki T,et al. Merkel cell polyomavims DNA sequences in peripheral blood and tissues from patients wilh Langerhans cell histiocytosis[J]. Hum Pathol,2014,45(1):119-126.
[13] Nelson DS,van Halteren A,Quispel WT,et al.MAP2Kl and MAP3KI mutations in Langerhans cell histiocytosis[J]. Genes Chromosomes Cancer,2015,54(6):361-368.
[14] Badalian-Very G,Vergilio JA,Degar BA,et al. Recurrent BRAF mutations in langerhans cell histiocytosis[J].Blood,2010,116(11):1919-1923.
[15] 阎晓玲.朗格汉斯细胞组织细胞增生症[J].中国现代神经疾病杂志,2014,14(10):866.
[16] 薛宁,潘凯丽,张静静.小儿朗格汉斯细胞组织细胞增生症24例临床分析[J].中国妇幼健康研究,2015,26(6):1298-1301.
[17] Chikwava K,Jaffce R.Langerin(CD207)staining in normal pediatric tissue,reactive lymph nodes,and childhood histocytic disorders[J]. Pediatr Dev Pathol,2004,7(6):607-614.
[18] Chertoff J,Chung J,Ataya A. Adult langerhans cell histiocytosis masquerading as Hidradenitis suppurativa[J]. Am J Respir Crit Care Med,2017,195(8):e34-36.
[19] Okubo A,Fujii K,Kondo T,et al. Kimura′s disease in the oral cavity:a rare manifestation of immunoglobulin G4-related disease[J]. J Dermatol,2017,44(12):e357-358.
[20] Chim CS,Liang R,Fung A,et al.Further analysis of clonality in Kimura's disease[J].Am J Surg Pathol,2003,27(5):703-704.
[21] 赵曼丽,朱坤,杨敏,等.儿童多系统性朗格汉斯细胞组织细胞增生症8例临床病理分析[J].临床与病理杂志,2015,35(6):1033-1037.
[22] Morimoto A,Shioda Y,Imamura T,et al. Intensified and prolonged therapy comprising cytarabine,vincristine and prednisolone improves outcome in patients with multisystem langerhans cell histiocytosis:results of the Japan Langerhans cell histiocytosis study Group-02 Protocol Study[J]. Int J Hematol,2016,104(1):99-109.
[23] Simko SJ,McClain KL,Allen CE. Up-front therapy for LCH:is it time to test an alternative to vinblastine/prednisone?[J]. Br J Haematol,2015,169(2):299-301.
[24] Berres ML,Lim KP,Peters T,et al. BRAF-V600E expression in precursor versus differentiated dendritic cells defines clinically distinct LCH risk groups[J]. J Exp Med,2015,212(2):281.
[25] Veys PA,Nanduri V,Baker KS,et al. Haematopoietic stem cell transplantation for refractory langerhans cell histiocytosis:outcome by intensity of conditioning[J]. Br J Haematol,2015,169(5):711-718.