原发性肺癌是我国发病率较高的恶性肿瘤之一[1],而且随着环境污染和人们生活习惯改变等因素的影响,我国的肺癌发病率和患病率日益升高[2]。由于多数肺癌患者的临床表现并不十分特异,半数以上患者在确诊时已发生远处转移,5年生存率和生活质量受到严重影响[3]。早期发现和诊断肺癌是目前肺癌相关领域研究的热点,尽管低剂量CT(Low-dose CT,LDCT)等筛查方式取得了较好的效果,但其存在电离辐射和一定的假阳性率,应用还存在限制[4]。血清学肿瘤标志物是临床常用的肿瘤筛查、诊断和随访工具,胃泌素释放肽前体(progastrin-releasing peptide,ProGRP)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC-Ag)、细胞角蛋白19片段抗原(cytokerantin 19 fragment,Cyfra21-1)及癌胚抗原(carcino-embryonic antigen,CEA)均是与肺癌高度相关的肿瘤标志物[5]。目前尚无诊断肺癌的特异性标志物,单一肿瘤标志物诊断的效能又较低,多项肿瘤标志物的联合检测可能为早期诊断肺癌提供新的方向[6]。为此,本研究对71例新诊断原发性肺癌患者进行了一项横断面研究,现报告如下。
1 资 料 与 方 法
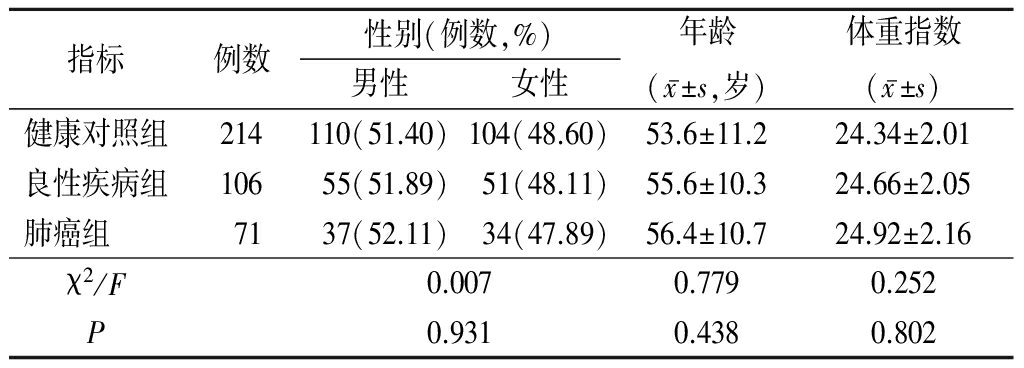
1.1 一般资料 随机抽取2016年1月—2017年6月在我院首次确诊的肺癌(非小细胞肺癌50例,小细胞肺癌21例)患者71例,另选择同时期、同年龄段的肺部良性疾病患者106例(如支气管哮喘16例、慢性支气管炎22例、肺炎35例和慢性阻塞性肺疾病33例)和健康体检者214例分别作为良性疾病组和健康对照组。3组受试者一般资料差异无统计学意义(P>0.05),具有可比性,见表1。
表1 3组受试者一般资料比较
Table 1 General data comparison in the three groups
1.2 纳入标准和排除标准 纳入标准:①临床症状、体征,影像学和病理学检查符合《中国原发性肺癌诊疗规范(2015年版)》[7]中的诊断要点;②经病理学和影像学检查明确病理类型和肿瘤分期;③未接受肺癌相关治疗;④经本院伦理会审核通过,受试者知情并签署知情同意书。排除标准:①既往存在其他部位恶性肿瘤;②近期接受过抗肿瘤药物治疗。
健康体检者为无肺部疾病、无其他肿瘤性疾病、血常规检查正常、既往无心脏病史和心电图检查正常者。
1.3 检测方法 所有受试者于清晨采集空腹肘正中静脉血样4 mL,静置30 min,8 ℃ 3 500 r/min(离心半径15 cm)离心15 min,分离血清,-80 ℃保存待检,血清ProGRP、SCC-Ag、Cyfra21-1和CEA水平用相应的酶联免疫吸附测定检测试剂盒(美国R&D公司)及其配套试剂(采购自上海润裕生物公司),应用HBS-1096A全自动酶标仪(南京德铁实验设备有限公司)进行定量检测。
1.4 评价指标 比较3组ProGRP、SCC-Ag、Cyfra21-1和CEA水平以及阳性率、阳性指标数,比较4项肿瘤标志物单独和联合诊断肺癌的诊断效能(包括灵敏度、特异度、准确度、阳性预测值和阴性预测值)。4项肿瘤标志物临界值分别为65.0 ng/L、1.5 μg/L、4.0 μg/L、5.0 μg/L,大于临界值判定为阳性。准确度=诊断符合例数/总例数×100%;灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%,特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%。
1.5 统计学方法 应用SPSS 22.0统计学软件分析数据。计量资料比较分别采用单因素方差分析和SNK-q检验;计数资料比较采用χ2检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线评价ProGRP、SCC-Ag、Cyfra21-1和CEA水平单独与联合诊断肺癌的效能,绘制ROC曲线图,并计算曲线下面积(area under curve,AUC)及其95%置信区间、标准误和P值,利用约登指数寻找最佳截点。P<0.05为差异有统计学意义。
2 结 果
2.1 3组血清ProGRP、SCC-Ag、Cyfra21-1和CEA水平比较 肺癌组血清ProGRP、SCC-Ag、Cyfra21-1和CEA水平显著高于健康对照组和良性疾病组,良性疾病组血清ProGRP水平显著高于健康对照组,差异有统计学意义(P<0.05);健康对照组与良性疾病组血清SCC-Ag、Cyfra21-1和CEA水平差异无统计学意义(P>0.05)。见表2。
表2 3组血清ProGRP、SCC-Ag、Cyfra21-1和CEA水平比较
Table 2 The level comparison between ProGRP,SCC-Ag,Cyfra21-1 and CEA of Serum in three groups ![]()
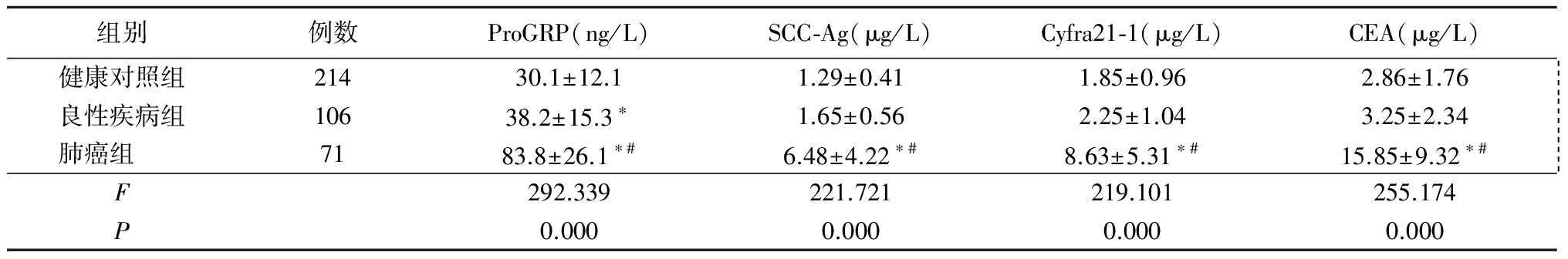
*P<0.05与健康对照组比较 #P<0.05与良性疾病组比较(SNK-q检验)
2.2 3组ProGRP、SCC-Ag、Cyfra21-1、CEA阳性率和阳性指标数比较 肺癌组ProGRP、SCC-Ag、Cyfra21-1和CEA阳性率和阳性指标数均显著高于健康对照组和良性疾病组(P<0.05),见表3。
表3 3组ProGRP、SCC-Ag、Cyfra21-1、CEA阳性率和阳性指标数比较
Table 3 Comparison of positive rate and positive index number of ProGRP,SCC-Ag,Cyfra21-1,CEA in three groups
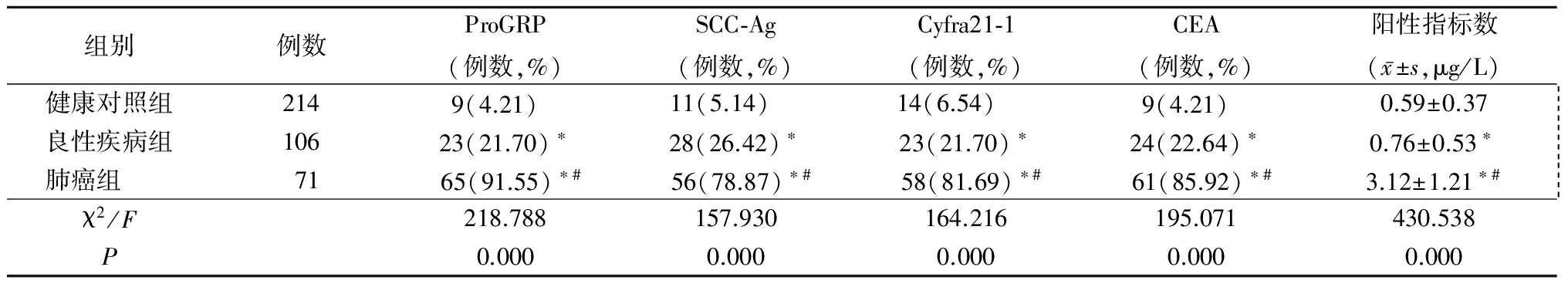
*P<0.05与健康对照组比较 #P<0.05与良性疾病组比较(χ2检验和SNK-q检验)
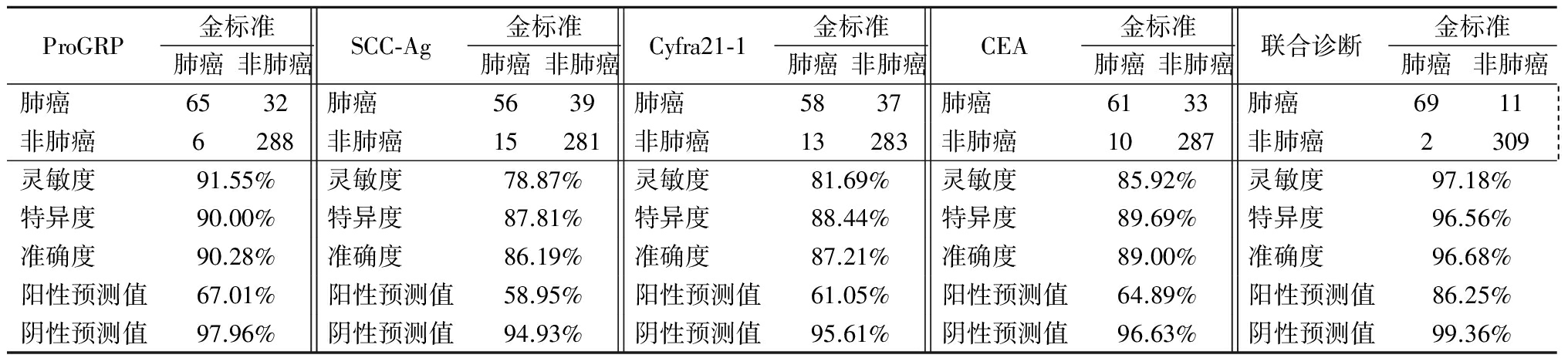
2.3 ProGRP、SCC-Ag、Cyfra21-1和CEA单独与联合诊断肺癌的ROC曲线 ROC曲线显示,4项肿瘤标志物单独诊断肺癌时,ProGRP的AUC最大(AUC=0.898),CEA(AUC=0.873)和Cyfra21-1(AUC=0.813)次之,SCC-Ag最低(AUC=0.798);4项肿瘤标志物联合诊断后AUC得到了显著提高(AUC=0.975),AUC值越大,诊断价值越高;利用约登指数得出最佳截点为ProGRP>47.5 ng/L、SCC-Ag>2.12 μg/L、Cyfra21-1>3.41 μg/L和CEA>5.98 μg/L。见表4。
2.4 ProGRP、SCC-Ag、Cyfra21-1和CEA单独与联合诊断肺癌的诊断效能 4项肿瘤标志物联合诊断的灵敏度、特异度、准确度、阳性预测值和阴性预测值均显著高于单独诊断,见表5。
表4 ProGRP、SCC-Ag、Cyfra21-1和CEA单独与联合诊断肺癌的AUC
Table 4 Solitary and combined diagnosis of AUCof lung cancer by ProGRP,SCC-Ag,Cyfra21-1 and CEA
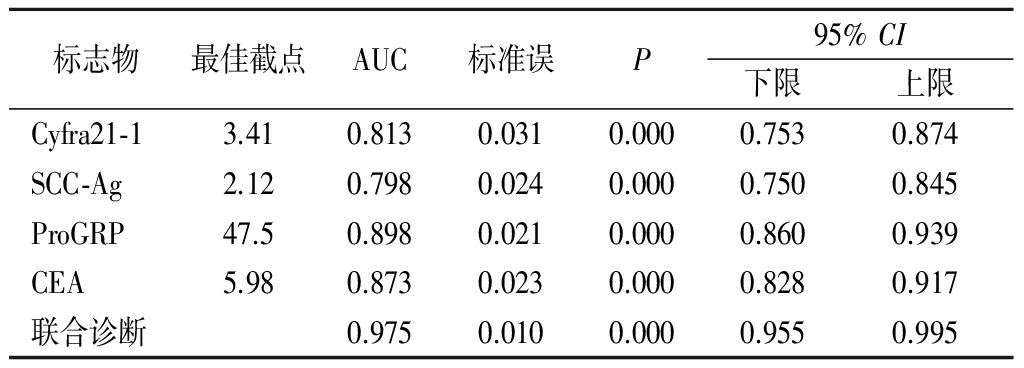
表5 ProGRP、SCC-Ag、Cyfra21-1和CEA单独与联合诊断肺癌的诊断效能
Table 5 The diagnostic efficiency of ProGRP, SCC-Ag, Cyfra21-1 and CEA alone and combined in diagnosing lung cancer (例数)
3 讨 论
肺癌是全球最常见的恶性肿瘤之一,尽管肺癌的发病率和患病率居恶性肿瘤第2位,但是其在癌症死因中居于首位[8]。肺癌起病隐匿,症状多于晚期开始出现,80%以上肺癌患者的预期寿命不足2年[9]。影像学检查(如胸部X线片和胸部CT)是目前临床最常用的肺癌筛查方式,但胸部X线片对小肺癌和靠近纵隔位置的肿瘤敏感性较低;而高清影像学检查(如LDCT等)存在较高的假阳性率和辐射剂量限制。病理学活组织检查是诊断肺癌的金标准,但其作为一种筛查手段,具有技术要求高、大样本处理困难和有创操作等不足。血清学肿瘤标志物是肺癌组织、细胞自身产生或引起特异性免疫反应而出现的相关生物大分子,其水平与肺癌有高度相关性。
本研究比较健康体检人群、良性肺部疾病患者和新确诊肺癌患者血清4项肿瘤标志物(ProGRP、SCC-Ag、Cyfra21-1、CEA)水平的差异,结果显示肺癌组血清4项肿瘤标志物水平均显著高于健康对照组织和良性疾病组,良性疾病组ProGRP水平高于健康对照组。胃泌素释放肽是一种胃肠激素,稳定性差,难检测,而其前体即ProGRP则具有半衰期较长、更稳定和可以进行体外检测的特点;ProGRP在正常上皮、良性肺疾病和上皮来源的肿瘤中表达水平低,而在肺癌组织(尤其是小细胞肺癌)中表达水平极高[10]。SCC-Ag是恶性肿瘤中最早发现的鳞状上皮起源的恶性肿瘤相关标志物,为肿瘤相关抗原的一种亚性,在肺鳞癌、宫颈癌和皮肤癌等鳞状上皮起源的癌症中高表达[11]。Cyfra21-1是细胞角蛋白19的一种可溶性片段,与肺癌(特别是鳞癌、腺癌和腺鳞癌等非小细胞肺癌)具有较高的相关性[12]。CEA可以由正常消化道细胞、胚胎组织和上皮起源的恶性肿瘤组织产生,在消化道肿瘤和肺癌的诊断中具有重要的参考意义[13]。Xiong等[14]研究显示,ProGRP、SCC-Ag、Cyfra21-1和CEA等肿瘤标志物在健康人群、肺部良性疾病和肺癌患者中均有一定程度的表达,而肺癌患者的上述4项肿瘤标志物水平显著高于非肺癌患者。
本研究结果显示,肺癌组ProGRP、SCC-Ag、Cyfra21-1、CEA阳性率和阳性指标数明显高于健康对照组和良性疾病组,但非肺癌患者仍存在一定的阳性率,其原因可能为上述指标在正常组织中存在一定的表达以及肺部疾病的刺激作用有关。这与Liu等[15]对2 097例肺癌和肺部疾病患者的研究结果较为相似。
ROC曲线是评估诊断效果的重要统计学工具。本研究显示4项肿瘤标志物单独诊断肺癌时,ProGRP的AUC最大,CEA和Cyfra21-1次之,SCC-Ag最小,4项标志物单独诊断时的AUC均<0.9,而联合诊断后AUC得到了显著提高。Molina等[16]研究显示,通过多种肿瘤标志物的联合应用,能够有效提高肿瘤标志物在筛查和诊断肺癌中的诊断效能,而其中漏诊率的减少最为明显。本研究结果显示,应用约登指数得出最佳截点,4项肿瘤标志物联合诊断的灵敏度、特异度、准确度、阳性预测值和阴性预测值均显著高于单独诊断。联合诊断可减少不同标志物对特殊类型肺癌敏感度不高的不足,也可以减少假阳性例数而提高特异度。
综上所述,应用ProGRP、SCC-Ag、Cyfra21-1和CEA 4项肿瘤标志物联合诊断肺癌具有较高的诊断效能,其最佳截点为ProGRP>47.5 ng/L、SCC-Ag>2.12 μg/L、Cyfra21-1>3.41 μg/L和CEA>5.98 μg/L。
[参考文献]
[1] Zheng R,Zeng H,Zhang S,et al. National estimates of cancer prevalence in China,2011[J]. Cancer Lett,2016,370(1):33-38.
[2] 王静,贾敬好,杨海芳,等.非小细胞肺癌放疗前后血清TGF-β1水平测定的临床意义[J].河北医科大学学报,2017,38(6):654-658.
[3] 石国一,刘玉玲,王敏.VEGF、HIF-1α、COX-2在非小细胞肺癌中的表达及意义[J].河北医科大学学报,2016,37(3):256-259.
[4] 吴小明.5项血清肿瘤标志物在肺癌诊断中的应用[J].河北医科大学学报,2010,31(6):682-684.
[5] Sone K,Oguri T,Ito K,et al. Predictive Role of CYFRA21-1 and CEA for Subsequent Docetaxel in Non-small Cell Lung Cancer Patients[J]. Anticancer Res,2017,37(9):5125-5131.
[6] 李远平,彭华利,龙永贵.多种肿瘤标志物的联合检测诊断肺癌的临床价值[J].医学分子生物学杂志,2015,12(5):286-289.
[7] 支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(1):67-78.
[8] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide: sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-386.
[9] 石远凯,孙燕,于金明,等.中国晚期原发性肺癌诊治专家共识(2016年版)[J].中国肺癌杂志,2016,19(1):1-15.
[10] Molina R,Marrades RM,Augé JM,et al. Assessment of a Combined Panel of Six Serum Tumor Markers for Lung Cancer[J]. Am J Respir Crit Care Med,2016,193(4):427-437.
[11] Liu L,Liu B,Zhu LL,et al. Clinical significance of CYFRA21-1,Scc-Ag and telomerase activity in serum and pleural effusion of patients with squamous-cell lung cancer[J]. Bioanalysis,2012,4(19):2367-2374.
[12] Holdenrieder S,Wehnl B,Hettwer K,et al. Carcinoembryonic antigen and cytokeratin-19 fragments for assessment of therapy response in non-small cell lung cancer: a systematic review and meta-analysis[J]. Br J Cancer,2017,116(8):1037-1045.
[13] Nakamura H,Nishimura T. History,molecular features,and clinical importance of conventional serum biomarkers in lung cancer[J]. Surg Today,2017,47(9):1037-1059.
[14] Xiong W,Zhao Y,Xu M,et al. The relationship between tumor markers and pulmonary embolism in lung cancer[J]. Oncotarget,2017,8(25):41412-41421.
[15] Liu L,Teng J,Zhang L,et al. The Combination of the tumor markers suggests the histological diagnosis of lung cancer[J]. Biomed Res Int,2017,2017:2013989.
[16] Molina R,Augé JM,Bosch X,et al. Usefulness of serum tumor markers,including progastrin-releasing peptide,in patients with lung cancer:correlation with histology[J]. Tumour Biol,2009,30(3):121-129.