·论 著·
血必净对急性百草枯中毒大鼠肺损伤保护作用的研究
王 鑫
(河北省邯郸市中心医院急诊科,河北 邯郸 056001)
[摘要] 目的研究血必净对急性百草枯大鼠肺组织中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽-过氧化物酶(glutathione peroxidase,GSH-PX)活力,丙二醛(malonaldehyde,MDA)含量以及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素10(interleukin-10,IL-10)表达的影响,探讨血必净治疗急性百草枯中毒的机制。方法将108只Wister大鼠用随机数字表法分为对照组、染毒组、治疗组各36只。在1,3,7,14,21,28 d每组各取6只,在乙醚麻醉下开胸,留取右下肺组织标本,测SOD、GSH-PX活力及MDA含量,行免疫组织化学检测肺组织TNF-α、IL-10蛋白表达水平。结果染毒组和治疗组SOD活性随时间沿长逐渐升高(P<0.05);染毒组各时点SOD活性低于对照组。治疗组各时点SOD活性高于染毒组,但仍低于对照组(P<0.05)。染毒组和治疗组GSH-PX活性随时间沿长逐渐升高(P<0.05);染毒组和治疗组各时点GSH-PX活性低于对照组,治疗组各时点GSH-PX活性高于染毒组(P<0.05)。染毒组和治疗组MDA活性随时间沿长逐渐降低(P<0.05);染毒组和治疗组各时点MDA活性高于对照组,治疗组各时点MDA活性低于染毒组(P<0.05)。染毒组和治疗组肺组织TNF-α和IL-10含量先升高再降低;染毒组和治疗组各时点肺组织TNF-α和IL-10含量表达高于对照组,治疗组各时点肺组织TNF-α和IL-10含量低于染毒组(P<0.05)。结论氧自由基和细胞因子TNF-α、IL-10在百草枯所致大鼠肺损伤中起重要作用;血必净能够减轻染毒大鼠肺组织损伤。
[关键词]中毒;百草枯;血必净;大鼠 doi:10.3969/j.issn.1007-3205.2018.09.005
百草枯是非选择性联吡啶类除草剂,具有喷洒后起效快、遇土失活的特性,百草枯对环境几乎没有影响,目前在世界上广泛使用[1]。但百草枯对人畜毒性很强,近年来百草枯中毒事件频发,且呈逐年上升的趋势,已成为影响大众健康的急危重症。百草枯中毒可导致全身多个脏器受损,由于肺泡上皮细胞的季胺类分子载体可以向细胞内转运百草枯分子,故肺是其损伤的主要靶器官,早期表现为肺泡内渗液增多,后期则出现肺间质纤维化和呼吸窘迫[2]。然而,百草枯导致肺损伤的确切机制还未完全阐明,也缺乏有效的治疗药物。氧化损伤与细胞因子在器官损伤的发生发展中起重要调控作用,也成为中毒治疗学的研究热点。本研究建立百草枯中毒大鼠模型,观察肺组织病理学改变,通过测定肺组织匀浆中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽-过氧化物酶(glutathione peroxidase,GSH-PX)活力及丙二醛(malonaldehyde,MDA)含量,并采用免疫组织化学(immunohistochemistry,IH)方法观察肺组织中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素10(interleukin-10,IL-10)的表达以及血必净注射液对其表达的影响,旨在探讨百草枯中毒导致肺损伤的机制和血必净对其治疗的作用。
1 材 料 与 方 法
1.1实验材料及试剂 实验动物由河北省实验动物中心提供,健康清洁Wister大鼠108只,体重220~270 g, 雌雄不拘,所有大鼠为适应环境,饲养于湿度约50%、温度约22 ℃的无菌动物室内,分笼喂养,自由饮水,每天定点更换垫料、饲料和饮用水,1周后,饮食活动、精神状态均正常的大鼠进入实验。20%百草枯原液由英国先正达(中国)科技股份有限公司生产。血必净注射液购于天津红日药业股份有限公司(批准字号:国药准字Z20040033)。MDA检测试剂盒、SOD检测试剂盒、GSH-PX试剂盒及考马斯亮蓝蛋白检测试剂盒均购自南京建成生物工程研究所。兔抗鼠TNF-α、IL-10多克隆抗体、DAB显色试剂盒、SABC二抗试剂盒由武汉博士德生物工程有限公司生产。台式低速离心机(0412-1)、恒温干燥箱、电热恒温水浴箱、大鼠代谢笼均由上海跃进医用仪器厂生产,-80 ℃冰箱均购自日本Sanyo株式会社,显微光镜照相机由日本Nikon公司生产。
1.2动物分组及模型制备 根据随机数字表法,将108只Wister大鼠分为对照组、染毒组、治疗组各36只。染毒组及治疗组将20%百草枯按25 mg/kg计算,用0.9%氯化钠稀释至1 mL,给染毒组及治疗组大鼠腹腔内一次性注射,制作中毒模型。然后,治疗组大鼠每天1次腹腔注射血必净 4 mL/kg,对照组及染毒组腹腔内注射等量生理盐水,于相应时间点留取标本。
1.3取材及样品制备 3组动物按1,3,7,14,21,28 d分为6个亚组,每个亚组6只,大鼠在每个时间点禁食水4 h后取出,用乙醚熏蒸的方式进行麻醉,剃除大鼠胸部的毛发,使用医用乙醇清毒皮肤,组织剪200 ℃火烧灭菌,逐层打开胸腔,在气管隆突处分离,并剪断气管,取出肺组织,从肺的右下极切取肺块为标本,剔除包膜及结缔组织,用0 ℃ PBS水清洗血渍,用滤纸擦干,放入盛有10%中性甲醛的容器中固定,石蜡包埋,切片,制成约5 μm的标本,以备组织学光镜检查及免疫组织化学检测TNF-α、IL-10的表达;其余肺组织制备匀浆,采用黄嘌呤氧化酶法测定SOD的活力、酶促反应谷胱甘肽消耗法测量GSH-PX的活力、硫代巴比妥酸法检测MDA的含量。
1.4免疫组织化学染色(immunocytochemistry,IH) 严格按照链霉亲和素-生物素标记法SABC试剂盒说明书操作。首先,组织切片机切取标本蜡块,制备约5 μm厚的切片,使用pH=7.14 PBS液二甲苯脱蜡3×3 min,不同溶度乙醇(100%→95%→80%→70%)进行脱水3×5 min,脱水切片放入新鲜配置的3%H2O2甲醇37 ℃孵育30 min以灭活内源性过氧化物酶,再次PBS缓冲液浸泡3×5 min,切片放入92~98 ℃ 0.01 mol/L枸橼酸缓冲液(pH=6.0)中煮沸半小时修复抗原,为减少非正常染色,10%正常山羊血清(PBS稀释)封闭游离的结合位点,滴加一抗工作液,兔抗鼠TNF-α、IL-10多克隆抗体,4 ℃孵育过夜,用PBS缓冲液代替一抗作阴性对照。之后,再次PBS液冲洗3×5 min;加入生物素标记二抗工作液,常温下孵育30 min,使用PBS液冲洗;滴加辣根过氧化物酶标记的链霉素-卵白素工作液,孵育30 min,再次使用PBS液冲洗;切片中滴加DAB显色剂,显色3 min,蒸馏水冲洗切片,苏木精复染5 min,酒精分化,伊红染色,依次应用梯度乙醇脱水,二甲苯Ⅰ、Ⅱ透明,中性树胶封固。依次从每组切片中随机取5张切片,在每张切片上任意取10个高倍视野,并且相互不重叠。结果判定:以棕黄色颗粒状免疫复合物出现在胞浆和(或)胞核中为阳性细胞,400倍光学显微镜拍照、观察、保存。免疫组织化学分析软件Image-Pro Plus 6.0检测TNF-α、IL-10平均吸光度值,并且测量背景值,用前者减去后者作为该标本的最后结果,统计学方法处理吸光度值。
1.5组织匀浆的制备 切取新鲜的肺组织块剪碎称重,放入容器中,称取9倍于组织块重量的4 ℃ 0.9%氯化钠倒入上述容器中,然后一起倒入玻璃匀浆器中,制备10%的组织匀浆,将匀浆以3 000~4 000 r/min离心10~15 min,取上清液,测定SOD、GSH-PX活力和MDA含量。
1.6统计学方法 应用SPSS 19.0统计软件分析数据,计量数据比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠肺组织结构的病理改变 对照组大鼠大体可见,肺表面包膜呈淡红色,光滑质软有弹性,无水肿及淤点。光镜下观察肺泡排列整齐,壁薄,结构清晰完整,肺泡腔内无渗出,肺间质有少量纤维组织,未见充血及增宽。
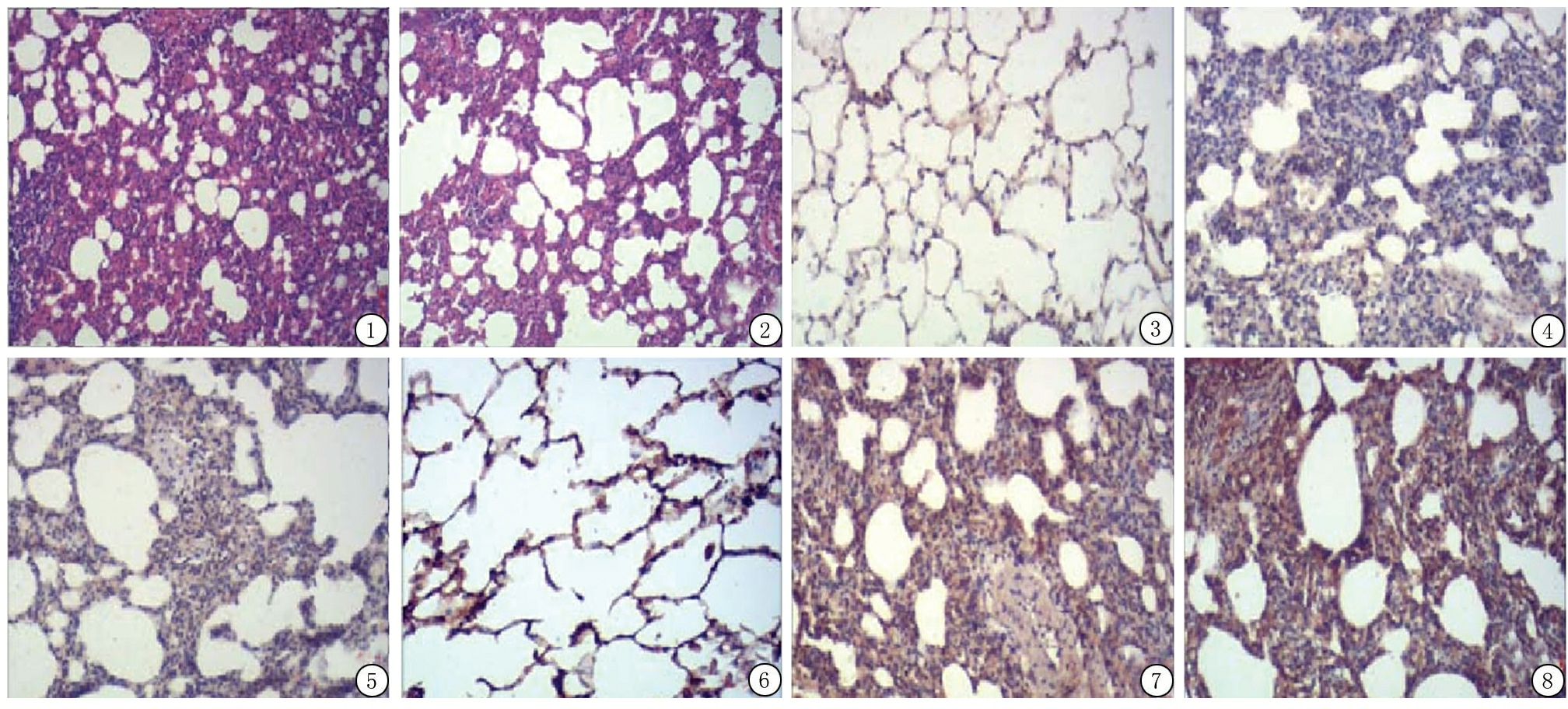
染毒组大鼠肺脏外观可见,体积明显变大,呈暗红色,包膜紧张、张力高,水肿显著,沿肺边缘分布有散在出血点,肺表面可见大片淤斑,切面有淤血渗出。光镜下可见肺泡壁结构破坏,充血、肿胀,部分肺泡塌陷,肺泡内红细胞聚集,有粉红色渗出液及纤维素,周围肺组织区域出血显著,肺间质增厚,气管及周围血管水肿,有大量炎细胞浸润,主要为中性粒细胞、单核巨噬细胞、淋巴细胞。7 d时弥漫性肺出血,肺泡和肺间质水肿达到高峰,多个肺泡表面有透明膜形成,以中性粒细胞肺泡炎病变为主。21 d时肺间质内有大量成纤维细胞增生。28 d时肺间质胶原纤维增厚(图1)。
治疗组病理学改变介于染毒组与对照组之间。血必净明显抑制了肺泡和肺间质周围的炎细胞浸润及水肿,与染毒组比较,肺泡及肺间质病变有不同程度的改善(图2)。
2.2各组大鼠肺组织SOD、GSH-PX、MDA测定结果
2.2.1SOD活性测定 对照组各时点SOD活性差异无统计学意义(P>0.05),染毒组和治疗组SOD活性随时间沿长逐渐升高,差异有统计学意义(P<0.05);染毒组各时点SOD活性低于对照组,治疗组各时点SOD活性高于染毒组,但各时点SOD活性仍低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2.2GSH-PX活性测定 对照组各时点GSH-PX活性差异无统计学意义(P>0.05),染毒组和治疗组GSH-PX活性随时间沿长逐渐升高,差异有统计学意义(P<0.05);染毒组和治疗组各时点GSH-PX活性低于对照组,治疗组各时点SOD活性高于染毒组,差异有统计学意义(P<0.05)。见表1。
2.2.3MDA含量测定 对照组各时点MDA活性差异无统计学意义(P>0.05),染毒组和治疗组MDA活性随时间沿长逐渐降低,差异有统计学意义(P<0.05);染毒组和治疗组各时点MDA活性高于对照组,治疗组各时点MDA活性低于染毒组,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠肺组织MDA、GSH-PX、SOD水平比较
Table1Comparison of MDA,GSH-PX and SOD levels in lung tissue of rats in each group
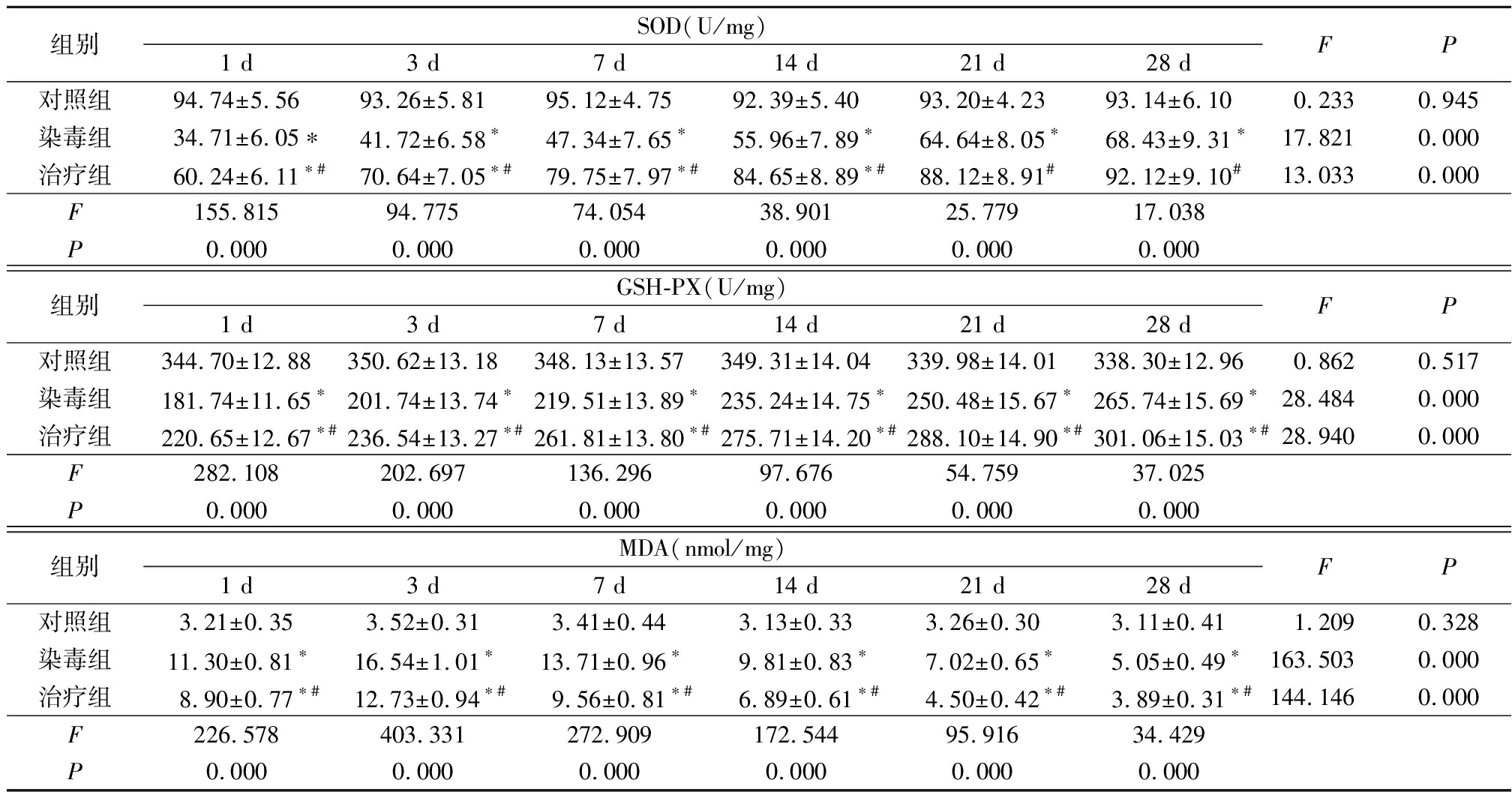
组别SOD(U/mg)1 d3 d7 d14 d21 d28 dFP对照组94.74±5.5693.26±5.8195.12±4.7592.39±5.4093.20±4.2393.14±6.100.2330.945染毒组34.71±6.05∗41.72±6.58∗47.34±7.65∗55.96±7.89∗64.64±8.05∗68.43±9.31∗17.8210.000治疗组60.24±6.11∗#70.64±7.05∗#79.75±7.97∗#84.65±8.89∗#88.12±8.91# 92.12±9.10# 13.0330.000F155.81594.77574.05438.90125.77917.038P0.0000.0000.0000.0000.0000.000组别GSH-PX(U/mg)1 d3 d7 d14 d21 d28 dFP对照组344.70±12.88350.62±13.18348.13±13.57349.31±14.04339.98±14.01338.30±12.960.8620.517染毒组181.74±11.65∗201.74±13.74∗219.51±13.89∗235.24±14.75∗250.48±15.67∗265.74±15.69∗28.4840.000治疗组220.65±12.67∗#236.54±13.27∗#261.81±13.80∗#275.71±14.20∗#288.10±14.90∗#301.06±15.03∗#28.9400.000F282.108202.697136.29697.67654.75937.025P0.0000.0000.0000.0000.0000.000组别MDA(nmol/mg)1 d3 d7 d14 d21 d28 dFP对照组3.21±0.353.52±0.313.41±0.443.13±0.333.26±0.303.11±0.411.2090.328染毒组11.30±0.81∗16.54±1.01∗13.71±0.96∗9.81±0.83∗7.02±0.65∗5.05±0.49∗163.5030.000治疗组8.90±0.77∗#12.73±0.94∗#9.56±0.81∗#6.89±0.61∗#4.50±0.42∗#3.89±0.31∗#144.1460.000F226.578403.331272.909172.54495.91634.429P0.0000.0000.0000.0000.0000.000
*P<0.05与对照组比较 #P<0.05与染毒组比较(SNK-q检验)
2.3大鼠肺组织免疫组织化学染色结果
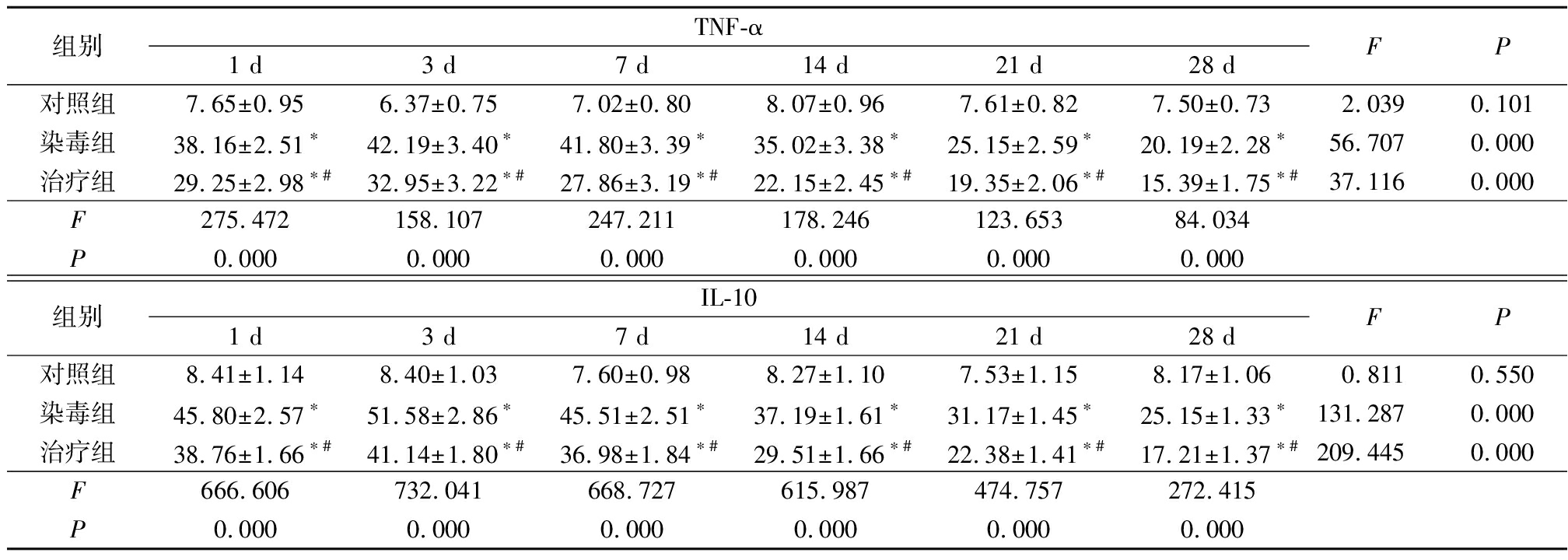
2.3.1TNF-α蛋白的表达 对照组各时点肺组织TNF-α蛋白表达差异无统计学意义(P>0.05),染毒组和治疗组肺组织TNF-α蛋白表达先升高再降低,差异有统计学意义(P<0.05);染毒组和治疗组各时点肺组织TNF-α蛋白表达高于对照组,治疗组各时点肺组织TNF-α蛋白表达低于染毒组,差异有统计学意义(P<0.05)。见表2,图3~5。
2.3.2IL-10含量变化 对照组各时点肺组织IL-10含量差异无统计学意义(P>0.05),染毒组和治疗组肺组织IL-10含量先升高再降低,差异有统计学意义(P<0.05);染毒组和治疗组各时点肺组织IL-10含量高于对照组,治疗组各时点肺组织IL-10含量低于染毒组,差异有统计学意义(P<0.05)。见表2,图6~8。
表2 各组大鼠肺组织免疫组织化学染色结果
Table2Immunohistochemical staining results of lung tissue in rats of each group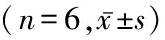
组别TNF-α1 d3 d7 d14 d21 d28 dFP对照组7.65±0.956.37±0.757.02±0.808.07±0.967.61±0.827.50±0.732.0390.101染毒组38.16±2.51∗42.19±3.40∗41.80±3.39∗35.02±3.38∗25.15±2.59∗20.19±2.28∗56.7070.000治疗组29.25±2.98∗#32.95±3.22∗#27.86±3.19∗#22.15±2.45∗#19.35±2.06∗#15.39±1.75∗#37.1160.000F275.472158.107247.211178.246123.65384.034P0.0000.0000.0000.0000.0000.000组别IL-101 d3 d7 d14 d21 d28 dFP对照组8.41±1.148.40±1.037.60±0.988.27±1.107.53±1.158.17±1.060.8110.550染毒组45.80±2.57∗51.58±2.86∗45.51±2.51∗37.19±1.61∗31.17±1.45∗25.15±1.33∗131.2870.000治疗组38.76±1.66∗#41.14±1.80∗#36.98±1.84∗#29.51±1.66∗#22.38±1.41∗#17.21±1.37∗#209.4450.000F666.606732.041668.727615.987474.757272.415P0.0000.0000.0000.0000.0000.000
*P<0.05与对照组比较 #P<0.05与染毒组比较(SNK-q检验)
图1 染毒组7 d肺组织结构(HE ×400)
Figure1Lung tissue structure in poisoned group at day7(HE×400)
图2治疗组7d肺组织结构(HE×400)
Figure2Lung tissue structure in treatment group at day7(HE×400)
图3对照组3d TNF-α蛋白表达(IH×400)
Figure3The expressions of TNF-α in control group(IH×400)
图4染毒组3d TNF-α蛋白表达(IH×400)
Figure4The expressions of TNF-α in poisoned group at day3(IH×400)
图5治疗组3d TNF-α蛋白表达(IH×400)
Figure5The expressions of TNF-α in treatment group at day3(IH×400)
图6对照组3d IL-10含量表达(IH×400)
Figure6The expressions of IL-10in control group at day3(IH×400)
图7染毒组3d IL-10含量表达(IH×400)
Figure7The expressions of IL-10,TNF-α in poisoned group at day3(IH×400)
图8治疗组3d IL-10含量表达(IH×400)
Figure8The expressions of IL-10in treatment group at day3(IH×400)
3 讨 论
百草枯商品名为克芜踪、对草快,市售为20%水溶液。百草枯合成于19世纪,属于联吡啶类触杀型除草剂。哺乳类动物肺泡Ⅰ型和Ⅱ型上皮细胞具有胺类物质转运系统,百草枯分子结构因与胺类物质相似,其进入机体后,可以被肺脏上皮细胞主动转运并蓄积,肺组织内百草枯浓度较高;百草枯中毒早期有大量中性粒细胞在肺内聚积,释放大量炎性细胞因子,故肺成为中毒早期被攻击的靶器官[3]。本研究观察了急性百草枯中毒大鼠肺组织的病理变化,肉眼可见染毒组大鼠肺组织呈暗红色,体积明显变大,肿胀明显,张力高、质软,包膜紧张,有弹性,表面散在出血点。光镜下可见气管及血管周围水肿,毛细血管扩张,大量炎性细胞浸润,肺泡壁结构破坏,肺泡塌陷,肺泡壁充血、水肿,部分肺泡内有水肿液及纤维素沉积,肺间质普遍增厚,病变肺泡周围出现代偿性肺气肿。以上病理变化均提示百草枯可导致肺损伤,但确切机制还不十分清楚。
动物实验和临床研究显示,百草枯分子作为电子受体,通过一系列反应,生成更多的氧自由基,从而导致机体氧化损伤、脂质过氧化反应及炎性细胞因子的产生[4]。由于氧自由基不易测定,本研究选择SOD、GSH-PX以及MDA作为观察指标。SOD的作用底物是超氧阴离子(O2-)自由基,是体内重要的自由基清除酶,也是自由基清除的第一关[5]。SOD通过清除、调节OH-、O2-等活性氧自由基,减轻或阻断过氧化反应,使过氧化物分解为无毒的醇。GSH-PX是自由基清除酶系中另一种重要的酶,既可以使有毒的过氧化物转化成无毒的羟基化合物,同时又分解H2O2阻止脂质过氧化反应,使体内氧化-还原系统保持动态平衡,从而保护细胞膜或细胞器膜的结构及功能免受自由基的损害[6]。SOD、GSH-PX活力的降低意味着清除氧自由基能力的下降。MDA是脂质过氧化过程中形成的一种终末代谢产物,检测其含量可反映机体脂质过氧化损伤的程度。本研究检测了百草枯中毒大鼠肺组织匀浆中SOD、GSH-PX的活力及MDA的含量,结果显示百草枯染毒大鼠在早期即出现SOD、GSH-PX的活力下降,此后虽有恢复,但仍低于对照组,提示百草枯在代谢过程中机体处于氧化应激状态,产生了大量有活性的自由基,从而消耗了机体的自由基清除酶。同时检测到染毒大鼠肺组织中MDA含量明显升高,细胞脂质过氧化反应增强,导致肺损伤。而SOD及GSH-PX由于参与抗氧化而大量消耗,活性均明显下降,提示染毒大鼠体内自由基明显增多,机体处于氧化应激状态,脂质过氧化反应增强,从而诱发肺损伤。
现代分子细胞学研究发现,炎性因子的产生可能是百草枯中毒导致肺损伤的另一个主要因素[7]。在已有的报道中,无论是腹腔注射百草枯,还是百草枯灌胃制造大鼠中毒模型,均证明百草枯中毒后发生的器官损伤与炎性细胞因子密切相关[8]。佟飞等[9]研究发现,在百草枯中毒后,大鼠肺组织中NF-κB和磷酸化p38(p38 MAPK)水平明显升高,与对照组比较差异有统计学意义。动物实验和临床研究均证实,多种细胞因子可以激活p38 MAPK通路,并通过信号传递,调控细胞凋亡和机体免疫[10]。上述结果表明炎性细胞因子含量升高可能与百草枯诱导的器官功能衰竭、病死率升高紧密相关。
本研究结果显示,百草枯染毒大鼠肺组织中细胞因子TNF-α和IL-10呈高表达,推测它们可能参与了肺组织的损伤过程。TNF-α作为炎症调控网络的核心因子,具有广泛的生物学特性,在炎性介质的生成、氧自由基导致的脏器损伤、中性粒细胞在肺内的聚集等病理过程中起着重要作用[11]。TNF-α在炎症反应的早期,是由活化的单核巨噬细胞产生的。基础研究已证明TNF-α是急性肺损伤早期的重要炎症因子。蒋玮[12]直接静脉注射TNF-α可引起肺泡内渗出增多,上皮细胞肿胀,而且毛细血管内皮细胞的广泛性损伤、通透性增加,清除TNF-α后,则上述病理改变明显好转。陈达[13]研究显示,在百草枯中毒大鼠的早期,肺组织中即有TNF-α的高表达,认为TNF-α参与了百草枯导致早期急性肺损伤以及后期纤维化的病理过程。本研究结果显示,染毒大鼠各时点肺组织TNF-α含量均高于对照组。表明TNF-α是百草枯中毒后早期释放的促炎因子,其在百草枯导致的肺损伤中发挥了重要作用。
IL-10是体内重要的抗炎细胞因子之一,具有抗炎和抑制机体免疫力双重属性,主要由单核细胞、巨噬细胞和T细胞产生。IL-10分泌后一方面抑制单核细胞、巨噬细胞和T细胞的活性,减少这些细胞合成和释放其他炎症细胞因子,另一方面降低单核细胞杀伤微生物的能力,抑制机体的免疫功能。宋静等[14]认为IL-10是急性肺损伤早期的抗炎介质,可减轻炎症反应引起的细胞损伤。有关IL-10与百草枯之间的关系,目前国内外尚缺乏报道。本研究中IL-10在染毒后显著升高,其作为抗炎细胞因子,高表达提示机体免疫调控失衡,可能与百草枯肺损伤有关。
目前,百草枯中毒的治疗仍处于探索阶段,无特效解毒药物。中药针剂血必净前身是神农33,是王今达教授从30多味中草药处方中以古方血府逐瘀汤为基础筛选出的注射液,为国家二类新药,主要由当归、赤芍、鱼腥草、红花、川芎、丹参等组成,具有活血化瘀、疏通经络之功效,其有效成分为川芎嗪、红花黄色素、阿魏酸、原儿茶醛、丹参素[15]。现化药理学研究认为,血必净能清除氧自由基,提高自由基清除酶系的活性,增加组织耐缺氧能力,改善局部血液循环,降低急性炎症毛细血管的通透性,减少渗出,降低内毒素水平,拮抗单核细胞、巨噬细胞系统产生的内源性炎性介质的释放,调节免疫及炎性介质的功能,临床上主要用于全身炎症反应综合征及多器官功能障碍综合征等危重症的治疗。已有临床资料证实血必净注射液可保护中毒患者的脏器功能并促进其恢复,提高患者的救治率[16]。本研究治疗组经血必净处理后,染毒大鼠肺泡毛细血管扩张、充血以及炎性细胞浸润显著好转,说明血必净注射液可延缓病情发展,抑制百草枯对肺的损伤;肺组织中SOD、GSH-PX的活性明显高于染毒组,而MDA的含量却低于染毒组,提示血必净具有抗氧化作用;免疫组织化学检测显示,治疗组在不同时间点TNF-α和IL-10表达均低于染毒组,说明血必净可抑制炎症因子的过度表达。
总之,本研究一方面证实了氧化反应、炎症介质TNF-α和IL-10参与了百草枯导致的肺损伤,另一方面也验证了血必净注射液具有多靶点保护脏器功能的作用,从而为百草枯中毒治疗提供了一个新的途径。
[参考文献]
[1] 中国医师协会急诊医师分会.急性百草枯中毒诊治专家共识(2013)[J].中国急救医学,2013,33(6):484-489.
[2] 董建光,邱泽武.百草枯中毒致肺纤维化的治疗现状[J].中国医刊,2017,52(2):23-26.
[3] Xu L,Xu J,Wang Z. Molecular mechanisms of paraquat-induced acute lung injury:a current review[J]. Drug Chem Toxicol,2014,37(2):130-134.
[4] Jiang YS,Ma YY,Wang ZQ,et al. Therapeutic effects of smeeta or smectite powder on rats with paraquat toxieation[J]. World J Emerg Med,2013,4(2):144-150.
[5] 郝斌,王切,王素玲,等.EC-SOD在肾缺血再灌注损伤大鼠脑内的表达变化[J].河北医科大学学报,2017,38(5):552-556.
[6] 方志成,方珂,郑翔.氧化应激反应在颅内动脉瘤合并心肌损伤中的作用[J].现代中西医结合杂志,2017,26(19):2061-2063.
[7] 武国艳,温宇英,白祥琰,等.硫辛酸通过Nrf 2-ARE信号通路对百草枯中毒大鼠急性肺损伤保护作用的研究[J].中华急诊医学杂志,2017,26(7):773-778.
[8] 肖小荣,陈思伟,詹兰芬,等.氨溴索在百草枯中毒大鼠肺纤维化中的保护作用[J].中国医药导报,2017,14(10):35-38.
[9] 佟飞,田英平,霍书花,等.p38MAPK及核因子-KB在百草枯致大鼠肺损伤中的变化[J].中华劳动卫生职业病杂志,2007,25(9):518-522.
[10] 舒怡.基于ERK1/2和p38MAPK探讨黄葵总黄酮对克罗恩病模型小鼠的治疗作用及其机制[D].南京:南京中医药大学,2017.
[11] 曹蓉蓉,马俊玥,李淑慧,等.TNF-α对鼠根尖乳头干细胞增殖及多向分化能力的影响[J].重庆医学,2017,46(14):1874-1877.
[12] 蒋玮.新生大鼠急性高氧肺损伤肺组织中SIRT1、TNF-α的蛋白表达及白藜芦醇的干预作用[D].苏州:苏州大学,2016.
[13] 陈达.雷帕霉素干预急性百草枯中毒大鼠肺损伤机制的研究[D].沈阳:中国医科大学,2014.
[14] 宋静,张蕴萍.干细胞动员对急性肺损伤大鼠肺泡表面活性物质和炎性因子表达的影响[J].中华实用诊断与治疗杂志,2017,31(4):341-344.
[15] 王靓,郑云辉.血必净注射液药理研究进展[J].临床医药实践,2016,25(7):542-543,544.
[16] 史立信,马志军,王清涛,等.血必净注射液对急性重型颅脑损伤患者多器官功能的影响[J].中国实用神经疾病杂志,2017,20(4):11-44.
Study on the protective effect of Xuebijing on lung injury in rats with acute paraquat poisoning
WANG Xin
(Department of Emergency,Handan Central Hospital,Hebei Province,Handan056001,China)
[Abstract]ObjectiveTo explore the mechanism of Xuebijing in the treatment of acute paraquat poisoning by studying the effects of Xuebijing on the activity of superoxide dismutase(SOD) and glutathione peroxidase(GSH-PX), the content of malonaldehyde(MDA) and the expression of tumor necrosis factor-α(TNF-α), interleukin-10(IL-10) in acute paraquat lung tissue.MethodsOn the base of random number table,108 Wister rats were divided into control group(36 rats), poisoned group(36 rats), treatment group(36 rats). On 1 st, 3 rd, 7 th, 14 th, 21 st and 28 th day,six rats from each group were anaesthetized by intraperitoneal injection of chloral hydrate. Open chest under ether anesthesia and leave the right lower lung tissue specimens to measure the activity of SOD and GSH-PX and the content of MDA. The expression levels of TNF-α, IL-10 in lung tissue were detected by immunohistochemical staining.ResultsThe activity of SOD in the poisoned and treatment group increased gradually along the length of time(P<0.05). The activity of SOD in each time point of the poisoned group was lower than that of the control group(P<0.05). The activity of SOD in the treatment group was higher than that of the infected group, but it was still lower than that of the control group(P<0.05). The activity of GSH-PX increased gradually along with the time in the poisoned and the treatment group(P<0.05).The GSH-PX activity in the poisoned and the treatment group was lower than that in the control group at all time points, and the GSH-PX activity at each time point in the treatment group was higher than that in the poisoned group(P<0.05). The MDA activity in the poisoned and the treatment group gradually was decreased along with the time length(P<0.05). The MDA activity in the posioned and the treatment group at each time point was higher than that in the control group, and the MDA activity at each time point in the treatment group was lower than that in the posioned group(P<0.05). The expression of TNF-α protein and the content of IL-10 in the lung tissue of the poisoned and the treatment group increased first and then decreased. The expression level of TNF-α, IL-10 protein in lung tissue of the poisoned and the treatment group was higher than that of the control group(P<0.05). The expression level of TNF-α, IL-10 in lung tissue at each time point in the treatment group were lower than those in the exposure group(P<0.05).ConclusionOxygen free radicals and cytokine TNF-α, IL-10 play an important role in lung injury induced by paraquat in rats. Xuebijing can reduce the injury of lung tissue in paraquat-poisoning rats.
[Key words]poisoning; paraquat; Xuebijing; rats
[收稿日期]2017-12-18;
[中图分类号]R595.5
[文献标志码]A
[文章编号]1007-3205(2018)09-1010-07
[修回日期]2018-01-03
[作者简介]王鑫(1970-),男,河北邯郸人,河北省邯郸市中心医院副主任医师,医学硕士,从事危重症诊治研究。
(本文编辑:赵丽洁)
![]()