·论 著·
大鼠SAH后学习记忆改变与炎症反应的相关性
高建亮1,张中原1,张小章1,孙林林2,付爱军2*
(1.华北理工大学附属遵化市人民医院神经外科,河北 遵化 064200;2.华北理工大学附属医院神经外科,河北 唐山 063000)
[摘要] 目的观察蛛网膜下腔出血(subarachnoid hemorrhage,SAH)对大鼠早期学习记忆能力的影响,探讨SAH大鼠血浆炎症因子与大鼠学习记忆变化的关系。方法将无特定病原体(specefic pathogen free,SPF)级SD健康雄性大鼠108只随机分为3组各36只,分别为空白组、假手术组、SAH模型组。每组大鼠又按6、24、72 h时间点分为3个亚组,每个时点12只。SAH模型组采用经颈内动脉穿刺法建立,假手术组只分离不穿刺颈内动脉,空白组不作处理。通过对各组大鼠水迷宫试验进行比较,记录每组大鼠各个时间点的学习及记忆的变化。然后腹主动脉取血,采用酶联免疫吸附测定法检测各组大鼠血浆中炎症因子白细胞介素1β(interleukin-1β,IL-1β)、IL-6含量。结果在水迷宫试验中,SAH模型组6,24,72 h到达平台时间较空白组和假手术组明显延长(P<0.05), SAH模型组在目标象限内驻留时间百分比明显低于空白组和假手术组(P<0.05)。SAH模型组6,24,72 h IL-1β和IL-6水平明显高于空白组和假手术组(P<0.05)。结论SAH大鼠早期出现学习记忆能力下降。SAH早期大鼠学习记忆能力下降可能与SAH后炎症反应有关。
[关键词]蛛网膜下腔出血;炎症反应;学习记忆 doi:10.3969/j.issn.1007-3205.2018.09.019
自发性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)被认为是一种重症脑血管疾病,多发于40~60岁人群,脑动脉瘤破裂是导致SAH的主要原因,其次是外伤、炎症等[1-2],具有很高的致死率和致残率。世界卫生组织调查结果表明,我国SAH发病率为每年(6~20)/10万人[3],致死率为32%~67%[4]。早期如并发脑血管痉挛会致脑梗死或急性脑积水等[5]。尽管对SAH的治疗取得了很大进步,但SAH的病死率和致残率仍很高,给患者家庭及社会造成极大的负担。SAH后对人的影响是多方面的,动脉瘤破裂如何进展到危及患者的生命,至今存在很多未知[6]。因当今技术条件所限,对SAH病理、生理机制变化的研究仍未有清晰的诠释,其中可能的原因之一是动物模型不能真实地模拟动脉瘤突然破裂所形成的SAH[7]。SAH后早期炎症反应可能是脑血管痉挛和早期脑损伤均存在的病理生理过程,并且早期炎症造成的损伤及自身保护反应在其中发挥了重要的作用。本研究对SAH后炎症反应与大鼠记忆力改变的相互联系进行探讨,报告如下。
1 材 料 与 方 法
1.1实验动物 无特定病原体(specefic pathogen free, SPF)级SD健康大鼠108只,购于中国人民解放军军事医学科学院卫生学环境医学研究所实验动物研究中心[SCXK-(军)2014-0001],均为雄性,体重320~350 g,于华北理工大学屏障环境实验动物中心进行饲养[SYXK(冀)2015-0038],饲养环境为适宜光照、良好通风、温湿度适宜、按需饮水摄食。在实验开始之前将SD大鼠进行适应环境饲养1周。适量提供饲料及饮用水,实验大鼠在喂养过程中无伤病及疫情发生,生存良好[8]。将大鼠随机分为空白组、假手术组、SAH模型组,按取标本的时间不同又分为SAH后6,24,72 h亚组,如有死亡或建模失败,则用备用大鼠进行补充。
1.2主要药品及试剂 多聚甲醛固定液,兔抗Beclin-1克隆抗体,抗体稀释液,Rat白细胞介素1(interleukin-1,IL-1)试剂盒,Rat IL-6试剂盒,丙二醛试剂盒等。
1.3主要仪器与器材 显微外科手术器械,超低温保存箱,水迷宫试验视频系统,图像分析采集系统,ZMN-7803冷冻台,Leica手术显微镜等。
1.4实验方法
1.4.1麻醉 准备好手术器械备用,取大鼠在天平上称重,配置10%水合氯醛溶液备用,根据所称大鼠体重,按0.3~0.4 mL/100 g的剂量,采用腹腔内注射方式给药,麻醉约5~10 min后,观察大鼠呼吸缓慢、平缓,无角膜反射,刺激肢体无反应,四肢肌张力明显减低呈现软瘫,即可判断为麻醉成功。
1.4.2术前准备 将麻醉成功后大鼠呈仰卧位,头朝上放置于解剖台上,四肢及头颅固定,保持呼吸道通畅,保温毯覆盖躯体,设定手术体温控制仪为38 ℃,常规消毒手术皮肤,备好纤芯,用记号笔在纤芯一端20 mm及22 mm处分别作标记[9],打开Leica手术显微镜。
1.4.3解剖颈部组织及血管 将大鼠颈前手术区备皮后,在Leica手术显微镜下,沿颈部中线逐层剪开皮肤,钝性分离右侧皮下组织,分离迷走神经和颈总动脉,颈内动脉及颈外动脉2个分支,在颈外动脉与甲状腺上动脉连接根部穿双线,分别结扎颈外动脉远端及颈外动脉,剪断颈外动脉,同时结扎并剪断甲状腺上动脉,先用显微动脉夹夹闭颈总动脉近心端,再用另一个动脉夹夹闭颈内动脉远心端。
1.4.4造模操作 空白组不作手术处理, SAH模型组造模时采用经典的颅内动脉穿刺法建立SD大鼠SAH模型,将颈部血管解剖分离清晰,结扎完毕,查看大鼠呼吸平稳后,提起结扎颈外动脉的缝合线,在显微镜下,用神经外科显微剪将颈外动脉距离线结3 mm处剪一楔形口,沿楔形切口插入纤芯,使纤芯自颈外动脉楔形切口处顺利插入,沿颈内动脉走形方向向颅内快速插入纤芯,此时会有较多颈内动脉回流血液流出,插入长度20~22 mm[10],如果插入过程中纤芯畅通无阻力感,再次快速插入纤芯2~3 mm[11],当有瞬间突破感时,表明颅内动脉已经被刺破,在颈外动脉剪口的近心端结扎颈外动脉,打开颈总动脉动脉夹,完成造模时间控制在2~3 min内[12],造模手术完成后,对SD大鼠进行复苏,然后放回笼中继续饲养,注意保暖及饲养温度。评判模型成功与否的指征:取脑组织标本后,观察确定没有脑组织损伤的SAH或颅底存在血凝块,视为制作模型成功。假手术组大鼠行相同的手术步骤,只进行颅内动脉造模术但不穿破血管,即不在颈内动脉和颈外动脉的分叉进行剪孔及插芯操作,即缝合颈部切口,将造模成功后的大鼠分3批次、分别在造模后的6,24,72 h对存活模型大鼠腹主动脉取血。
1.5水迷宫试验 分别对空白组,假手术组及SAH模型组SD大鼠在术后6,24,72 h进行水迷宫试验,并记录大鼠到达平台时间、在目标象限内驻留时间数据。
1.6IL-1β、IL-6检测 将造模成功后的大鼠分3批次,分别在造模后的6,24,72 h将大鼠称重,腹腔内麻醉,麻醉成功后,暴露腹腔脏器,穿刺腹主动脉取血,将腹主动脉抽取的血样置于4 ℃冰箱冷藏待测[13],采用酶联免疫吸附测定法检测血浆中IL-1β、IL-6水平。
1.7统计学方法 应用SPSS 20.0统计软件处理数据,计量资料比较分别采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.13组水迷宫试验结果比较 SAH模型组6,24,72 h到达平台时间较空白组和假手术组明显延长(P<0.05), SAH模型组在目标象限内驻留时间的百分比明显低于空白组和假手术组(P<0.05),见表1。
表1 3组大鼠到达平台时间和目标象限内驻留时间百分比比较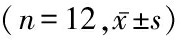
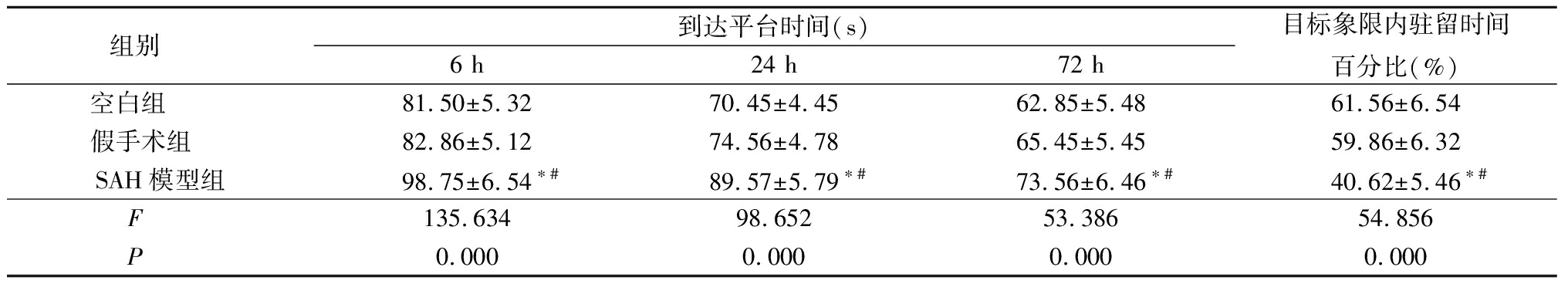
组别 到达平台时间(s)6 h24 h72 h目标象限内驻留时间百分比(%)空白组 81.50±5.3270.45±4.4562.85±5.4861.56±6.54假手术组 82.86±5.1274.56±4.7865.45±5.4559.86±6.32SAH模型组98.75±6.54∗#89.57±5.79∗#73.56±6.46∗#40.62±5.46∗#F 135.63498.65253.38654.856P 0.0000.0000.0000.000
*P<0.05与空白组比较 #P<0.05与假手术组比较(SNK-q检验)
2.23组IL-1β、IL-6水平比较 SAH模型组6,24,72 h IL-1β和IL-6水平均明显高于空白组和假手术组(P<0.05),见表2。
表2 3组大鼠血浆中IL-1β和IL-6水平比较
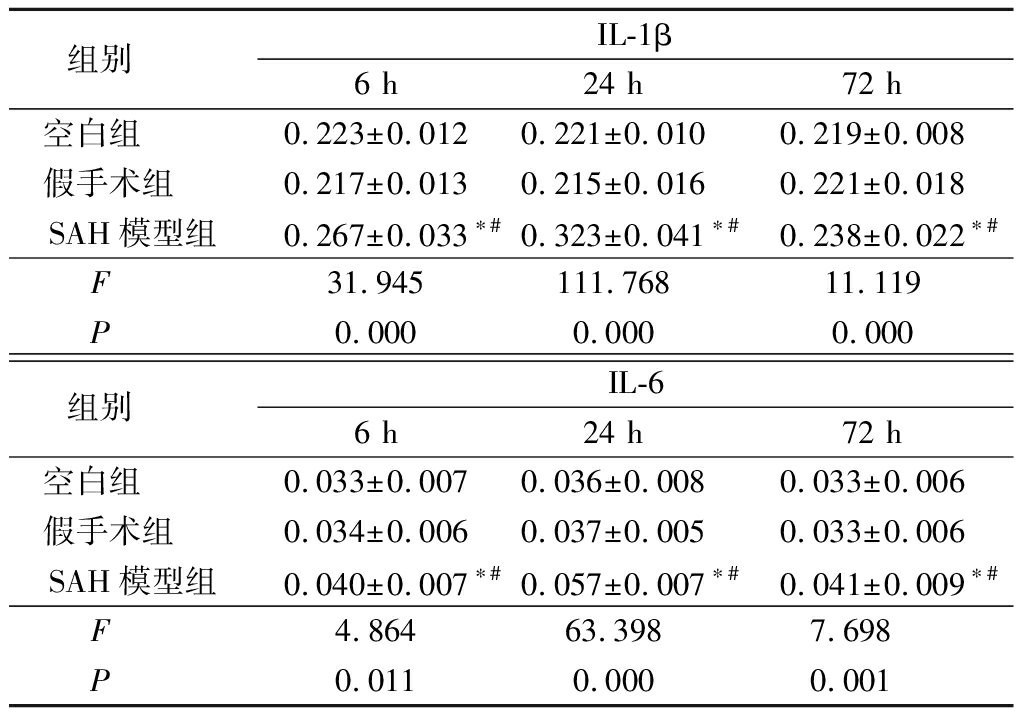
组别 IL-1β6 h24 h72 h空白组 0.223±0.0120.221±0.0100.219±0.008假手术组 0.217±0.0130.215±0.0160.221±0.018SAH模型组0.267±0.033∗#0.323±0.041∗#0.238±0.022∗#F 31.945111.76811.119P 0.0000.0000.000组别 IL-66 h24 h72 h空白组 0.033±0.0070.036±0.0080.033±0.006假手术组 0.034±0.0060.037±0.0050.033±0.006SAH模型组0.040±0.007∗#0.057±0.007∗#0.041±0.009∗#F 4.86463.3987.698P 0.0110.0000.001
*P<0.05与空白组比较 #P<0.05与假手术组比较(SNK-q检验)
3 讨 论
自发性SAH多源于颅内动脉瘤,一旦破裂对人的危害是非常大的,我国SAH的发病率近年来呈现逐年升高趋势[14-15]。有研究者发现,如果将因SAH导致死亡的所有患者包括在内,每年SAH发病率将高达32/10万[16]。大部分SAH存活者均会留下一定的神经功能损伤、认知功能缺失及精神障碍等后遗症,这给患者以后的社会生活带来无法避免的身心创伤[17],给患者家庭带来沉重的负担。寻找有效降低SAH致死率、致残率的治疗方式,成为全世界神经科学者研究SAH治疗方法的热点。
3.1SAH造模 寻找一种SAH后研究早期脑损伤的动物模型成为研究的重点,近年来大鼠作为制作SAH模型的理想动物,通常采用以下3种方法:①枕大池蛛网膜下腔注血法;②颅内动脉穿刺法;③动脉血管周围置血法。血管内穿刺法真实模拟了临床上脑动脉瘤破裂导致的SAH。本研究通过颅内血管穿刺法造模过程的观察,发现造模后大鼠同时或单一出现以下症状或体征:①大小便失禁;②突发间断性或持续肢体或全身抽搐;③口吐少量或大量泡沫样痰;④呼吸浅慢,间隔一段时间后恢复正常呼吸,少数出现呼吸骤停;⑤呼吸间断急促;⑥造模后双侧瞳孔不等大,观察一段时间后恢复等大;⑦高热、短时间一侧肢体肌力差等。在临床工作中SAH患者也会出现上述症状和体征,如引起呼吸、循环及泌尿系统的复杂改变。颅内血管内穿刺法为临床SAH后病理、临床改变及治疗研究相对完善的造模方法,但仍存在颅内出血不可控、有一定死亡发生率等情况,有统计称总的死亡发生率为35%[18]。故减少及控制造模的死亡发生率有待进一步改进完善。
3.2SAH后炎症反应 临床和实验研究证实,SAH后在脑内和蛛网膜下腔有明显的炎症反应,且SAH患者会出现全身炎症反应。诱发SAH后炎症反应的是血红蛋白,血红蛋白通过引发自由基的生成,造成炎症反应失控[19],大量神经元被溶解破坏,星形胶质细胞被激活[20]。炎症介质参与SAH后包括促炎性细胞因子IL-1β,IL-6的生成,许多SAH后患者会引起中性粒细胞升高和脑损伤的临床症状,神经炎症反应加重脑水肿的形成,造成SAH脑损伤预后不良。
研究表明,IL-1β、IL-6在炎症反应中具有显著的作用。IL-1在炎症反应的发生发展中是重要的初始调控因子,通常情况下IL-1有3种活性形式:IL-1α、IL-1β和IL-1γ。研究表明,IL-1β的表达主要参与了炎症早期的反应,同时IL-1β作为炎症反应扩大的主要启动因子,是炎症反应发生及发展的主要参与者。IL-1β表达的程度与机体组织损伤面积的大小有一定相互关联[21]。炎症因子IL-6是由T淋巴细胞、B淋巴细胞、纤维母细胞以及多种肿瘤细胞等所产生的,在原发性高血压的发生发展中起重要作用,其表达水平在脑损伤后显著增加[22],IL-6水平的高低与急性脑损伤患者脑组织的损伤轻重有关。因此,IL-6是机体组织损伤程度和炎症反应轻重的重要指标。
本研究将SD大鼠分为空白组、假手术组和SAH模型组,SAH模型组采用经典的颅内血管穿刺法制造SAH模型,分6,24,72 h对各组大鼠进行水迷宫试验,测试各组大鼠的学习、记忆能力变化,检测各组大鼠血浆中炎症因子IL-1β、IL-6的含量变化,大鼠的神经损伤程度可用水迷宫试验大鼠找到平台所需的时间及目标象限内驻留时间进行量化记录,结果显示SAH模型组大鼠在Morris水迷宫试验中表现出学习记忆能力的改变,与空白组、假手术组相比,在造模后6,24,72 h 3个时间点SAH模型组大鼠找到平台所用的时间明显延长(P<0.05),表明SAH模型组大鼠出现了严重的神经功能损伤;SAH模型组造模后目标象限内驻留时间百分比逐渐降低,表明随时间的延长大鼠的神经功能在逐步恢复,相比较在6 h时目标象限内驻留时间最长,学习及记忆等神经功能损害最明显,可能与大脑皮层和海马内神经元的数量有关,说明大鼠的学习记忆能力在SAH早期即出现明显下降。本研究结果还显示,与空白组、假手术组相比较,SAH模型组IL-1β、IL-6在各个时间点数值均明显升高(P<0.05)。
总之,炎症反应在脑损伤及损伤进展中起着至关重要的作用。通过对动脉瘤性SAH炎症反应的病理生理学研究,寻找靶向抑制炎症反应的药物,可改善SAH患者的预后。
[参考文献]
[1] Sehba FA,Hou J,Pluta RM,et al. The importance of early-brain injury after subarachnoid hemorrhage[J]. Prog Neurobiol,2012,97(1):14-37.
[2] 赵立辉,左玉强,魏晓玲.对比分析CTA与DSA在诊断自发性蛛网膜下腔出血中的价值[J].河北医科大学学报,2015,36(9):1085-1087,封三.
[3] Itoh T,Imano M,Nishida S,et al. Increased apoptotic neuronal cell death and cognitive impairment at early-phase after traumatic brain injury in aged rats[J]. Brain Struct Function,2013,218(1):209-220.
[4] 石晓勇,王中,陈罡,等.自噬在大鼠蛛网膜下腔出血后早期脑损伤中作用的实验研究[J].临床神经外科杂志,2015,12(6):449-452.
[5] Cui Y,Duan X,Li H,et al. Hydrogen Sulfide Ameliorates Early Brain Injury Following Subarachnoid Hemorrhage in Rats[J]. Molecular Neurobiology,2016,53(6):3646.
[6] Kapapa T,Woischneck D,Tjahjadi M. Long-term health-related quality of life After Spontaneous Nontraumatic Subarachnoid Hemorrhage:Self and Proxy Reports in a 10-year period[J]. World Neurosurgery,2014,81(1):105-109.
[7] Pluta RM,Bacher J,Skopets B,et al. A non-human primate model of aneurismal subarachnoid hemorrhage(SAH)[J]. Transl Stroke Res,2014,5(6):681-691.
[8] An C,Kuda T,Yazaki T,et al. Caecal environment of rats fed far East Asian-modelled diets[J]. App Microbiol Biotechnol,2014,98(10):4701-4709.
[9] 李建华,孙娟,张艳,等. 线栓长度对颈内动脉穿刺法建立大鼠蛛网膜下腔出血模型的影响[J].青海医学院学报,2014,35(3):191-195.
[10] 姜珊,修彬华,邢国祥,等.蛛网膜下腔出血引起模型大鼠感觉皮层S1区胶质细胞活化[J].细胞与分子免疫学杂志,2015,31(10):1367-1371.
[11] Hansel G,Ramos DB,Delgado CA,et al. The potential therapetic effect of guanosine after cortical focal ischemia in rats [J]. PLOS One,2014,9(2):e90693.
[12] Sehba FA.Rat endovascular perforation model[J]. Transl Stroke Res,2014,5(6):660-668.
[13] Chang CZ,Wu SC,Kwan AL. A purine antimetabolite attenuates toll-like receptor-2,-4,and subarachnoid hemorrhage-induced brain apoptosis[J]. J Surgical Res,2015,199(2):676-687.
[14] Qi JP,Wu AP,Wang DS,et al. Correlation between neuronal injury and Caspase-3 after focal ischemia in human hippocampus[J]. Chin Med J( Engl),2012,117(10):1507-1512.
[15] 赵双军,耿藏果.高压氧治疗对动脉瘤破裂蛛网膜下腔出血术后患者脑功能恢复的效果观察[J].河北医科大学学报,2014,35(6):694-696.
[16] Yan T,Chopp M,Chen J. Experimental animal models and inflammatory cellular changes in cerebral ischemic and hemorrhagic stroke[J]. Neurosci Bull,2015,31(6):717-734.
[17] Ferrante E,Regna-Gladin C,Arpino I,et al. Pseudo-subarachnoid hemorrhage:a potential imaging pitfall associated with spontaneous intracranial hypotension[J]. Clin Neurol Neurosurg,2013,115(11):2324-2328.
[18] Guvenc Tuna B,Lachkar N,de Vos J,et al. Cerebral artery remodeling in rodent models of subarachnoid hemorrhage[J]. J Vasc Res,2015,52(2):103-115.
[19] Badjatia N,Monahan A,Carpenter A,et al. Inflammation,negative nitrogen balance,and outcome after aneurysmal subarachnoid hemorrhage [J]. Neurology,2015,84(7):680-687.
[20] Chen LN,Shi Q,Zhang XM,et al. Optimization of the isolation and enrichment of S-nitrosylated proteins from brain tissues of rodents and humans with various prion diseases for iTRAQ-based proteomics [J]. Int J Mol Med,2015,35(1):125-134.
[21] 李娜,程晋成,王水平,等.脑脊液何雪晴内皮素-1,白介素-6,检测对急性颅脑损伤严重程度的评估意义[J].现代检验医学杂志,2013,28(5):77-80.
[22] 张秀丽,孙志扬.白介素-6、白介素-8在大鼠脑损伤中的研究[J].全科医学临床与教育,2013,11(3):259-261.
[中图分类号]R743.35
[文献标志码]B
[文章编号]1007-3205(2018)09-1073-04
[收稿日期]2017-12-14;
[修回日期]2017-12-26
[作者简介]高建亮 (1982-),男,河北遵化人,华北理工大学附属遵化市人民医院主治医师,医学硕士,从事脑血管疾病诊治研究。
*通讯作者。E-mail:tsfaj@sina.com
(本文编辑:许卓文)
![]()

