·论 著·
不同病原微生物重症感染患者炎症因子水平变化研究
李 宾,王 冠,牛丙寅,陈东升,甄根深,翁以炳*
(首都医科大学附属北京潞河医院重症医学科,北京 101104)
[摘要] 目的分析不同病原微生物重症感染患者炎症因子水平在感染后不同时间的变化。方法收集重症医学科有感染征象的患者95例。收集不同时间点的白细胞介素(interleukin,IL)-6、IL-8、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、血白细胞(white blood cell,WBC)、降钙素原(procalcitonin,PCT)的检测结果,以及病原学检查结果。结果病原学检查显示肺炎克雷伯杆菌感染26例,铜绿假单胞菌感染22例,鲍曼不动杆菌感染18例,嗜麦芽黄单胞菌感染7例,奇异变形杆菌感染10例,大肠埃希菌感染12例。各病原体的炎症因子水平组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。肺炎克雷伯杆菌、奇异变形杆菌和大肠埃希菌感染患者IL-6、TNF-α、PCT、C反应蛋白(C-reactive protein,CRP)、WBC均呈现上升和下降迅速的过程;铜绿假单胞菌感染患者CRP、WBC、中性粒细胞百分比(Neu%)和TNF-α、PCT升高较快(分别在入院时和入院后6 h),随后缓慢下降;IL-6、IL-8升高较慢(峰值出现在入院后48 h),随后才缓慢下降;鲍曼不动杆菌感染患者各炎症因子水平则在入院早期即明显升高,但维持较高水平的时间较长,至48 h才缓慢下降;嗜麦芽黄单胞菌感染患者IL-6、TNF-α、PCT、CRP表现类似肺炎克雷伯杆菌感染患者,WBC的峰值则出现在入院时,而IL-8的升高较慢,直到入院后24 h才达到最高值,此后缓慢下降。结论不同病原微生物感染后会产生相对特异的炎症因子水平变化趋势,据此有助于临床早期判断感染微生物的种类,从而提高抗生素选择的正确率,以及时挽救患者生命、提高社会经济效益。
[关键词]感染;病原微生物;炎症因子 doi:10.3969/j.issn.1007-3205.2018.09.020
重症医学科感染患者通常病情严重,并发多种病原微生物感染常使病情更为复杂,故抗生素的选取和使用方案较为关键[1]。目前临床常用的治疗路径多为早期经验性选用抗生素、检出敏感菌后结合临床实际调整使用方案、病情稳定后降级抗生素、直至减量和停用[2-5]。但这种方法存在的问题主要是随着社区和院内感染微生物的变迁,经验性治疗往往不能起到准确的治疗作用,且病原微生物的检出耗时较长,可能进一步影响临床治疗的效果,一些检出结果可能存在假阳性或假阴性等情况,这些因素均可能影响临床救治效果。近年来随着生物学的发展,与感染有关的生物标记物检测方法被引入临床并指导抗生素的应用[6]。不同病原微生物感染产生炎症标记物的时间和存在时限有很大不同[7-10],如细菌、真菌、病毒等感染后白细胞介素(interleukin,IL)迅速升高,2 h左右达到高峰,并依病情严重程度持续若干时间。降钙素原(procalcitonin,PCT)则在细菌感染后2 h左右升高,并在12~24 h达高峰。利用这一特点,结合血象、临床表现等指标尽可能准确地判断临床感染的病原微生物,可指导抗生素的使用,从而缩短病程、减少社会经济负担。本研究回顾我院过去2年收治的重症感染患者,对其炎症因子水平的变化特点进行分析和总结,报告如下。
1 资 料 与 方 法
1.1一般资料 收集2015年1月—2016年12月首都医科大学附属北京潞河医院重症医学科初始入院的有感染征象的患者95例。男性64例,女性31例;年龄58~88岁,平均(64±13)岁;体重指数24±6;感染原因:下呼吸道及肺部感染35例,胃肠穿孔术后17例,胸部外伤术后10例,腹部外伤术后12例,混合性外伤术后21例。
1.2纳入标准和排除标准 纳入标准:①有临床感染表现;②符合急性炎症反应综合征的标准;③下呼吸道感染者入院时已行有创机械通气。排除标准:①心脏骤停患者;②严重肝功能障碍(Child-Pugh C级以上)患者;③行血液透析或床旁肾替代治疗患者;④内分泌及代谢病患者;⑤恶性肿瘤患者。
1.3研究方法 本研究为单中心、回顾性队列研究。病案室检索符合纳入标准的病例,双人独自翻阅病历,采集相关指标的所有结果(有缺失者予以排除),录入Excel表格;合并表格后出现数据异常者由第三人复核病历原始资料纠正。
1.4观察指标 收集患者血白细胞(white blood cell,WBC)及其分类、IL-6、IL-8、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、PCT等指标。
1.5统计学方法 应用SAS 9.4统计软件处理数据,计量资料比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1病原学检查结果 病原学分布为肺炎克雷伯杆菌26例,铜绿假单胞菌22例,鲍曼不动杆菌18例,嗜麦芽黄单胞菌7例,奇异变形杆菌10例,大肠埃希杆菌12例。
2.2不同病原学感染患者炎症因子水平变化
2.2.1总体变化 肺炎克雷伯杆菌感染患者在入院初期有最高滴度的IL-6,并直至入院后48 h开始逐渐下降,72 h后降至正常水平;铜绿假单胞菌感染患者在IL-6和IL-8的滴度上呈较长时间的升高,甚至在入院后72 h仍呈明显升高;鲍曼不动杆菌感染患者在发病后的24~48 h呈现较高滴度的IL-6和IL-8;嗜麦芽黄单胞菌感染患者在血WBC升高的平均值方面有着最低的水平,无论是在入院确诊时,还是在72 h之后;奇异变形杆菌感染患者PCT的下降程度最迅速,发病后24 h即迅速下降,至72 h已基本将至正常范围;大肠埃希菌感染患者所有炎症因子指标均表现为在入院时迅速升高,24 h达高峰,以后在72h内快速回落至正常范围这一过程。这些病原体在检测的各炎症因子水平,组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表1。
2.2.2炎症因子水平峰值情况 肺炎克雷伯杆菌感染患者的IL-6、TNF-α、PCT、C反应蛋白(C-reactive protein,CRP)、WBC的峰值出现在入院后6 h,IL-8的峰值出现在入院后第一个24 h,均值为(140.75±86.32) ng/L;铜绿假单胞菌感染患者的IL-6、IL-8的峰值出现在入院后48 h,TNF-α、PCT的峰值则出现在入院后6 h,中性粒细胞百分比(Neu%)、CRP和WBC的峰值则在入院时即出现;鲍曼不动杆菌感染患者的感染标记物峰值均出现在入院后6 h;嗜麦芽黄单胞菌感染患者IL-6、TNF-α、PCT、CRP的峰值出现在入院后6 h,IL-8的峰值出现在入院后24 h,WBC的峰值则出现在入院时;奇异变形杆菌感染患者的IL-6、IL-8、TNF-α、PCT、WBC的峰值均出现在入院时,CRP的峰值出现在入院后6 h;大肠埃希菌感染患者IL-6、IL-8、TNF、PCT、CRP的峰值均出现在入院时,WBC的峰值则出现在入院后6 h。见表1。
表1 不同病原微生物感染患者不同时段IL-6、IL-8、TNF-α、PCT、CRP、WBC、Neu水平变化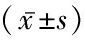
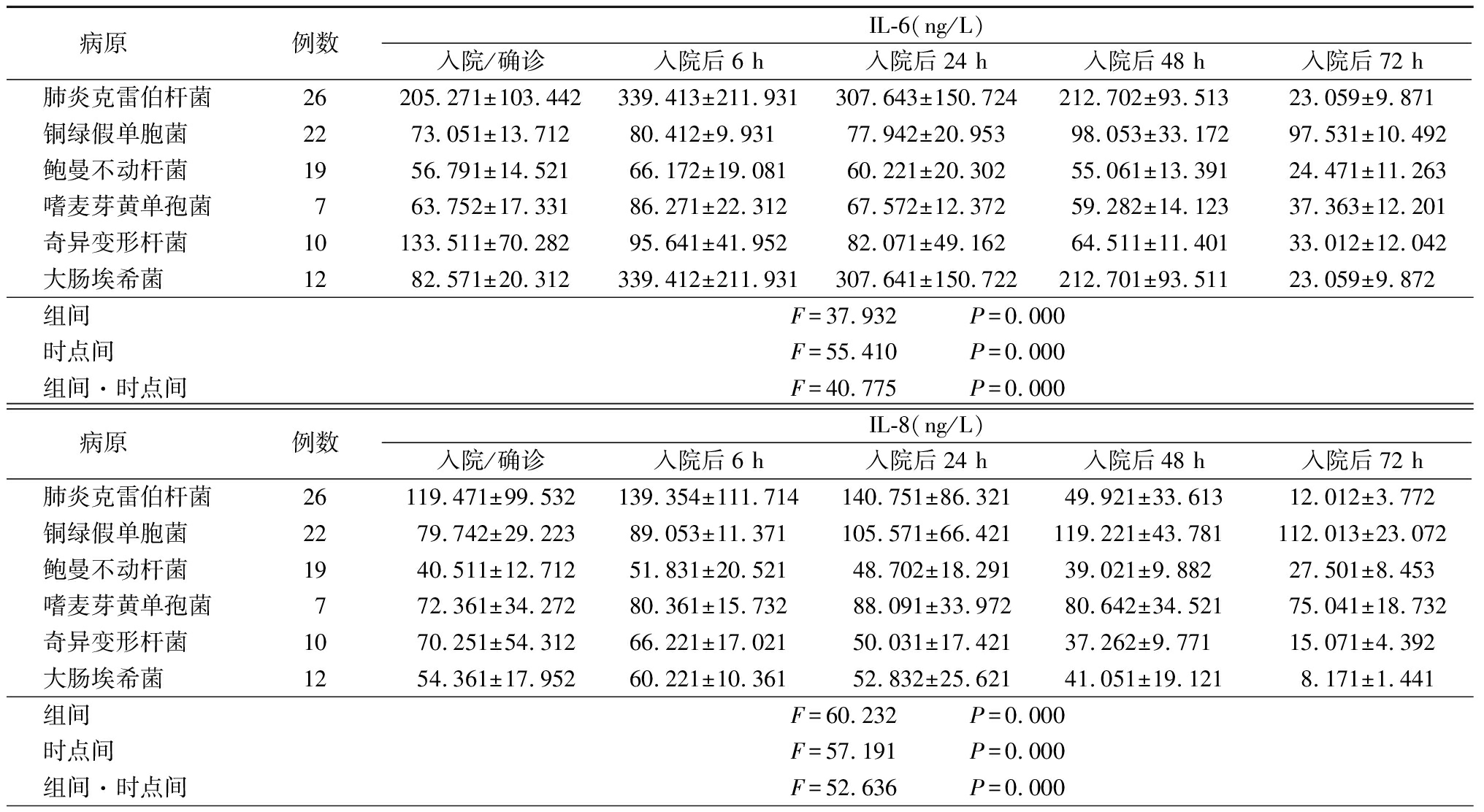
病原 例数IL-6(ng/L)入院/确诊入院后6 h入院后24 h入院后48 h入院后72 h肺炎克雷伯杆菌26205.271±103.442339.413±211.931307.643±150.724212.702±93.51323.059±9.871铜绿假单胞菌 2273.051±13.71280.412±9.93177.942±20.95398.053±33.17297.531±10.492鲍曼不动杆菌 1956.791±14.52166.172±19.08160.221±20.30255.061±13.39124.471±11.263嗜麦芽黄单孢菌763.752±17.33186.271±22.31267.572±12.37259.282±14.12337.363±12.201奇异变形杆菌 10133.511±70.28295.641±41.95282.071±49.16264.511±11.40133.012±12.042大肠埃希菌 1282.571±20.312339.412±211.931307.641±150.722212.701±93.51123.059±9.872组间 F=37.932 P=0.000时点间 F=55.410 P=0.000组间·时点间 F=40.775 P=0.000病原 例数IL-8(ng/L)入院/确诊入院后6 h入院后24 h入院后48 h入院后72 h肺炎克雷伯杆菌26119.471±99.532139.354±111.714140.751±86.32149.921±33.61312.012±3.772铜绿假单胞菌 2279.742±29.22389.053±11.371105.571±66.421119.221±43.781112.013±23.072鲍曼不动杆菌 1940.511±12.71251.831±20.52148.702±18.29139.021±9.88227.501±8.453嗜麦芽黄单孢菌772.361±34.27280.361±15.73288.091±33.97280.642±34.52175.041±18.732奇异变形杆菌 1070.251±54.31266.221±17.02150.031±17.42137.262±9.77115.071±4.392大肠埃希菌 1254.361±17.95260.221±10.36152.832±25.62141.051±19.1218.171±1.441组间 F=60.232 P=0.000时点间 F=57.191 P=0.000组间·时点间 F=52.636 P=0.000
表1(续)
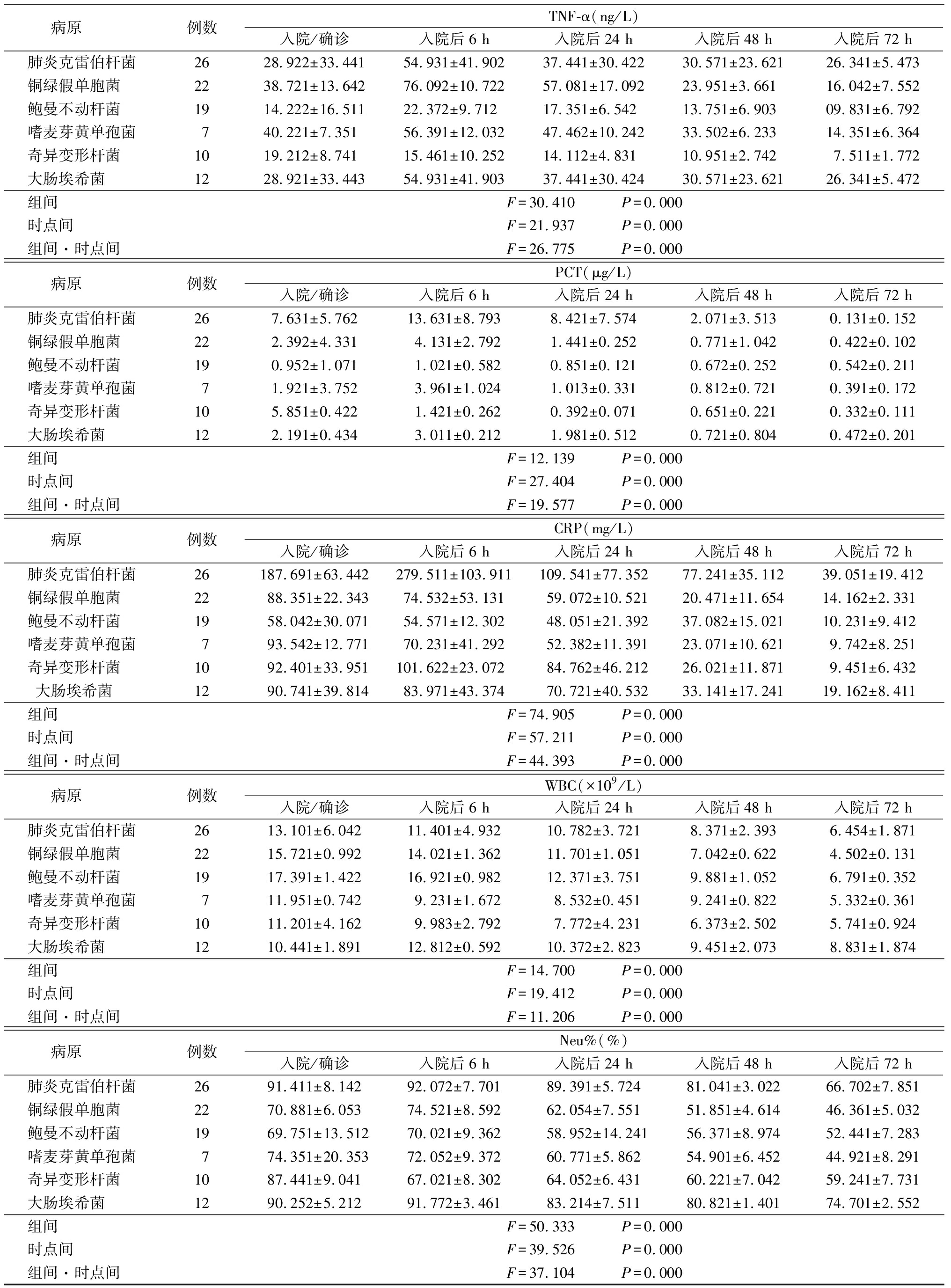
病原 例数TNF-α(ng/L)入院/确诊入院后6 h入院后24 h入院后48 h入院后72 h肺炎克雷伯杆菌2628.922±33.44154.931±41.90237.441±30.42230.571±23.62126.341±5.473铜绿假单胞菌 2238.721±13.64276.092±10.72257.081±17.09223.951±3.66116.042±7.552鲍曼不动杆菌 1914.222±16.51122.372±9.71217.351±6.54213.751±6.90309.831±6.792嗜麦芽黄单孢菌740.221±7.35156.391±12.03247.462±10.24233.502±6.23314.351±6.364奇异变形杆菌 1019.212±8.74115.461±10.25214.112±4.83110.951±2.7427.511±1.772大肠埃希菌 1228.921±33.44354.931±41.90337.441±30.42430.571±23.62126.341±5.472组间 F=30.410 P=0.000时点间 F=21.937 P=0.000组间·时点间 F=26.775 P=0.000病原 例数PCT(μg/L)入院/确诊入院后6 h入院后24 h入院后48 h入院后72 h肺炎克雷伯杆菌267.631±5.76213.631±8.7938.421±7.5742.071±3.5130.131±0.152铜绿假单胞菌 222.392±4.3314.131±2.7921.441±0.2520.771±1.0420.422±0.102鲍曼不动杆菌 190.952±1.0711.021±0.5820.851±0.1210.672±0.2520.542±0.211嗜麦芽黄单孢菌71.921±3.7523.961±1.0241.013±0.3310.812±0.7210.391±0.172奇异变形杆菌 105.851±0.4221.421±0.2620.392±0.0710.651±0.2210.332±0.111大肠埃希菌 122.191±0.4343.011±0.2121.981±0.5120.721±0.8040.472±0.201组间 F=12.139 P=0.000时点间 F=27.404 P=0.000组间·时点间 F=19.577 P=0.000病原 例数CRP(mg/L)入院/确诊入院后6 h入院后24 h入院后48 h入院后72 h肺炎克雷伯杆菌26187.691±63.442279.511±103.911109.541±77.35277.241±35.11239.051±19.412铜绿假单胞菌 2288.351±22.34374.532±53.13159.072±10.52120.471±11.65414.162±2.331鲍曼不动杆菌 1958.042±30.07154.571±12.30248.051±21.39237.082±15.02110.231±9.412嗜麦芽黄单孢菌793.542±12.77170.231±41.29252.382±11.39123.071±10.6219.742±8.251奇异变形杆菌 1092.401±33.951101.622±23.07284.762±46.21226.021±11.8719.451±6.432大肠埃希菌 1290.741±39.81483.971±43.37470.721±40.53233.141±17.24119.162±8.411组间 F=74.905 P=0.000时点间 F=57.211 P=0.000组间·时点间 F=44.393 P=0.000病原 例数WBC(×109/L)入院/确诊入院后6 h入院后24 h入院后48 h入院后72 h肺炎克雷伯杆菌2613.101±6.04211.401±4.93210.782±3.7218.371±2.3936.454±1.871铜绿假单胞菌 2215.721±0.99214.021±1.36211.701±1.0517.042±0.6224.502±0.131鲍曼不动杆菌 1917.391±1.42216.921±0.98212.371±3.7519.881±1.0526.791±0.352嗜麦芽黄单孢菌711.951±0.7429.231±1.6728.532±0.4519.241±0.8225.332±0.361奇异变形杆菌 1011.201±4.1629.983±2.7927.772±4.2316.373±2.5025.741±0.924大肠埃希菌 1210.441±1.89112.812±0.59210.372±2.8239.451±2.0738.831±1.874组间 F=14.700 P=0.000时点间 F=19.412 P=0.000组间·时点间 F=11.206 P=0.000病原 例数Neu%(%)入院/确诊入院后6 h入院后24 h入院后48 h入院后72 h肺炎克雷伯杆菌2691.411±8.14292.072±7.70189.391±5.72481.041±3.02266.702±7.851铜绿假单胞菌 2270.881±6.05374.521±8.59262.054±7.55151.851±4.61446.361±5.032鲍曼不动杆菌 1969.751±13.51270.021±9.36258.952±14.24156.371±8.97452.441±7.283嗜麦芽黄单孢菌774.351±20.35372.052±9.37260.771±5.86254.901±6.45244.921±8.291奇异变形杆菌 1087.441±9.04167.021±8.30264.052±6.43160.221±7.04259.241±7.731大肠埃希菌 1290.252±5.21291.772±3.46183.214±7.51180.821±1.40174.701±2.552组间 F=50.333 P=0.000时点间 F=39.526 P=0.000组间·时点间 F=37.104 P=0.000
3 讨 论
在重症医学科治疗的严重感染患者早期、足量、恰如其分地使用抗生素尤为关键[11-15]。临床实践中较为常用的方法为先经验性选用抗微生物药物,根据治疗效果动态调整抗微生物药物的种类和剂量,待药敏结果回报后作出必要调整。这一模式显然使治疗存在一定的滞后性,也是临床病原微生物产生耐药的一个重要原因。因此,有学者提出使用“降阶梯原则”使用抗微生物药,但这种方式也带来药物的滥用和耐药问题的进一步恶化。寻找一种较为精确、可靠的选择抗微生物治疗的临床方法是一项重要和紧迫的任务。有几种近年来逐渐用于临床的感染标记物,如PCT、IL-6、IL-8、TNF-α等。细菌感染时,肝脏的巨噬细胞和单核细胞、肺及肠道组织的淋巴细胞及内分泌细胞,在内毒素、TNF-α及IL-6等作用下合成分泌大量的PCT,导致血清PCT水平显著升高;IL-6则是固有免疫系统对损伤和感染最初反应所表达的重要细胞因子,它还可促进肝脏产生CRP等,同时也可刺激和改变骨髓细胞,产生更多的多形核白细胞。 在炎症反应中,IL-6的升高早于其他细胞因子,也早于CRP和PCT,而且持续时间长,故可用来辅助急性感染的早期诊断[6]。
本研究对不同病原微生物感染患者不同阶段的炎症因子水平变化进行了比较和分析,结果显示奇异变形杆菌和大肠埃希菌感染患者的感染标记物升高和持续的时间较为接近,但在具体数值上差异较大,大肠埃希菌感染患者6 h 时IL-6水平要远高于奇异变形杆菌感染患者,可以作为抗微生物药选择的一个依据;肺炎克雷伯杆菌感染患者炎症因子水平变化的一个突出表现是其数值维持了一个相对较长时间的高水平,在入院后72 h以后才有明显降低,即便是在病原学检查已经证实初始抗微生物药选择正确者也是如此。这说明肺炎克雷伯杆菌的毒力较强,故相关的感染学标记物水平相应升高,此点可作为临床针对性选用抗微生物药物的一个依据。
铜绿假单胞菌和鲍曼不动杆菌是重症医学科严重感染患者的常见致病菌,治疗困难,早期准确地选用针对二者感染的抗生素极为重要。本研究结果显示,铜绿假单胞菌感染患者炎症因子水平相对较高,且较长时间维持在高水平;鲍曼不动杆菌感染患者炎症因子水平相对较低,但也保持了一个较长时间的高水平数值。这可能与二者的特性有关,也反映了其需要较长时间的抗感染治疗才能有效。在重症医学科的临床工作中,当患者的一般情况改善后又突然加重,且相关感染学指标持续升高,需考虑到很可能存在铜绿假单胞菌和鲍曼不动杆菌的感染,并可据此选用相应的抗微生物治疗。
嗜麦芽黄单胞菌是一种比较独特的病原微生物,该菌对大部分抗生素耐药性较强,需使用磺胺类、喹诺酮类药物,且抗菌周期较长。本研究结果显示,嗜麦芽黄单胞菌感染患者在发病6 h,其炎症因子水平已达高峰,此后逐渐下降,72 h时基本恢复正常。该菌主要侵袭高龄和长期住院的患者,特别是行气管插管机械通气的患者更易罹患,结合这一临床特点,及时选用相应的抗生素可起到缩短疗程、改善预后的作用。
感染标记物是近年来随着分子生物学进展而发展起来的针对病原微生物感染的一些特定分子标识。本研究结果显示,不同病原微生物感染后,随着时间的推移会产生不同的感染标记物水平变化,据此有助于早期选用恰当的抗生素。本研究的局限在于样本例数较少,故还需进一步行较大样本的分析,以确定感染标记物在感染不同病原微生物后的变化范围,从而判定是何种病原微生物,以便提高抗生素选择的正确性,这有助于提高临床救治危重症患者的效率,达到及时挽救患者生命、提高社会经济效益的目的。
[参考文献]
[1] Roberts JA,Abdul-Aziz MH,Lipman J,et al. Individualised antibiotic dosing for patients who are critically ill:challenges and potential solutions[J]. Lancet Infect Dis,2014,14(6):498-509.
[2] Douglas IS. New diagnostic methods for pneumonia in the ICU[J]. Curr Opin Infect Dis,2016,29(2):197-204.
[3] Tansley G,Hall R. Pharmacokinetic considerations for drugs administered in the critically ill[J]. Br J Hosp Med (Lond),2015,76(2):89-94.
[4] Bassetti M, De Waele JJ,Eggimann P,et al. Preventive and therapeutic strategies in critically ill patients with highly resistant bacteria[J]. Intensive Care Med,2015,41(5):776-795.
[5] Wong G,Sime FB,Lipman J,et al. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients?[J]. BMC Infect Dis,2014,14:288.
[6] 中国医药教育协会感染疾病专业委员会.感染相关生物标志物临床意义解读专家共识[J].中华结核和呼吸杂志,2017,40(4):243-257.
[7] Buijs EA,Zwiers AJ,Ista E,et al. Biomarkers and clinical tools in critically ill children: are we heading toward tailored drug therapy?[J]. Biomark Med,2012,6(3):239-257.
[8] Pfortmueller CA,Meisel C,Fux M,et al. Assessment of immune organ dysfunction in critical illness: utility of innate immune response markers[J]. Intensive Care Med Exp,2017,5(1):49.
[9] Hotchkiss RS, Moldawer LL,Opal SM,et al. Sepsis and septic shock[J]. Nat Rev Dis Primers,2016,2:16045.
[10] Horhat FG,Gundogdu F,David LV,et al. Early evaluation and monitoring of critical patients with acute respiratory distress syndrome (ARDS) using specific genetic polymorphisms[J]. Biochem Genet,2017,55(3):204-211.
[11] Luyt CE,Bréchot N,Trouillet JL,et al. Antibiotic stewardship in the intensive care unit[J]. Crit Care,2014,18(5):480-489.
[12] Bretonnière C,Leone M,Milési C,et al. Strategies to reduce curative antibiotic therapy in intensive care units (adult and paediatric)[J]. Intensive Care Med,2015,41(7):1181-1196.
[13] Karam G,Chastre J,Wilcox MH,et al. Antibiotic strategies in the era of multidrug resistance[J]. Crit Care,2016,20(1):136-144.
[14] Schnabel RM,van der Velden K,Osinski A,et al. Clinical course and complications following diagnostic bronchoalveolar lavage in critically ill mechanically ventilated patients[J]. BMC Pulm Med,2015,15:107.
[15] Karacaer F,Hamed I,Özogul F,et al. The function of probiotics on the treatment of ventilator-associated pneumonia(VAP):facts and gaps[J]. J Med Microbiol,2017,66(9):1275-1285.
[中图分类号]R515
[文献标志码]B
[文章编号]1007-3205(2018)09-1077-05
[收稿日期]2017-12-12;
[修回日期]2018-05-08
[作者简介]李宾(1984-),男,北京人,首都医科大学附属北京潞河医院医师,医学学士,从事重症医学研究。
*通讯作者。E-mail:wengyibing@medmail.com.cn
(本文编辑:赵丽洁)
![]()

