·临床研究·
吕 晶1,马 珩2,李娜萍3*,严 进4
(1.湖北省武汉市长江航运总医院,武汉市脑科医院病理科,湖北 武汉 430010;2.华中科技大学同济医学院附属同济医院外科细胞室,湖北 武汉 430000;3.华中科技大学同济医学院附属同济医院病理科,湖北 武汉430000;4.湖北省武汉市普仁医院耳鼻喉科,湖北 武汉430000)
[关键词]神经内分泌瘤;肾盂;病理学,临床 doi:10.3969/j.issn.1007-3205.2018.09.024
神经内分泌肿瘤是肾脏肿瘤中最不常见的一种源于神经内分泌细胞的肿瘤,到目前为止,英文文献大概有110例报道。肾盂来源的神经内分泌肿瘤更少见,目前报道的只有4例[1]。一般很难判断肿瘤是起源于肾实质还是肾盂,这些肿瘤常被归为一类[2]。肾盂中的神经内分泌细胞增生、小神经内分泌肿瘤和神经内分泌肿瘤非常罕见且对于其临床特征认识很少。因此,对于这些罕见的肾脏神经内分泌肿瘤通常是参考WHO 2004版和WHO 2006版肺的神经内分泌肿瘤[3]进行分类。本研究报道1例偶然发现的起源于马蹄肾峡部的小神经内分泌肿瘤,其最大直径为2.5 mm,是目前报道的最小的肾原发性神经内分泌肿瘤。
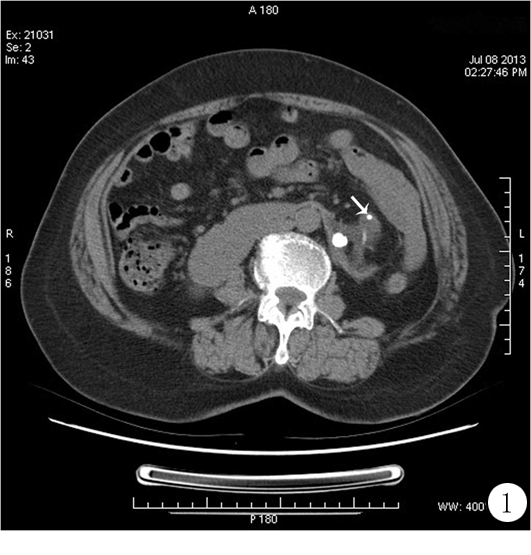
1.1一般资料 患者,女,65岁,既往左肾积水、肾结石和马蹄肾,1年前患者再次出现左下腹疼痛不适,B超发现双J管布满结石,遂来院就诊。腹部CT(图1)和X线检查均发现左侧泌尿系区双J管残影。99mTc-DTPA肾动态显像示左肾功能严重受损,右肾功能大致正常。体格检查、胸片、心电图、血常规及尿常规均未见明显异常,血生化检查示肾小球滤过率=79.3 mL·min-1·1.73 m-2(参考范围>90 mL·min·1.73 m-2)。

图1 CT扫描示马蹄肾,左侧肾结石(高密度影)及泌尿系区双J管残影(箭头所示)
1.2方法 因左肾功能严重受损行包括马蹄肾峡部的左肾切除术,术中盆腹腔未见明显肿瘤浸润。术后患者恢复良好。
1.3结果 肉眼及镜下观:肾积水(大小12 cm×6 cm×3 cm),肾盂显著扩张,皮质严重萎缩,峡部呈高度扩张的管样结构,似扩张的肾盂组织,内含暗褐色分泌物。镜下(图2A)见扩张的肾盂黏膜呈立方或柱状细胞化生,上皮下可见一个直径2.5 mm、境界清楚的微小肿瘤结节,瘤细胞呈柱状,排列成腺管状或索状结构。细胞大小、形态一致,胞界不清,胞质红染,呈细颗粒状。细胞核圆形或卵圆形,呈轻度异型性,未见明显核分裂象,未见坏死和钙化。邻近的肾实质萎缩,呈慢性肾炎-肾间质炎症。肾门淋巴结及血管未见癌转移。免疫组化染色示(图2B~D):肿瘤细胞Vim和Syn弥漫(+),CgA、CD56和NSE散在(+),P504s和WT-1均(-),Ki-67增殖指数<1%。在峡部扩张肾盂的被覆上皮中也可见散在的与肿瘤细胞免疫表型一致的神经内分泌细胞。这些细胞位于上皮基底部化生的立方或柱状细胞之间,单个散在或者小簇状聚集,而周围正常的肾实质中未见免疫反应阳性的神经内分泌细胞。病理诊断为肾原发性小神经内分泌肿瘤。术后1个月复查,未发现肿瘤的复发和转移。
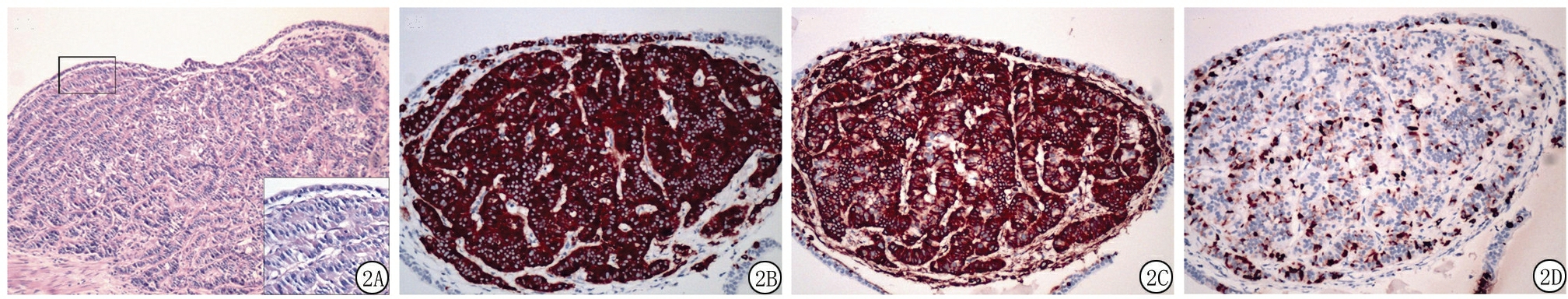
图2 微小肿瘤结节及化生的肾盂黏膜上皮中散在增生的神经内分泌细胞的HE及免疫组化染色(EnVision法)结果
A.HE染色示肾盂黏膜发生立方状或柱状细胞化生,上皮下可见一个直径2.5 mm的微小肿瘤结节,瘤结节由增生的柱状细胞构成腺管状或者索状结构(×100,右下角插入图片×200);B.肿瘤细胞及表面肾盂黏膜中增生的神经内分泌细胞均Syn染色弥漫(+)(×200);C.肿瘤细胞及表面肾盂黏膜中的增生的神经内分泌细胞均VIM染色弥漫(+)(×200);D.肿瘤细胞及表面肾盂黏膜中增生的神经内分泌细胞均CgA染色散在(+)(×200)
2.1临床表现 神经内分泌肿瘤是起源于神经内分泌细胞的肿瘤,这些细胞也被称作嗜铬细胞或者胺前体摄取与脱羧细胞[4],在体内分布广泛。在泌尿生殖系统如膀胱(尤其是膀胱三角区)、前列腺、尿道中均发现有神经内分泌细胞,但是在正常的肾实质中未见分布。神经内分泌肿瘤在胃肠道(73.7%)和呼吸道(25.1%)中最常见,而在其他部位,如卵巢、睾丸、子宫颈、胆道、乳腺均较罕见。
1966年,Resnick等[5]首次报道了原发于肾脏的神经内分泌肿瘤。到目前为止,有110篇英文文献报道,其中23例与马蹄肾相关,3例与肾畸胎瘤相关,2例与多囊性肾病相关,有1例为原发性神经内分泌肿瘤和腺癌同时起源于马蹄肾成熟性畸胎瘤的报道[6]。肾神经内分泌肿瘤的发病年龄为13~79岁(平均年龄48岁),男女发病率没有显著差异。其最常见的临床症状为腰、背、腹痛,腰、腹部肿块,腹胀,血尿,体重降低或者泌尿系感染,1例患者以睾丸疼痛为首发症状。9.2%(10/109)的患者伴有神经内分泌症状(如类癌综合征、Cushing′s综合征),24.7%(27/109)的肾神经内分泌肿瘤患者没有临床症状,只因常规体检或其他疾病偶然发现。已知肿瘤大小的71例病例报道中,55例肿块最大直径≥4 cm,16例肿块<4 cm。45.9%的患者在就诊时或者术后发生转移,最常见的转移部位为淋巴结、肝脏或者骨组织,还有1例行根治性肾切除术后5年发生乳腺转移[7]。在31例明确有肿瘤转移的病例中,87%(27/31)的患者肿块直径≥4 cm。87/109例患者有术后随访资料,随访时间为2个月至10年,其中23例患者带瘤生存,56例患者未见肿瘤复发,7例患者死于肾神经内分泌肿瘤诊断后3~28个月。起源于马蹄肾的神经内分泌肿瘤患者预后一般比较好,15例有临床随访资料的患者中,仅1例行肾部分切除术28个月后死亡[8],4例带瘤生存[9],10例未见肿瘤的复发与转移。Krishnan等[10]发现马蹄肾发生神经内分泌肿瘤的相对风险是正常肾脏的62倍,而Motta计算其相对风险率为120。针对文献报道的110例中23例与马蹄肾有关[6],加上本研究报道的1例一共是111例,其中有24例与马蹄肾有关,笔者用同样的计算方法,得出其相对风险率为87。
2.2发病机制 由于在正常的肾实质中还没有发现固有的神经内分泌细胞,肾原发性神经内分泌肿瘤的组织起源仍未明了,关于其发生机制目前已有多种假说。肾神经内分泌肿瘤可能源于化生的或畸胎瘤上皮中已存在的局灶增生的神经内分泌细胞。本病例尽管没有发现畸胎瘤的成分,但是在化生的立方或者柱状上皮中发现Syn、Vim、CgA、NSE和CD56阳性的神经内分泌细胞,这些神经内分泌细胞可能是长期肾积水、肾结石及双J管残留等刺激因素所诱发的,是肾原发性神经内分泌肿瘤的起源。此外,有多篇关于原发性肾神经内分泌肿瘤与先天性肾畸形如马蹄肾、肾畸胎瘤和多囊性肾病共存的文献报道,提示神经内分泌肿瘤的发生可能是胚胎性因素所诱发的。目前的研究发现,形成马蹄肾峡部的肾实质组织的异常融合是后肾细胞的异常迁移所导致的畸形事件。与本病例一样,几乎所有与马蹄肾相关的肾神经内分泌肿瘤均位于其峡部或者紧邻峡部的肾组织。因此,在伴随肿瘤发生的异常的呼吸型或者肠型化生上皮中散在的神经内分泌细胞可能含有致畸因素。同时,有些肾原发性神经内分泌肿瘤中还发现有3号和13号染色体数目和(或)结构的异常。通过激活与神经内分泌细胞分化相关的基因,可能会导致多潜能干细胞发展为神经内分泌肿瘤组织[11]。总之,肾原发性神经内分泌肿瘤可能起源于散在的携带先天性或者获得性异常基因的神经内分泌细胞。此外,需要更深入的研究进一步阐述源于马蹄肾的原发性神经内分泌肿瘤的发病机制。
2.3诊断与鉴别诊断 由于神经内分泌肿瘤多发生于胃肠道或者呼吸道,罕见于肾脏,故肾脏发现的神经内分泌肿瘤很可能源于其他部位隐匿性肿瘤的转移。因此,在诊断肾原发性神经内分泌肿瘤之前,需仔细而系统地检查其他部位可能存在的肿瘤。对于本例患者,术中经仔细探查腹腔,没有发现腹水、粘连或者其他非肾脏原发肿瘤转移的证据。同时,胸腔X线、CT扫描也未见肿瘤存在,从而排除转移瘤的可能。
神经内分泌细胞增生一般被认为是神经内分泌肿瘤的一种癌前病变。目前学术界将神经内分泌细胞增生、小神经内分泌肿瘤和神经内分泌肿瘤视为神经内分泌细胞增殖的3个连续阶段。肾脏原发的神经内分泌肿瘤与机体其他部位发生的神经内分泌肿瘤有类似的组织学特征和免疫表型。尽管神经内分泌细胞增生在肾脏中非常罕见,在Krishnan等[10]报道的病例中仍发现有神经内分泌细胞增生,且与本病例一样,其增生的神经内分泌细胞与神经内分泌肿瘤有相同的免疫表型。目前认为小神经内分泌肿瘤是一种最早的神经内分泌肿瘤,尽管有极少数关于非典型性小神经内分泌肿瘤和伴有淋巴结转移的小神经内分泌肿瘤的报道,但是目前仍认为它是一种良性病变。可能是由于缺乏特异的临床症状及有效的影像学证据,到目前为止还没有关于肾原发性小神经内分泌肿瘤的报道,故本病例是目前报道中起源于马蹄肾的神经内分泌肿瘤中最小的1例(最大直径2.5 mm),对于肾小神经内分泌肿瘤患者必须密切随访,防止隐匿性肿瘤的浸润进展。
关于肾神经内分泌肿瘤与其他类型肾脏肿瘤的鉴别,没有特异的影像学证据[12],肾神经内分泌肿瘤/小神经内分泌肿瘤在CT扫描中呈现非增强、低衰减、有或无坏死的肾脏包块或结节,但是这些特征均不是诊断肾神经内分泌肿瘤/小神经内分泌肿瘤所特异的。此外,CT、MRI有时也不能辅助临床医生准确地进行术后分期或者寻找肿瘤原发灶。放射性核素标记的奥曲肽肿瘤受体显像的应用是一种寻找神经内分泌肿瘤病灶的有效新途径。奥曲肽是一种生长抑素类似物,可以与生长抑素受体结合,从而可以在80%的神经内分泌肿瘤中表达。有文献报道这种新方法在诊断神经内分泌肿瘤中的敏感度可以超过85%[13],但是也有研究表明正常肾脏对示踪剂的摄取可能会掩盖可疑的病灶。因此,这些技术必须相互补充,相辅相成,尤其是对于多发性病灶、CT扫描可疑的病灶或者对于有明显的神经内分泌肿瘤的临床或者生化表现,但是CT或MRI检查阴性的患者,推荐行放射性核素标记的奥曲肽扫描。同时,需要更多病例辅助研究肾的原发性神经内分泌肿瘤的影像学特征。但是,最终的确诊必须由病理学检查加以证实。瘤细胞通常可以与Syn、CD56、CgA、NSE、Leu-7和Cytokeratin CAM5.2发生不同程度的免疫反应;此外,CD99也在大多数神经内分泌肿瘤中有表达。然而,瘤细胞通常对甲状腺转录因子1(thyroid transcription factor-1,TTF-1),P504s和WT-1失表达[13]。同时,浸润性尿路上皮癌、前列腺癌、肾细胞癌均极少表达神经内分泌细胞标记物。本病例中P504s和WT-1均阴性,从而可以排除前列腺癌转移至肾细胞癌的可能。
2.4治疗与预后 尽管原发性肾神经内分泌肿瘤患者多发生局部淋巴结甚至远处器官的转移,但是其病程相对较长,包括受累淋巴结在内的根治性手术切除是原发性肾神经内分泌肿瘤的主要治疗方法,而且对于局限性病例是可以彻底治愈的。由于有术后7年仍发生肾神经内分泌肿瘤转移的病例报道,故对于原发性肾神经内分泌肿瘤患者建议术后长期密切随访。对于转移到肝脏的肿瘤,极少可能手术治愈,但可以缓解症状。全身或者反式动脉给予化疗药物已经作为肾神经内分泌肿瘤肝转移的一种治疗策略,但尚未提出明确的治疗标准。有研究认为影响肾原发性神经内分泌肿瘤的不良预后因素包括患者年龄大于40岁、肿瘤直径大于4 cm、切面呈实体型、核分裂象>1/10HPF、有转移和肿瘤侵及肾脏包膜等。
[参考文献]
[1] Aung PP,Killian K,Poropatich CO,et al. Primary neuroendocrine tumors of the kidney[J]. Hum Pathol,2013,44(5):873-880.
[2] Kuroda N,Alvarado-Cabrero I,Sima R,et al. Renal carcinoid tumor:An immunohistochemical and molecular genetic study of four cases[J]. Oncol Lett,2010,1(1):87-90.
[3] Chiang MC,Ou YC,Yang CR,et al. Primary renal carcinoid tumor with multiple metastases[J]. J Chin Med Assoc,2010,73(8):435-437.
[4] Armah HB,Parwani AV. Primary carcinoid tumor arising within mature teratoma of the kidney:report of a rare entity and review of the literature[J]. Diagn Pathol,2007,2:15.
[5] Resnick ME,Unterberger H,Mcloughlin PT. Renal carcinoid producing the carcinoid syndrome[J]. Med Times,1966,94(8):895-896.
[6] Hasteh F,Pu R,Michael CW. A metastatic renal carcinoid tumor presenting as breast mass:a diagnostic dilemma[J]. Diagn Cytopathol,2007,5:306-310.
[7] Lane BR,Chery F,Jour G,et al. Renal neuroendocrine tumours:a clinicopathological study[J]. BJU Int,2007,100(5):1030-1035.
[8] Rodriguez-Covarrubias F,Gomez X,Valerio JC,et al. Carcinoid tumor arising in a horseshoe kidney[J]. Int Urol Nephrol,2007,39(2):373-376.
[9] Mazzucchelli R,Morichetti D,Lopez-Beltran A,et al. Neuroendocrine tumours of the urinary system and male genital organs:clinical significance[J]. BJU Int,2009,103(11):1464-1470.
[10] Krishnan B,Truong LD,Saleh G,et al. Horseshoe kidney is associated with an increased relative risk of primary renal carcinoid tumor[J]. J Urol,1997,157(6):2059-2066.
[11] Koo CW,Baliff JP,Torigian DA,et al. Spectrum of pulmonary neuroendocrine cell proliferation:diffuse idiopathic pulmonary neuroendocrine cell hyperplasia,tumorlet,and carcinoids[J]. AJR Am J Roentgenol,2010,195(3):661-668.
[12] Kuroda N,Tanaka A,Ohe C,et al. Review of renal carcinoid tumor with focus on clinical and pathobiological aspects[J]. Histol Histopathol,2013,28(1):15-21.
[13] Mccaffrey JA,Reuter VV,Herr HW,et al. Carcinoid tumor of the kidney. The use of somatostatin receptor scintigraphy in diagnosis and management[J]. Urol Oncol,2000,5(3):108-111.
[中图分类号]R737.11
[文献标志码]B
[文章编号]1007-3205(2018)09-1088-04
[收稿日期]2017-08-30;
[修回日期]2017-09-20
[作者简介]吕晶(1980-),女,湖北武汉人,湖北省武汉市长江航运总医院主治医师,医学硕士,从事临床病理学诊断研究。
*通讯作者。E-mail: linaping2008@163.com
(本文编辑:刘斯静)