· 指南解读 ·
2017版《美国内分泌学会临床实践指南
——儿童肥胖的评估、治疗和预防》解读
皮亚雷,张亚男,张会丰 *
(河北医科大学第二医院儿科,河北 石家庄 050000)
[ 关键词 ] 肥胖症;儿童;评估;治疗;预防;指南;解读
截至到2015年,世界上有超过1亿儿童和6亿成人存在肥胖。自1980年以来,70多个国家肥胖患病率增加了1倍,其他多数国家的患病率也在持续上升。1990年开始,与高体重指数(body mass index,BMI)相关的疾病负担开始增加 [1] 。1985—2014年中国7~18岁学生超重、肥胖的检出率亦持续增长,至2014年超重及肥胖总检出率高达19.4% [2] 。儿童肥胖既是一种独立的慢性代谢性疾病,也是儿童高血压、高血脂、2型糖尿病、脂肪肝、代谢综合征等慢性疾病的重要危险因素 [3] ,且增加成年期慢性疾病的患病风险 [4] 。超重及肥胖快速增长,已经成为影响我国儿童青少年身心健康的重要问题 [5-7] 。目前尚没有针对我国儿童肥胖防治的相关共识及指南。美国临床内分泌代谢杂志于2017年更新了儿童肥胖评估、治疗及预防临床实践指南 [8] ,现对其进行解读,以期对我国儿童青少年肥胖防治起到有效指导作用。
参与指南制定者包括由内分泌学会任命的6名专家组成的工作组、1名方法专家及1名医学作家。工作组采用建议评估、发展和评价的评级(Grading of Recommendations Assessment,Development and Evaluation,GRADE)系统进行证据质量和推荐强度的评估,采用一致的语言和图形描述证据质量和推荐强度。就推荐的强度而言,强有力的推荐使用“推荐”和数字“1”,弱的推荐使用“建议”和数字“2”。十字圆圈表明证据的质量,如⊕○○○表示非常低质量,⊕⊕○○表示低质量,⊕⊕⊕○表示中等质量,⊕⊕⊕⊕表示高质量。
1 超重与肥胖的诊断
1 . 1 肥胖的诊断方法 肥胖定义为身体脂肪或脂肪组织过多。判定脂肪过多的方法包括水下称重法、空气位移体积描记法、双能X线吸收测量法、CT及MRI成像测量、生物电阻抗分析法、皮褶厚度测量法、腰围、腰臀比等 [9] 。其中水下称重法为肥胖判定的金标准,但测定费时,需要特定的设备,且不适合儿童等特殊人群,仅限于研究应用。其他上述方法或者测量过程繁琐,或者价格昂贵,或者存在X射线暴露、可重复性差、精确度差等劣势,不适于大规模人群筛查和临床应用。
1 . 2 肥胖的诊断仍推荐使用BMI 指南推荐使用BMI 和美国疾病预防控制中心标准的BMI百分位数诊断年龄≥2岁的儿童青少年超重和肥胖(1|⊕⊕⊕○)。对于年龄≥2岁的儿童青少年,推荐将85≤BMI<95百分位数(同年龄同性别)作为超重的诊断标准,将BMI≥95百分位数(同年龄同性别)作为肥胖的诊断标准;将BMI≥95百分位数(同年龄同性别)的120%或BMI≥35作为极度肥胖的诊断标准(1|⊕⊕○○)。指南建议,对于年龄<2岁的儿童,将≥同性别同身长世界卫生组织图表第97.7百分位数作为诊断儿童肥胖的标准(2|⊕○○○)。
1 . 3 BMI更便于筛查的操作 BMI是目前临床应用最广泛的超重及肥胖诊断指标。但BMI不能区分肌肉和脂肪,因此不能区分多余的脂肪组织和肌肉增加所造成的儿童和青少年超重或肥胖,是反映体重超标而非脂肪组织超标的指标;当BMI和高度保持不变的情况下,不同的种族(民族)成人组之间的区域质量和身体成分均有差异;且在不同年龄、性别和种族(民族)相同的组别中,身体成分亦有明显差异 [10] 。尽管BMI受上述年龄、性别、种族(民族)等多种因素影响,但儿童和青少年的BMI与用更直接的方法测量的体脂百分位数有相当好的相关性,与其他测量参考标准方法相比,BMI测量身体肥胖,特异度为0.93,灵敏度为0.73 [11] ,且计算方法简单,易获得,适合临床及较大人群筛查应用。因此,工作组高度重视BMI的方便性以及医生和患者对这一测量方法的熟悉程度,尽管它并不是一个反映超重或肥胖的可靠指标,但仍认为BMI是目前评估超重和肥胖、指导健康管理和确定是否需要转诊给专科医生的最合理的衡量标准,仍然推荐基于BMI的超重和肥胖诊断标准。
限于BMI的民族和种族差异,中国肥胖问题工作组2004年发表了《中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准》,通过调查24万余中国汉族7~18岁学龄儿童青少年,建立了我国儿童青少年自身BMI数据。尽管工作组强调文中数据为超重和肥胖筛查标准,而非临床诊断标准,但我国儿童肥胖临床工作者,多数采用此标准作为临床诊断标准。
1 . 4 指南不推荐评估儿童或青少年肥胖时测量胰岛素浓度 内分泌疾病导致的肥胖为儿童及青少年肥胖的罕见病因,且除肥胖外,常常伴有其他症状,如生长减速或停滞,因此工作组反对对肥胖儿童常规进行内分泌病因实验室评估,除非患儿的身材(或)身高增长速度减低(1|⊕⊕⊕○)。由于肥胖与众多慢性疾病的相关性,指南推荐对BMI≥85百分位数的儿童评估潜在并发症的风险(1|⊕⊕⊕○),因为存在胰岛素抵抗和胰岛素敏感的儿童青少年之间空腹胰岛素有很大重叠,且目前尚没有被广泛接受的有临床应用价值的切值用于诊断胰岛素抵抗,指南不推荐在评估儿童或青少年肥胖时测量胰岛素浓度(1|⊕⊕⊕○)。具体并发症及评估标准见表1。
表1 肥胖伴有不同并发症的评估标准
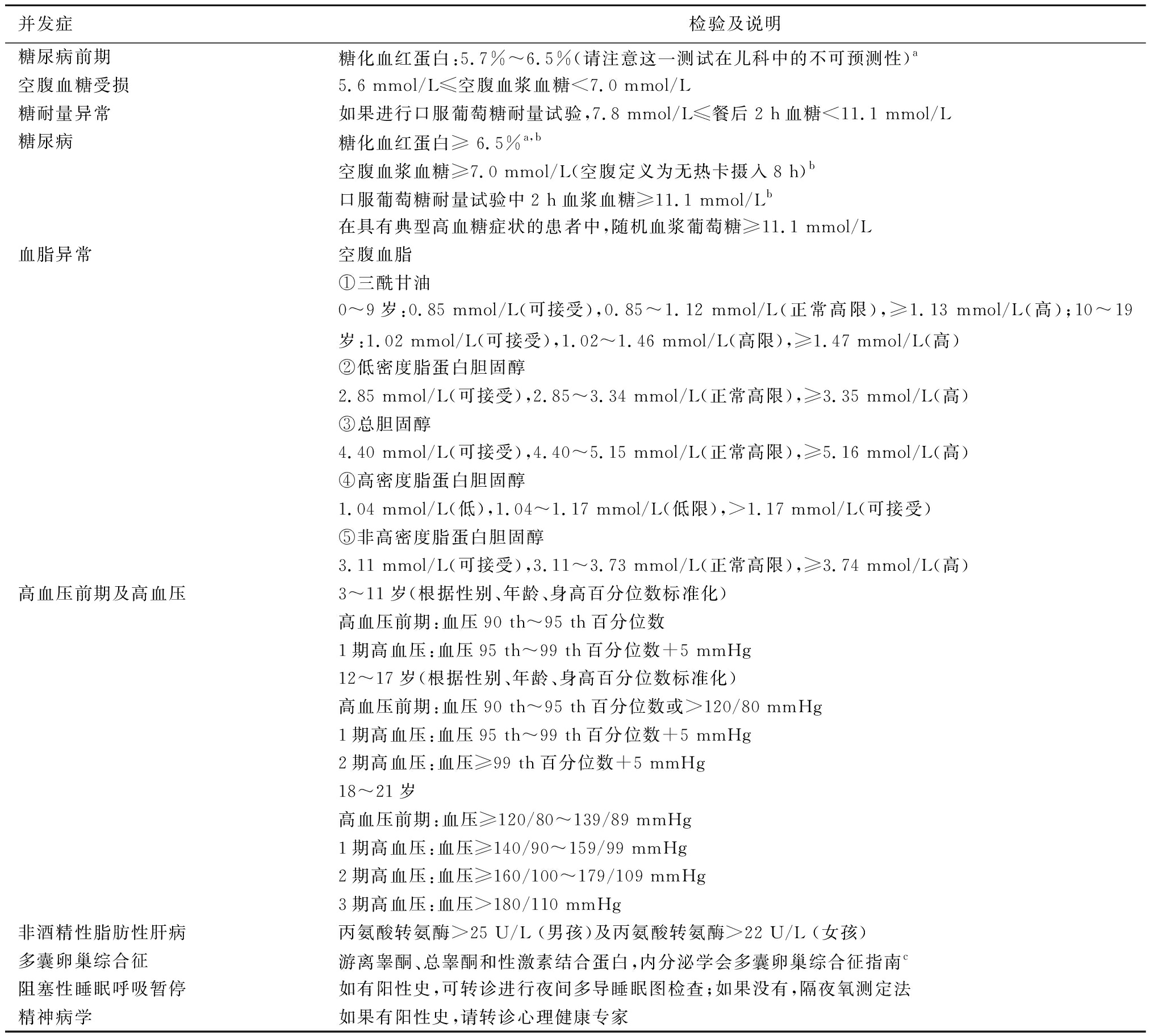
并发症检验及说明糖尿病前期糖化血红蛋白:5.7%~6.5%(请注意这一测试在儿科中的不可预测性)a空腹血糖受损5.6 mmol/L≤空腹血浆血糖<7.0 mmol/L糖耐量异常如果进行口服葡萄糖耐量试验,7.8 mmol/L≤餐后2 h血糖<11.1 mmol/L 糖尿病糖化血红蛋白≥ 6.5%a,b空腹血浆血糖≥7.0 mmol/L(空腹定义为无热卡摄入8 h)b口服葡萄糖耐量试验中2 h血浆血糖≥11.1 mmol/Lb在具有典型高血糖症状的患者中,随机血浆葡萄糖≥11.1 mmol/L血脂异常空腹血脂①三酰甘油0~9岁:0.85 mmol/L(可接受),0.85~1.12 mmol/L(正常高限),≥1.13 mmol/L(高);10~19岁:1.02 mmol/L(可接受),1.02~1.46 mmol/L(高限),≥1.47 mmol/L(高)②低密度脂蛋白胆固醇2.85 mmol/L(可接受),2.85~3.34 mmol/L(正常高限),≥3.35 mmol/L(高)③总胆固醇4.40 mmol/L(可接受),4.40~5.15 mmol/L(正常高限),≥5.16 mmol/L(高)④高密度脂蛋白胆固醇1.04 mmol/L(低),1.04~1.17 mmol/L(低限),>1.17 mmol/L(可接受)⑤非高密度脂蛋白胆固醇3.11 mmol/L(可接受),3.11~3.73 mmol/L(正常高限),≥3.74 mmol/L(高)高血压前期及高血压3~11岁(根据性别、年龄、身高百分位数标准化)高血压前期:血压90 th~95 th百分位数1期高血压:血压95 th~99 th百分位数+5 mmHg12~17岁(根据性别、年龄、身高百分位数标准化)高血压前期:血压90 th~95 th百分位数或>120/80 mmHg1期高血压:血压95 th~99 th百分位数+5 mmHg2期高血压:血压≥99 th百分位数+5 mmHg18~21岁高血压前期:血压≥120/80~139/89 mmHg1期高血压:血压≥140/90~159/99 mmHg2期高血压:血压≥160/100~179/109 mmHg3期高血压:血压>180/110 mmHg非酒精性脂肪性肝病丙氨酸转氨酶>25 U/L (男孩)及丙氨酸转氨酶>22 U/L (女孩)多囊卵巢综合征游离睾酮、总睾酮和性激素结合蛋白,内分泌学会多囊卵巢综合征指南c阻塞性睡眠呼吸暂停如有阳性史,可转诊进行夜间多导睡眠图检查;如果没有,隔夜氧测定法精神病学如果有阳性史,请转诊心理健康专家
注:a.试验应在NGSP认证的实验室进行,并用DCCT检测标准化,我国目前未将糖化血红蛋白作为糖尿病的诊断和筛查标准;b.在无明确高血糖的情况下,应通过反复试验确认;c.考虑到睾酮水平的变异性和检测标准欠佳,很难确定诊断多囊卵巢综合征或其他高雄激素症的绝对水平(推荐熟悉当地的监测方法),首选的测定方法是高压液相色谱串联质谱法
2 遗传性肥胖综合征
大约7%的儿童极端肥胖可能由罕见的染色体异常和(或)高渗透突变导致,随着新的基因检测方法出现,这个比例可能会增加。工作组建议对发生极早的肥胖(5岁以前)和具有遗传性肥胖综合征临床特征(尤其是食欲极度旺盛),和(或)有极度肥胖家族史的患儿进行基因检测(2|⊕⊕○○),以对患者进行更恰当的管理,并为患者家庭提供遗传咨询。临床医生应考虑的潜在病因和遗传情况见表2。
表2 伴或不伴发育延迟的遗传性肥胖综合征

临床特征肥胖伴发育延迟 显性遗传型 Prader-Willi综合征:肌张力低、婴儿期存活困难、体重增加、身材矮小(由于生长激素缺乏)、食欲过盛、低促性腺激素性性腺功能减退、睡眠障碍、强迫性行为 Albright遗传性骨营养不良:部分患者身材矮小、骨骼缺陷、嗅觉障碍、母系遗传时激素抵抗(如甲状旁腺激素) SIM1缺陷:食欲旺盛伴自主神经功能障碍(以低收缩压为特征)、语言发育延迟、神经行为异常包括自闭症型行为 BDNF/TrkB缺陷:过度活跃、注意力不集中、注意广度受限、短期记忆和痛觉受损 隐性遗传型 Bardet-Biedl 综合征:手足畸形(合指/短指/多指)、视网膜营养不良或色素性视网膜病变、性腺功能减退、肾脏异常/损害 TUB缺陷:视网膜营养不良、耳聋肥胖不伴发育延迟 显性遗传型 Alström综合征:视网膜营养不良、胰岛素抵抗、耳聋、扩张型心肌病、进行性肺肝肾功能不全 MC4R缺陷:食欲过盛、线性生长加速、不成比例的高胰岛素血症、低/正常血压 SH2B1缺陷:食欲过盛、不成比例的高胰岛素血症、早期语言延迟(通常能缓解)、包括攻击性在内的行为问题 KSR2缺陷:轻度食欲过盛、基础代谢率降低、胰岛素抵抗常伴黑棘皮病、月经不规则、早发2型糖尿病 隐性遗传型 瘦素缺乏:极度食欲过盛、反复感染、低促性腺激素性性腺功能减退、轻度甲状腺功能低下 瘦素受体缺陷:极度食欲过盛、反复感染、低促性腺激素性性腺功能减退、轻度甲状腺功能低下 POMC缺陷:食欲过盛、ACTH缺乏引起的胆汁淤积性黄疸或肾上腺危象、皮肤苍白、白发发红 PCSK1缺陷:小肠疾病、低血糖、甲状腺功能减退、ACTH缺乏、尿崩症
注:脑源性神经营养因子(brain-derived neurotrophic factor,BDNF);酪氨酸受体激酶B(tyrosine receptor kinase B,TrkB); 黑皮质素4受体(melanocortin 4 receptor,MC4R); SH2B衔接因子蛋白1(SH2B adaptor protein 1,SH2B1);Ras2激酶抑制剂(kinase suppressor of ras 2,KSR2);促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH);前阿片皮质激素(proopiomelanocortin,POMC); 前蛋白转化酶枯草杆菌蛋白酶1(proprotein convertase subtilisin/kexintype 1,PCSK1)。
3 肥胖的预防
肥胖发生的环境因素包括社会、家庭、饮食、运动、睡眠、心理压力等多个方面,因此儿童肥胖预防计划应是以学校为基础、有社区(2|⊕⊕○○)和整个家庭(2|⊕○○○)参与的整体计划, 应用综合性的行为改变干预,使尽可能多的人成为受众(1|⊕⊕○○)。指南建议临床医生应促进并参与到对儿童青少年、父母和社区持续健康饮食活动的教育中来,鼓励学校对健康饮食提供足够的教育(2|⊕○○○);推荐临床医生开具健康饮食处方和支持健康饮食习惯。因摄入低营养、高能量密度、高脂肪食物是肥胖的危险因素,果汁较水果含有更高的能量,且饱腹感差,应避免输入高能量-低营养价值的食物(如含糖饮料、运动饮料、水果饮料、添加蔗糖的快餐、高果糖玉米糖浆、高脂肪或高钠加工食品及高热量零食),鼓励全水果饮食而不提倡果汁 [12] (1|⊕⊕○○);建议每周内最少进行5 d的剧烈运动,每次最少20 min,60 min为宜(1|⊕⊕○○);因热量摄入和代谢改变均与睡眠紊乱有关,建议培养儿童青少年健康的睡眠模式以减少其发展为肥胖的可能性(2|⊕⊕○○);由于零食和含糖饮料摄入增加与面对电子屏幕时间增加有关 [13] ,推荐平衡儿童青少年不可避免的面对电子屏幕的时间和体力活动的时间(1|⊕⊕○○);建议临床医生评估家庭功能并作出合适的转诊,以解决家庭压力并减轻肥胖的发展(2|⊕⊕○○);因为支持母乳喂养与肥胖之间关系的证据是不一致的(1|⊕○○○),指南基于母乳喂养众多的健康益处,仅仅建议母乳喂养以预防肥胖。
4 肥胖的治疗
4 . 1 生活方式干预 儿童肥胖最重要的环境因素是热量摄入超过热量消耗。 因此,包括饮食调整和增加体育运动在内的生活方式干预是儿童体重管理的基石 [14] 。药物和手术等其他治疗均建立在生活方式干预基础之上。指南推荐临床医生开具处方并支持强化的、适合年龄和文化特点的、以家庭为中心的生活方式改变(包括饮食、体育运动、行为),以促进BMI降低(1|⊕⊕⊕○)。一项随机试验Meta分析显示,联合生活方式干预(饮食和运动)在以家庭参与为目标时,对肥胖产生中度但意义显著的影响,而当父母未参与进来时,对肥胖的影响并不显著。表明在提供综合生活方式干预时,应该让家庭参与进来。
具体在饮食方面,应减少快餐、添加蔗糖食物的摄入,并杜绝含糖饮料;减少高果糖玉米糖浆摄入,增加高果糖玉米糖浆食物标志;减少高脂肪、高钠盐或加工食物的摄入;用水果代替水果饮料;2岁以上儿童青少年减少饱和脂肪饮食摄入;推荐膳食纤维、水果和蔬菜饮食;适时、规律饮食,避免每天持续饮食摄入,尤其是放学后或晚饭后;识别儿童青少年环境中引起进食的因素,如无聊、压力、孤独,或面对电子屏幕;鼓励单包装和改进食品标签,方便消费者使用(未分级的好的实践声明)。
在运动方面,指南推荐临床医生应当开具处方并支持减少静止的时间,每天至少有20 min的中度至剧烈的体育活动,目标是60 min,并且建立在控制饮食热量的基础上(1⊕⊕○○|)。中度及剧烈程度体育运动为能引起呼吸和心率增快的运动,包括快走、跳舞、游泳、平地骑自行车等。中等强度运动时能说话,但不能唱歌;剧烈运动时不能唱歌,且说话困难。这些概念可以帮助父母及患儿更好理解和区分中度及剧烈运动强度,可操作性强。
指南建议的其他生活方式改变尚包括限制非学习必需的面对屏幕时间为每天1~2 h,减少久坐行为(2|⊕○○○);医生应识别与饮食和活动相关的不良喂养方式,并对家庭成员进行健康饮食和锻炼习惯教育(2|⊕○○○),应调查和诊断不健康的家庭内部沟通方式,并支持提高儿童青少年自尊的教养方式(2|⊕○○○)。
4 . 2 药物治疗 指南建议,对于儿童和青少年肥胖,只有正规的强化生活方式干预方案未能限制体重增加或改善并发症时,才使用药物治疗(2|⊕○○○)。除了临床试验,不推荐年龄<16岁超重但不肥胖的儿童和青少年使用药物治疗(1|⊕○○○)。食品药品管理局批准的治疗肥胖药物只可与最强烈的生活方式改变联合使用,且只有有丰富抗肥胖药物使用经验、了解其潜在副作用的医生才可使用(2|⊕○○○)。如果患者经12周最大治疗量抗肥胖药物治疗之后,BMI/BMI z值减少未超过4%,临床医生应当中止药物治疗并重新评估患者(2|⊕○○○)。当怀疑心理问题时,医疗团队应评估心理合并症,开具评估及咨询处方(2|⊕○○○)。
治疗肥胖的药物包括中枢性食欲抑制剂、影响营养吸收制剂、影响内环境/代谢控制剂。美国食品药品监督管理局已批准治疗儿童肥胖的药物非常有限,只有奥利司他被批准用于治疗年龄≥12岁青少年肥胖症。奥利司他为特异性胃肠道脂肪酶抑制剂,通过阻断人体对食物中脂肪的吸收,减少热卡摄入。其常见不良反应包括油性斑点、排气、便急、脂肪/油性大便、大便增加、大便失禁等,慢性吸收不良综合征和胆汁淤积症者禁用。因其降低脂溶性维生素吸收,强烈建议服用奥利司他者补充多种维生素。二甲双胍被批准用于治疗年龄≥10岁2型糖尿病患儿,未被批准用于肥胖。生长激素被批准用于Prader-Willi综合征患者增加身高,而非用于其肥胖治疗。未经批准的药物用于年龄<16岁的儿童和青少年肥胖治疗时,应仅限于大型的、有良好对照的研究。
4 . 3 手术治疗 指南建议只有在以下条件时才使用外科手术(2|⊕○○○):①患者青春发育已经达到Tanner 4/5期,身高已经达到或接近成人身高,且BMI>40伴轻度并发症(高血压、血脂异常、中度骨科并发症、轻度睡眠呼吸暂停、非酒精性脂肪性肝炎、继发于肥胖的重度心理困扰)或BMI>35伴显著的并发症(2型糖尿病、中重度睡眠呼吸暂停、假性脑瘤、骨科并发症、非酒精性脂肪性肝炎伴晚期纤维化);②尽管经过正规方案改变生活方式,使用或未使用药物治疗,极度肥胖和并发症持续存在;③心理评估确认家庭单元的稳定性和能力(可能存在肥胖致生活质量受损而造成的心理压力,但患者并没有潜在的未经治疗的精神疾病);④患者有坚持健康饮食和活动习惯的能力;⑤应在能提供必要护理基础设施的儿童减肥手术中心,由经验丰富的外科医生来进行手术,中心还应包括一个能够长期随访患者及其家庭代谢和心理社会需求的团队。
指南反对对以下人群进行手术治疗:处于青春期前的儿童;孕妇或哺乳期的女性青年(以及计划在术后2年内怀孕的女性青年);未养成健康饮食和运动习惯的患者;有未解决的物质滥用、饮食失调、未经治疗的精神障碍问题的患者(2|⊕○○○)。
目前应用较多的术式为胃旁路术和垂直袖状胃切除术。除了解剖上的改变,减重手术可显著改善机体代谢状况 [15-18] ,包括逆转2型糖尿病、改善非糖尿病患者血糖稳态、增加胰岛素分泌及敏感性、缓解睡眠呼吸暂停、改善非酒精性脂肪性肝炎及严重关节病变、改善心血管事件危险因素、减轻心脏后负荷改善心脏功能等。术后30 d内主要的手术并发症为胃肠道漏、自杀观念、肺栓塞,发生率约0.4%,最常见的并发症为腹痛、腹泻、恶心及脱水。远期并发症的发生率约10%~15%,包括切口疝、胆石症、小肠梗阻、吻合口狭窄、蛋白质能量营养不良、维生素及矿物质缺乏、体重反弹等。
相较于2008年的指南,本次指南参考了大量新的肥胖相关研究文献,在遗传性肥胖综合征方面的数据更新最为显著,并更新了肥胖流行病学数据,提供了应用实验室数据进行肥胖并发症诊断和管理的指导,尤其强调了避免对大部分患儿进行内分泌病因及胰岛素水平筛查。在肥胖预防方面,新的研究仍支持生活方式改变是最重要的预防方式,但弱化了母乳喂养在肥胖预防中的作用。治疗上,生活方式改变是所有治疗的基石,青少年儿童可用的药物十分有限,减重手术相关研究数据越来越多,可显著改善患儿代谢指标,但应严格掌握适应证,并有完善的治疗随访团队。
[参考文献]
[1] GBD 2015 Obesity Collaborators,Afshin A,Forouzanfar MH,et al. Health Effects of Overweight and Obesity in 195 Countries over 25 Years[J]. N Engl J Med,2017,377(1):13-27.
[2] 王烁,董彦会,王政和,等.1985-2014年中国7~18岁学生超重与肥胖流行趋势[J].中华预防医学杂志,2017,51(4):300-305.
[3] Skinner AC,Perrin EM,Moss LA,et al. Cardiometabolic risks and severity of obesity in children and young adults[J]. N Engl J Med,2015,373(14):1307-1317.
[4] 何宇纳,赵文华,赵丽云,等.2010-2012年中国10~17岁儿童青少年代谢综合征流行情况[J].中华预防医学杂志,2017,51(6):513-518.
[5] 马军.儿童代谢综合征研究进展[J].中国儿童保健杂志,2013,21(5):452-455.
[6] 马军.我国儿童青少年面临的主要健康问题及应对策略[J].北京大学学报:医学版,2013,45(3):337-342.
[7] Song Y,Ma J,Wang HJ,et al. Secular trends of obesity prevalence in Chinese children from 1985 to 2010:Urban-rural disparity[J]. Obesity (Silver Spring),2015,23(2):448-453.
[8] Styne DM,Arslanian SA,Connor EL,et al. Pediatric obesity-assessment,treatment,and prevention:an endocrine society clinical practice guideline[J]. J Clin Endocrinol Metab,2017,102(3):709-757.
[9] Sweeting HN. Measurement and definitions of obesity in childhood and adolescence:a field guide for the uninitiated[J]. Nutr J,2007,6:32.
[10] Heymsfield SB,Peterson CM,Thomas DM,et al. Why are there race/ethnic differences in adult body mass index-adiposity relationships? A quantitative critical review[J]. Obes Rev,2016,17(3):262-275.
[11] Javed A,Jumean M,Murad MH,et al. Diagnostic performance of body mass index to identify obesity as defined by body adiposity in children and adolescents:a systematic review and meta-analysis[J]. Pediatr Obes,2015,10(3):234-244.
[12] Shefferly A,Scharf RJ,DeBoer MD. Longitudinal evaluation of 100% fruit juice consumption on BMI status in 2-5-year-old children[J]. Pediatr Obes,2016,11(3):221-227.
[13] Olafsdottir S,Berg C,Eiben G,et al. Young children's screen activities,sweet drink consumption and anthropometry:results from a prospective European study[J]. Eur J Clin Nutr,2014,68(2):223-228.
[14] Kumar S,Kelly AS. Review of Childhood obesity:from epidemiology,etiology,and comorbidities to clinical assessment and treatment[J]. Mayo Clinic Proc,2017,92(2):251-265.
[15] Ram  n JM,Salvans S,Crous X,et al. Effect of Roux-en-Y gastric bypass vs sleeve gastrectomy on glucose and gut hormones:a prospective randomised trial[J]. J Gastrointestl Surg,2012,16(6):1116-1122.
n JM,Salvans S,Crous X,et al. Effect of Roux-en-Y gastric bypass vs sleeve gastrectomy on glucose and gut hormones:a prospective randomised trial[J]. J Gastrointestl Surg,2012,16(6):1116-1122.
[16] Hafeez S,Ahmed MH. Bariatric surgery as potential treatment for nonalcoholic fatty liver disease:a future treatment by choice or by chance?[J]. J Obes,2013,2013:839275.
[17] Inge TH,Prigeon RL,Elder DA,et al. Insulin sensitivity and β--cell function improve after gastric bypass in severely obese adolescents[J]. J Pediatr,2015,167(5):1042-1048.
[18] Michalsky MP,Inge TH,Simmons M,et al. Cardiovascular risk factors in severely obese adolescents:The Teen Longitudinal Assessment of Bariatric Surgery (Teen-LABS) Study[J]. JAMA Pediatr,2015,169(5):438-444.
*通讯作者 。E-mail:13333015983@163.com
[作者简介] 皮亚雷(1982-),女,河北行唐人,河北医科大学第二医院主治医师,医学硕士,从事儿科疾病诊治研究。
[修回日期] 2018-08-15
[收稿日期] 2018-07-15;
[文章编号] 1007-3205(2018)10-1117-05
[文献标志码] A
[ 中图分类号 ] R589.2
doi: 10.3969/j.issn.1007-3205.2018.10.001
(本文编辑:许卓文)


 n JM,Salvans S,Crous X,et al. Effect of Roux-en-Y gastric bypass vs sleeve gastrectomy on glucose and gut hormones:a prospective randomised trial[J]. J Gastrointestl Surg,2012,16(6):1116-1122.
n JM,Salvans S,Crous X,et al. Effect of Roux-en-Y gastric bypass vs sleeve gastrectomy on glucose and gut hormones:a prospective randomised trial[J]. J Gastrointestl Surg,2012,16(6):1116-1122.