表1 2010年世界卫生组织神经内分泌肿瘤分级
Table 1 2010 WHO neuroendocrine tumor classification
· 论 著 ·
李胜超,彭 利
(河北医科大学第四医院肝胆外科,河北 石家庄 050011)
[ 摘要 ] 目的 探讨胰腺神经内分泌肿瘤的临床病理特征、影像学表现、治疗方法并进行预后分析。 方法 将胰腺神经内分泌肿瘤患者47例按照免疫组织化学检查结果分为功能组11例和非功能组36例;按照核分裂象计数和Ki67指数分为神经内分泌瘤(nuroendocrine tumor,NET)组40例和神经内分泌癌(nuroendocrine carcinoma,NEC)组7例。对患者进行随访,对患者的病例资料、病理资料、治疗经过、预后等进行分析。 结果 功能组和非功能组在性别、临床分期和肿瘤分级差异均无统计学意义( P >0.05)。NET组均为Ⅰ期和Ⅱ期,NEC组各期均有分布,2组差异有统计学意义( P <0.05);NET组与NEC组性别、CgA表达和Syn表达差异均无统计学意义( P >0.05)。30 例患者得到随访, 随访时间4~68个月, 1例患者术后发生肝脏转移行微波消融术,至随访结束仍生存状况良好,其余29例患者无转移或复发,生存状况良好。 结论 胰腺神经内分泌肿瘤可发生于胰腺各个部位,CT或MRI为主要检查方法,确诊依靠病理诊断,治疗以手术为主,并结合靶向治疗、射频消融、化疗等多种方式。胰腺神经内分泌肿瘤总体预后较好。
[ 关键词 ] 胰腺肿瘤;病理学,临床;预后
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor,P-NENs) ,是一类起源于神经内分泌细胞及肽能神经元的低度侵袭性、异质性肿瘤 [1] 。根据其是否伴随激素相关性的临床特征而划分为两类:功能性P-NENs和非功能性P-NENs [2] 。多数患者手术治疗效果好,即使是恶性P-NENs,由于生长缓慢,积极治疗也可获得长期存活。本研究对接受外科治疗的47例P-NENs患者进行随访,对患者的病例资料、影像学表现、病理特征、治疗、预后等进行分析,旨在加强对P-NENs的认识,提高其诊断及治疗水平。
1 . 1 一般资料 收集2005年6月—2014年6月在河北医科大学第四医院肝胆外科收治的47例经病理证实的P-NENs患者临床资料,男性16例,女性31例,年龄14~82岁,平均(48.98±17.83)岁。按照免疫组织化学检查结果分为功能组11例和非功能组36例;按照核分裂象计数和Ki67指数分为神经内分泌瘤(nuroendocrine tumor,NET)组40例和神经内分泌癌(nuroendocrine carcinoma,NEC)组7例。
1 . 2 病理评估 采用2010年第4版世界卫生组织NEN命名、分类、分期标准和2011年中国胃肠胰神经内分泌胖瘤病理学诊断共识对PNENs患者进行回顾性病理诊断,对肿瘤进行分类、分级及分期。通过神经内分泌标记物突触素(synaptophysin,Syn)和嗜铬粒蛋白A(chromograninA,CgA)的免疫组织化学染色确定肿瘤是否具有神经内分泌性质,然后根据核分裂象计数和Ki67指数决定肿瘤的分级,将P-NENs分为NET(1级和2级)和NEC(3级)。根据临床病理资料确定患者是否存在临床综合征和功能性神经内分泌肿瘤。按照世界卫生组织标准,P-NENs临床分期采用与胰腺外分泌部肿瘤相同的分级方法。见表1。
表1 2010年世界卫生组织神经内分泌肿瘤分级
Table 1 2010 WHO neuroendocrine tumor classification

注:a.核分裂象活跃区至少计数50个高倍视野;b.用MIBI抗体在核标记最强区域计数500~2 000个细胞的阳性百分比,核分裂象与Ki-67指数分级不一致时,使用分级高的参数
1 . 3 免疫组织化学染色 免疫组织化学染色采用Envision二步法,Dako自动染色机染色,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精对比染色。以磷酸盐缓冲液替代一抗作空白对照,已知阳性组织切片作阳性对照。
1 . 4 随访 随访为门诊复查和电话随访2种形式,末次随访时间为2014年10月,随访时间为4~68个月(平均36个月),门诊随访以上腹部B超或上腹部CT检查为主。
1 . 5 统计学方法 应用SPSS 13.0统计软件处理数据,计数资料比较采用χ 2 检验。 P <0.05为差异有统计学意义。
2 . 1 功能组和非功能组病理特征比较 功能能组和非功能组之间在性别、临床分期和肿瘤分级差异均无统计学意义( P >0.05),见表2。
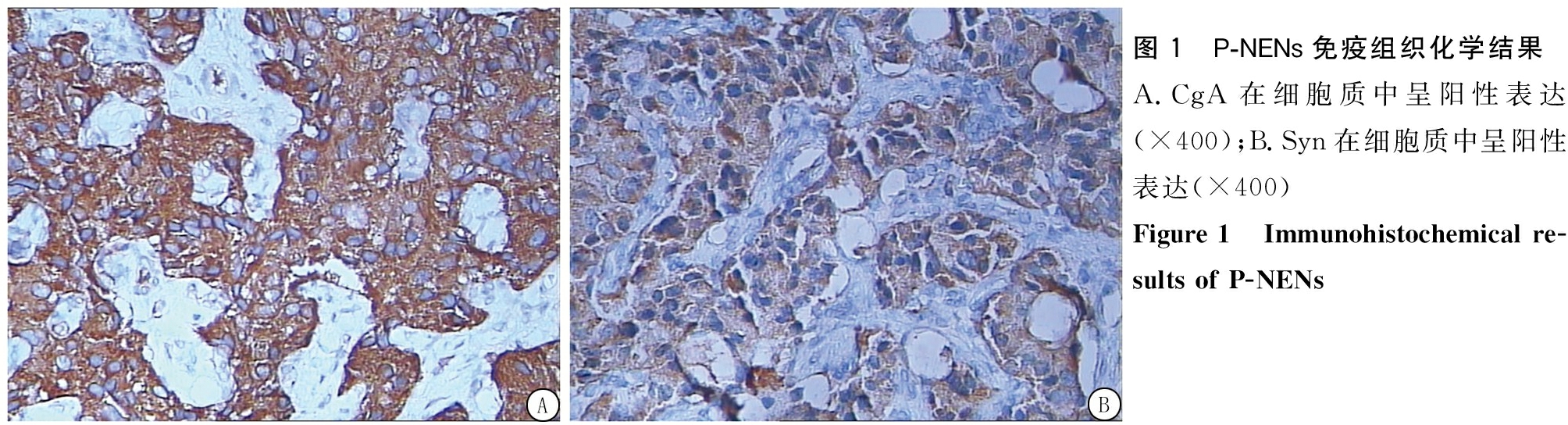
2 . 2 NET组和NEC组免疫组织化学结果比较 NET组均为Ⅰ期和Ⅱ期,NEC组各期均有分布,2组差异有统计学意义( P <0.05), NET组与NEC组在性别、CgA表达和Syn表达差异均无统计学意义( P >0.05),见表3,图1。
表2 功能组与非功能组临床病理特征比较
Table 2 Comparison of pathological features between functional and non - functional groups (例数)
表3 NET组与NEC组临床病理特征比较
Table 3 Comparison of clinical and pathological features between the NEC group and the NET group (例数)

2 . 3 随访结果 47例P-NENs患者中,30例得到随访,1例患者术后发生肝脏转移行微波消融术,至随访结束仍生存状况良好,其余29例患者无转移或复发,生存状况良好。
P-NENs是一种少见疾病,占全部胰腺肿瘤的1%~3%,其发病率呈不断上升趋势,该病可以发生于任何年龄段,多集中在30~60岁,无明显性别差异,与遗传相关 [3] 。发病率升高可能与临床医师对该病认识程度和诊断水平的提高有关。P-NENs分为功能性和非功能性P-NENs两类 [2] 。功能性P-NENs往往有特异性的内分泌紊乱代谢症状,如胰岛素瘤可因分泌过多的胰岛素,导致低血糖,表现出头晕、眼花、无力、疲乏等临床症状。非功能性P-NENs通常不表现出内分泌代谢紊乱的症状,临床表现不典型,非功能性P-NETs较容易与胰腺癌及其他恶性肿瘤混淆,延误诊断及治疗。近年来随着临床实践经验的积累和对胰腺内分泌肿瘤疾病本质的认识,P-NENs诊断率逐年增加,有关P-NENs的诊断和治疗手段在不断更新。
3 . 1 P-NENs的诊断
3 . 1 . 1 P-NENs的临床表现 非功能性P-NENs多无特异性临床表现,本研究中发现肿瘤最大直径<5 cm多由体检发现,肿瘤最大直径≥5 cm,压迫周围脏器,出现腹部隐痛伴腹胀或乏力、纳差,有1例压迫胆管出现黄染,笔者认为有临床表现主要因肿瘤生长、压迫导致。功能性P-NENs以胰岛细胞瘤多见,5%~10%为多发性内分泌肿瘤Ⅰ型。本研究功能性P-NENs患者中主要以低血糖为临床症状的胰岛素瘤,9例出现发作性低血糖昏迷伴脑损害症状,是胰岛素瘤分泌过多的胰岛素致糖在中枢神经系统的供应不足所致,重者可出现癫痫症状。进食或应用葡萄糖或症状可缓解。血管活性肠肽瘤较罕见,本研究中2例腹泻并伴发低钾血症,主要与血管活性肠肽的大量分泌相关,数量上远低于胰岛素瘤。胃泌素瘤表现为反复发作的消化道溃疡、腹泻及高胃泌素血症,极易发生消化道出血和溃疡穿孔。在受摩擦部位出现游走性红斑伴周期性发作、坏死称为胰高血糖素瘤,恶性度高,比较罕见。
3 . 1 . 2 P-NENs的影像学诊断 影像学检查包括B超、CT、MRI或正电子发射计算机断层显像等 [4] 。B超下肿瘤均表现为边界清楚的低回声占位性病变,血供丰富,对于直径>2 cm的P-NENs患者,B超的阳性率可达70%~80%,但接近80%的P-NENs肿瘤直径<2 cm,且肿瘤多位于胰腺实质内,与周围正常胰腺组织的密度相似。B超易受患者肥胖、消化道气体、操作者经验和熟练程度等因素影响,故灵敏度较低。
增强CT检查是目前较为公认的P-NENs的首选检查方法。可以清楚、客观地显示肿瘤位置、胰管是否扩张及胰腺是否萎缩等,还可显示有、无区域淋巴结肿大及胰周器官转移灶,对区别良恶性病变有重要价值。多数富含血管的P-NENs在增强CT扫描检查的动脉期均显示出高强化。胰腺分期扫描技术可显示病灶的血供多期相,CT早期灌注成像能够显示胰腺肿瘤血流动力学的变化,上述2种检查方法均可提高对胰腺占位性病变定性诊断的准确率,而CT三维血管重建能清晰地显示肿瘤、门静脉、下腔静脉,以及肠系膜上动、静脉之间的关系及其侵犯范围,从而帮助外科医师在术前制定准确和详细的手术计划。据北京协和医院的资料显示,利用多排薄层螺旋CT胰腺灌注分期扫描,其胰岛素瘤的检出率可达92.7%。P-NENs患者的增强CT图像和病理组织学发现,肿瘤钙化灶的出现往往提示其分化程度较高,注射造影剂后肿瘤的增强程度和光镜下肿瘤的血管密度成正比。低分化的肿瘤多呈不衰减、低衰减或弱高衰减,而高分化的肿瘤往往呈较强的高衰减。故增强CT检查不仅能有效发现P-NENs,而且在一定程度上能评估患者的预后。
CT下肿瘤为可强化的胰腺局部占位性病变,MRI下也可见到明显增强的胰腺占位。CT和MRI对P-NENs诊断的敏感度相似,均在90%左右。MRI对发现P-NENs具有重要作用尤其是CT难以定性的或肿瘤病灶较小而CT未能检出的,可考虑应用MRI检查。本研究2例肿瘤直径<2.0 cm的患者通过MRI技术得以明确诊断。另外,超声内镜检查(endoscopic ultrasonography,EUS)、生长抑素受体显像(somatostatin receptor scintigraphy,SRS)等检查也是可选择的影像学手段 [5-6] 。因为大多数P-NENs(除胰岛素瘤)生长抑素受体表达为阳性,故SRS对>1 cm的P-NENs敏感度可达到80%~90%,对肝转移灶的敏感性可达到81%~96%。EUS对胰腺及十二指肠的肿瘤诊断的准确性很高。对胰腺十二指肠部位不能确定的肿物可行EUS检查以提高检出率。这些检查并非常规检查方法,本研究中的47例患者均为CT或MRI发现,未行内镜超声、SRS等检查。
3 . 1 . 3 P-NENs的病理学诊断 P-NENs病理诊断依靠免疫组织化学染色,既可以确定肿瘤的神经内分泌分化程度,也可以确定特殊类型的多肽激素和生物活性胺的表达,如多数肿瘤的突触素(synaptophysins,SYN)、NSE,CgA免疫组织化学反应阳性。本研究47例P-NENs,免疫组织化学CgA 阳性44例(93.6%)、Syn阳性45例(95.7%)。与要文青等 [7] 报道的CgA阳性率为96.9%、Syn阳性率为95.3%基本一致。
P-NENs在组织病理切片下瘤细胞与正常胰腺内分泌细胞相似,细胞排列呈实体性、梁状、腺样、脑回型、管泡型或假菊形团型;大多数分化较好,分化差的较少见。对于P-NENs的分级,依靠2010世界卫生组织神经内分泌肿瘤分级 [8-9] ,即根据核分裂象个数和Ki-67指数进行 [10] 。本研究结果显示47例P-NENs中,NET 40例,NEC 7例,其中功能性P-NENs 11例,非功能性36例;病理分级1级27例,2级13例,3级7例;临床分期为Ⅰ、Ⅱ、Ⅲ和Ⅳ期的患者分别为37,7,1和2例,其中NET Ⅰ期36例,Ⅱ期4例,Ⅲ和Ⅳ期均为NEC;功能性P-NENs组与非功能性组比较,临床分期和肿瘤分级差异均无统计学意义( P >0.05);NET与NEC组临床分期差异有统计学意义( P <0.05)。要文青等 [7] 研究认为,功能性P-NENs患者与非功能性P-NENs患者比较,临床分期和肿瘤分级差异有统计学意义,P-NENs的肿瘤分级和远处转移是影响患者预后的独立因素。
3 . 2 P-NENs的治疗 P-NENs大部分生长缓慢,没有明显的年龄差异,呈低度恶性。手术切除是目前P-NENs的首选治疗方法 [11] 。P-NENs一旦诊断清楚,就应该手术治疗。P-NENs恶性程度较低,肿瘤生长速度相对较慢,即使肿瘤已经发生转移,也应尽可能切除肿瘤原发灶和转移灶以及清扫淋巴结,从而降低患者的肿瘤负荷,提高患者的生存率。
手术方法应遵循个体化原则,根据不同的肿瘤位置和患者情况决定手术方式。位于胰体尾部的肿瘤可行胰体尾切除术,胰头部的肿瘤可行胰十二指肠切除术,肿瘤较小者适合局部切除的可局部切除,但要达到根治性切除的要求,根据情况也可扩大切除范围。合并有肝转移的患者可切除原发灶,这样可明显缓解症状,转移灶如不能完整切除或全部切除的则不必勉强切除,即使强行切除转移灶,仍有很高的复发率。单发的<4 cm的胰腺囊性神经内分泌瘤,无局部侵犯者,手术包括肿瘤摘除和胰腺节段切除,应争取尽可能保留更多的胰腺组织,以减少或避免胰腺内、外分泌功能的障碍,一般不进行局部淋巴结清扫。该手术不是根治性手术,故只用于那些良性和低度恶性肿瘤。不过也有研究表明,术中诊断为良性而行胰腺节段切除术后病理为恶性的患者,术后随访其生存期与行根治性切除的患者无差异。但是只有大样本的病例回顾研究才能确定胰腺节段性切除和根治性切除对恶性P-NENs治疗价值的区别。考虑为恶性的P-NENs,如无远处转移则应行根治性切除,根据位置行胰十二指肠切除术或者胰体尾切除术,并应进行淋巴结清扫。肿瘤侵犯周围组织,如胃肠道、血管等 [12] ,应积极手术治疗,哪怕联合血管切除和重建也是必要的。由于目前P-NENs的病例较少,对于怀疑为恶性的P-NENs是否应该行根治性手术尚存在较大争议。本研究随访患者30例,目前生存状况均较好,1例发生肝多发转移无法根治切除而仅行TACE治疗的患者和术后肝转移而行微波固化治疗的患者在随访期也生存状况良好。这可能与本研究部分患者手术时临床期别较早、随访时间较短有关。总之,P-NENs总体预后较好,即使是恶性P-NENs,经积极治疗也可获得长期存活。
综上所述,P-NENs是一种少见的胰腺肿瘤,预后较好,故明确P-NENs的诊断 [13] 并选择适合的治疗方法,能改善患者的预后。手术治疗是治疗P-NENs的首选方法。对局部无法根治性切除而不伴远处转移者,积极行减瘤手术有助于改善患者预后,提高患者生活质量。对于远处转移者,积极的手术切除包括原发肿瘤和转移灶切除,完整的手术切除能改善总体生存率和无瘤生存率 [14] 。对于转移灶不可切除者,可辅以放疗、化疗、内分泌治疗、射频消融、选择性经皮动脉栓塞及分子靶向等 [15-16] 进一步治疗手段,使患者生活质量得到提高,生存时间延长。
[参考文献]
[1] Stevenson M,Lines KE,Thakker RV,et al. Molecular genetic studies of pancreatic neuroendocrine tumors: new therapeutic approaches[J]. Endocrinol Metab Clin North Am,2018,47(3):525-548.
[2] Camilli M,Papadimitriou K,Nogueira A,et al. Molecular profiling of pancreatic neuroendocrine tumors (pNETS) and the clinical potential[J]. Expert Rev Gastroenterol Hepatol,2018,12(5):471-478.
[3] Conemans EB,Lodewijk L,Moelans CB,et al. DNA methylation profiling in MEN1-related pancreatic neuroendocrine tumors reveals a potential epigenetic target for treatment[J]. Eur J Endocrinol,2018,179(3):153-160.
[4] Lee L,Ito T,Jensen RT,et al. Imaging of pancreatic neuroendocrine tumors: recent advances,current status,and controversies[J]. Expert Rev Anticancer Ther,2018,18(9):837-860.
[5] Li-Geng T,Cai G,Aslanian HR,et al. EUS diagnosis of cystic pancreatic neuroendocrine tumors[J]. VideoGIE,2018,28(3):106-108.
[6] 马慧,王瑞霞,郑敏娟,等.胃窗超声造影对胃肿瘤的诊断价值及分型[J].河北医科大学学报,2015,36(10):1209-1211.
[7] 要文青,王威亚,李甘地.64例胰腺神经内分泌肿瘤的临床病理特征[J].中华肿瘤杂志,2014,4(36):287-293.
[8] Borka K. Clinicopathological characterization of gastro-entero-pancreatic neuroendocrine tumors[J]. Magy Onkol,2018,62(2):90-97.
[9] Bu J,Youn S,Kwon W,et al. Prognostic factors of non-functioning pancreatic neuroendocrine tumor revisited:the value of WHO 2010 classification[J]. Ann Hepatobiliary Pancreat Surg,2018,22(1):66-74.
[10] Genc CG,Falconi M,Partelli S,et al. Recurrence of Pancreatic Neuroendocrine Tumors and Survival Predicted by Ki67[J]. Ann Surg Oncol,2018,25(8):2467-2474.
[11] Wong KP,Tsang JS,Lang BH,et al. Role of surgery in pancreatic neuroendocrine tumor[J]. Gland Surg,2018,7(1):36-41.
[12] Nakazuru S,Sakakibara Y,Ishida H,et al. Gastric metastasis from pancreatic neuroendocrine tumor[J]. Gastrointest Endosc,2018,88(3):559-560.
[13] Basuroy R,Bouvier C,Ramage JK,et al. Presenting symptoms and delay in diagnosis of gastrointestinal and pancreatic neuroendocrine tumours[J]. Neuroendocrinology, 2018,107(1):42-49.
[14] Shimata K,Sugawara Y,Hibi T,et al. Liver transplantation for unresectable pancreatic neuroendocrine tumors with liver metastases in an era of transplant oncology[J]. Gland Surg,2018,7(1):42-46.
[15] Hirmas N,Jadaan R,Al-Ibraheem A,et al. Peptide receptor radionuclide therapy and the treatment of gastroentero-pancreatic neuroendocrine tumors:current findings and future perspectives[J]. Nucl Med Mol Imaging,2018,52(3):190-199.
[16] Gao L,Natov NS,Daly KP,et al. An update on the management of pancreatic neuroendocrine tumors[J]. Anticancer Drugs,2018,29(7):597-612.
LI Sheng-chao, PENG Li
( Department of Liver and Gallbladder Surgery , the Fourth Hospital of Hebei Medical University , Shijiazhuang 050011, China )
[ Abstract ] Objective To analyze the clinicopatholocal features of pancreatic neuroendocrine neoplasms(P-NENs) and investigate the treatment and prognosis in patients with pancreatic neuroendocrine tumor. Methods According to the results of immunohistochemical examination, 47 cases of pancreatic neuroendocrine tumors were divided into functional group(11 cases) and non-functional group(36 cases). According to the nuclear fission image count and the Ki67 index, 40 cases were divided into the nuroendocrine tumor(NET) group and 7 cases were divided into the nuroendocrine carcinoma(NEC) group. The patients were followed up, and the case data, pathological data, treatment process and prognosis of the patients were analyzed. Results There were no statistically significant differences in gender, clinical stage and tumor grade between functional groups and non-functional groups( P >0.05). NET groups were all in Ⅰperiod and Ⅱ period, NEC group are distributed in each period. The difference between the 2 groups was statistically significant.( P <0.05). There were no statistically significant differences in gender, CgA and Syn expression between the NET group and the NEC group( P >0.05). Thirty patients were followed up, with a follow-up period of 4-68 months. One patient had liver metastasis and underwent microwave ablation until the end of the follow-up. The survival condition was still good. The remaining 29 patients had no metastasis or recurrence and had a good survival. Conclusion Pancreatic neuroendocrine tumors can occur in all parts of the pancreas. CT or MRI is the main examination method, and the diagnosis depends on pathological diagnosis, and the treatment is mainly surgery, combined with targeted therapy, radiofrequency ablation, chemotherapy and other methods. The overall prognosis of pancreatic neuroendocrine neoplasms is good.
[ Key words ] pancreatic neoplasms; pathology, clinical; prognosis
[作者简介] 李胜超(1979-),女,河北石家庄人,河北医科大学第四医院主管护士,医学硕士,从事临床护理学研究。
[基金项目] 国家自然科学基金项目(81402490);河北省医学科学研究重点课题(ZL20140332);河北省科技计划项目(16277705D)
[修回日期] 2018-09-12
[收稿日期] 2018-08-27;
[文章编号] 1007-3205(2018)10-1169-05
[文献标志码] A
[ 中图分类号 ] R735.9
doi: 10.3969/j.issn.1007-3205.2018.10.013
(本文编辑:许卓文)