Table 1 Comparison of ATIP 3 a mRNA and protein expression in four groups of cells
· 论 著 ·
黄 平,李彦英,李玲玲,齐冰丽,苏梦亚,张纪妍
(河北省沧州市中心医院妇一科,河北 沧州 061000)
[ 摘要 ] 目的 探讨血管紧张素Ⅱ受体的相互作用蛋白3a(angiotensin Ⅱ type 2 receptor-interacting protein 3a,ATIP3a)-高迁移率族蛋白A2(high mobility group AT-hook 2,HMGA2)-细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)信号通路对卵巢上皮细胞癌顺铂耐药性的影响。 方法 培养顺铂耐药卵巢癌细胞株SKOV3/DDP、A2780/DDP,分为8组( n =3),对照组C1和C2组仅向SKOV3/DDP、A2780/DDP细胞中加入RMPI 1640培养基,A1组和A2组为分别向SKOV3/DDP、A2780/DDP细胞中加入ATIP3a多肽(1 nmol/L)处理6 h,S1和S2组为分别向SKOV3/DDP、A2780/DDP细胞中转染siRNA-ATIP3a,VC1和VC2组分别向SKOV3/DDP、A2780/DDP细胞中转染siRNA-vector作为对照。顺铂3 μg/mL处理72 h后,采用乳酸脱氢酶法检测细胞的增殖能力,体外侵袭实验检测细胞侵袭能力,Real-time PCR法检测HMGA2 mRNA表达,免疫蛋白印记法检测HMGA2和磷酸化ERK的表达。 结果 A1组SKOV3/DDP细胞增殖率和侵袭能力、HMGA2 mRNA和蛋白表达、磷酸化ERK蛋白表达明显低于C1组,S1组SKOV3/DDP细胞增殖率和侵袭能力、HMGA2 mRNA和蛋白表达、磷酸化ERK蛋白表达明显高于C1组、A1组,VC1组SKOV3/DDP细胞增殖率和侵袭能力、HMGA2 mRNA和蛋白表达、磷酸化ERK蛋白表达高于A1组,低于S1组,差异均有统计学意义( P <0.05); A2组A2780/DDP细胞增殖率和侵袭能力、HMGA2 mRNA和蛋白表达、磷酸化ERK蛋白表达低于C2组; S2组A2780/DDP细胞增殖率和侵袭能力、HMGA2 mRNA和蛋白表达、磷酸化ERK蛋白表达明显高于C2组、A2组,VC2组A2780/DDP细胞增殖率和侵袭能力、HMGA2 mRNA和蛋白表达、磷酸化ERK蛋白表达高于A2组,低于S2组,差异均有统计学意义( P <0.05)。 结论 卵巢上皮细胞癌顺铂耐药性可能与ATIP3a-HMGA2-ERK信号通路有关。
[ 关键词 ] 卵巢肿瘤;顺铂耐药性;ATIP3a-HMGA2-ERK信号通路
卵巢癌临床症状隐匿,是导致发达国家妇女死亡的主要妇科恶性肿瘤之一 [1-2] 。化疗是卵巢癌患者术后或不能进行手术患者的重要治疗措施,顺铂作为卵巢癌化疗的一线药物,其耐药性已成为亟待解决的问题 [3-5] 。血管紧张素Ⅱ受体的相互作用蛋白3a(angiotensin Ⅱ type 2 receptor-interacting protein 3a,ATIP3a)是一种由微管相关肿瘤抑制基因编码的,直接作用于细胞膜、细胞质和细胞核,能够有效抑制细胞有丝分裂的蛋白 [6] ,已有研究表明下调ATIP3a的表达可增加口腔癌细胞的低分化,导致预后不良 [7] 。高迁移率族蛋白A2(high mobility group AT-hook 2,HMGA2)可通过调节转录增强因子的活性,改变染色质结构,通过增加细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)的磷酸化水平促进细胞的有丝分裂 [8-9] 。既往研究表明,ATIP3a-HMGA2信号通路可能与卵巢癌细胞的发生发展存在密切联系 [10] 。本研究探讨ATIP3a-HMGA2-ERK信号通路在顺铂耐药卵巢上皮性癌细胞耐药性中的作用,旨在为进一步解决卵巢癌的顺铂耐药性提供思路和治疗靶点。
1 . 1 细胞和抗体来源 卵巢癌上皮性细胞株SKOV3和A2780、顺铂耐药卵巢癌上皮性细胞SKOV3/DDP和A2780/DDP购自中国典型物保藏中心;ATIP3a多肽、siRNA-ATIP3a及阴性对照组siRNA-vector由苏州吉玛基因公司合成;LipofectaminTM2000购自Invitrogen公司;HMGA2抗体(兔抗人)、磷酸化细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)抗体(兔抗人)购自美国Abcam公司;二抗(山羊抗兔)购自武汉博士德生物工程有限公司;细胞培养相关试剂均购自于美国Gibco公司;乳酸脱氢酶试剂盒购自碧云天生物制剂有限公司;顺铂购自德国Merck公司。
1 . 2 细胞培养及转染 卵巢癌上皮性细胞SKOV3、A2780、顺铂耐药卵巢癌上皮性细胞SKOV3/DDP、A2780/DDP接种于含有10%胎牛血清和100 U/mL青霉素的RPMI 1640培养基中,将培养皿放入37 ℃、CO 2 浓度为5%的培养箱(Thermo,美国)中培养,细胞呈贴壁生长,当细胞生长至70%~80%时,胰蛋白酶消化、传代,取对数生长期的SKOV3、A2780、SKOV3/DDP、A2780/DDP细胞用于实验。对照组C1和C2组仅向SKOV3/DDP、A2780/DDP细胞中加入RMPI 1640培养基,A1组和A2组为分别向SKOV3/DDP、A2780/DDP细胞中加入ATIP3a多肽(1 nmol/L),处理6 h;S1和S2组为分别向SKOV3/DDP、A2780/DDP细胞中转染siRNA-ATIP3a,严格按照Invitrogen公司提供的试剂说明书,使用LipofectaminTM2000进行转染将SKOV3/DDP、A2780/DDP细胞以5×10 5 /孔密度接种于6孔板上,细胞融合至60%~70%密度时,用2 μL的脂质体(Lipofectamin TM2000)和siRNA-ATIP3a以体积1∶50混匀后加入培养液中进行转染,转染6 h后,用PBS清洗3遍,更换普通培养液继续培养48 h,使用qPCR验证转染效率。VC1和VC2分别向SKOV3/DDP、A2780/DDP细胞中转染siRNA-vector作为对照。顺铂使用DMSO溶液溶解完全后,使用RPMI 1640培养基将其浓度稀释至3 μg/mL,将含有顺铂的RPMI 1640培养基加入各组细胞,处理72 h。
1 . 3 SKOV3/DDP、A2780/DDP增殖率的测定 采用乳酸脱氢酶(lactate dehydrogenase,LDH)法测定细胞增殖率。每组取3孔,将收集的细胞培养液以13 000 r/min速度离心10 min,每组离心后的细胞培养液上清取100 μL,转移至96孔板。按LDH试剂盒说明书加入所需试剂,充分反应后于分光光度计测量各孔在492 nm处的吸光度,655 nm处的波长为参照。各组细胞在除去细胞培养基后,加入0.5% Trition,并孵育30 min,并按照上述方法测定各孔在492 nm处的吸光度,最终细胞增殖率(%)= (上清液中LDH+细胞内LDH)/上清液中LDH ×100%,并重复3次
1 . 4 体外细胞侵袭能力检测 每组SKOV3/DDP、A2780/DDP细胞取3孔,将收集的细胞悬液200 μL(含有2×10 4 个细胞)加入预先使用100 μL Matrigel包被的Transwell小室,Transwell下室加入RPMI 1640培养基500 μL,将Transwell小室置于37 ℃、5% CO 2 的培养箱中培养,待细胞贴壁后,各组更换相应培养基。37℃、5%CO 2 培养箱中培养48 h后,擦去Transwell小室上未穿过的细胞,风干后用0.1%结晶紫染色30 min,倒置显微镜下(×100)计数10个不同视野中的穿膜细胞数,重复3次并取均值。
1 . 5 体外侵袭实验检测 SKOV3/DDP、A2780/DDP细胞的侵袭能力每组取3孔,在置有聚碳酸酯膜(8 μm孔径)的Transwell小室底部膜的上室面使用100 μL Matrigel铺成人工底模,37 ℃下放置2 h,并置于超净台内紫外线照射风干过夜。使用前30 min重新水化成胶。在预包被的Transwell小室中每孔加入各组SKOV3/DDP、A2780/DDP细胞悬液200 μL(含有2×10 4 个细胞),下室加入RPMI 1640培养基500 μL,37 ℃、CO 2 浓度为5%的培养箱中培养,待细胞贴壁后,各组更换相应培养基并处理48 h。使用无菌棉签擦去Transwell小室上未穿过的细胞,风干后用0.1%结晶紫染色30 min,倒置显微镜下(×100)计数10个不同视野中的穿膜细胞数。实验重复3次并取均值。
1 . 6 Real-time PCR 每组取3孔,收集SKOV3、A2780、SKOV3/DDP和A2780/DDP细胞,采用PCR法测定ATIP3a、HMGA2 mRNA的表达水平:参照Gene bank所公布的基因序列合成(大连宝成生物技术公司),并使用NCBI提供的Blast进行引物序列验证,与其他基因无匹配。
提取SKOV3、A2780、SKOV3/DDP、A2780/DDP细胞总RNA(Trizol法),当总RNA的OD260/OD280在1.8~2.0之间时复合逆转录标准。总RNA逆转录反应后,将所得cDNA使用20 μL反应体系(1×Real master mix,1×SYBR Green,上下游引物个1 μL及1 μL cDNA)行荧光实时定量PCR反应,GADPH基因作为内参照。反应条件为:95 ℃ 10 s,一个循环;95 ℃ 5 s,59 ℃ 30 s;82 ℃ 1 s,39个循环;读版;30 ℃ 1 s,绘制标准曲线。利用标准曲线校正SKOV3、A2780、SKOV3/DDP、A2780/DDP各组细胞中目的cDNA的表达水平。结果采用PCR反应指数增长初期荧光信号跨越阈值时的反应循环数(Ct值)表示,相对定量采用比较法,即以目的基因ATIP3a、HMGA2 mRNA Ct值和内参基因GADPH mRNA值的比值反映表达水平,每个样本均做3个复孔,以不加模板为空白对照。
1 . 7 蛋白免疫印迹 分析每组取3孔,收集各组处理后的SKOV3/DDP、A2780/DDP细胞,裂解液将细胞裂解,煮沸法蛋白变性。各组所收集蛋白质浓度采用BCA法测定。每孔25 μg蛋白质上样,6%十二烷基硫酸钠聚丙烯酰胺凝胶电泳中电流恒定进行电泳,电压恒定半干法转至偏二氟乙烯膜(polyvinylidenefluoride,PVDF膜,5%脱脂奶粉室温封闭1 h后,TBST洗膜,分别加入兔抗人ATIP3a、HMGA2、磷酸化ERK抗体(1∶1 000),37 ℃下1 h孵育后,TBST洗膜3次,每次10 min。山羊抗兔二抗(1∶1 000)25 ℃ 1 h孵育,TBST洗膜3次,每次10 min,ECL发光,以GADPH作为内参照。
1 . 8 统计学方法 应用SPSS 11.5统计软件处理数据。计量资料比较分别采用两独立样本的 t 检验、单因素方差分析和SNK- q 检验。 P <0.05为差异有统计学意义。
2 . 1 卵巢癌野生细胞株与耐药株ATIP3a mRNA和ATIP3a蛋白表达比较 卵巢癌顺铂耐药株SKOV3/DDP和卵巢癌顺铂耐药株A2780ATIP3a mRNA和ATIP3a蛋白表达低于其野生细胞株SKOV3和A2780,差异均有统计学意义( P <0.05),见表1,图1。
表1 4组细胞ATIP3a mRNA和蛋白表达比较
Table 1 Comparison of ATIP 3 a mRNA and protein expression in four groups of cells ![]()
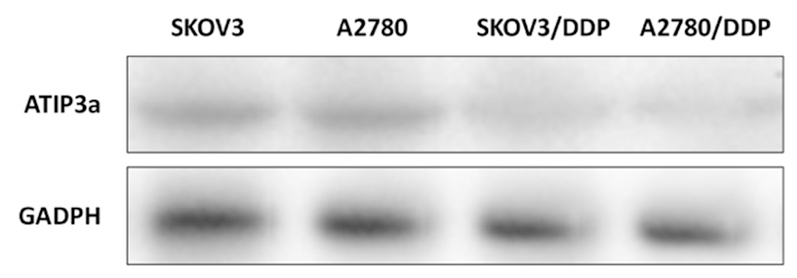
图1 4组细胞ATIP3a蛋白表达
Figure 1 Protein expression of ATIP 3 a in four groups
2 . 2 各组耐药株细胞生长增殖率与细胞侵袭能力比较 A1组SKOV3/DDP细胞增殖率、穿过细胞数较C1组明显下降,S1组SKOV3/DDP细胞增殖
率、穿过细胞数较C1组、VC1组均明显升高,VC1组SKOV3/DDP细胞增殖率、穿过细胞数较A1组升高,较S1组降低,差异均有统计学意义( P <0.05)。A2组A2780/DDP细胞增殖率、穿过细胞数明显低于C2组,S2组A2780/DDP细胞增殖率、穿过细胞数明显高于C2组、A2组,VC2组SKOV3/DDP细胞增殖率、穿过细胞数较A2组升高,较S2组降低,差异均有统计学意义( P <0.05)。见表2。
表2 SKOV3 / DDP 、 A2780 / DDP细胞增殖率和细胞侵袭能力比较
Table 2 Comparison of cell proliferation and invasion in SKOV 3/ DDP and A 2780/ DDP cells ![]()
* P <0.05与C1组比较 # P <0.05与A1组比较 △ P <0.05与S1组比较 ☆ P <0.05与C2组比较 ▲ P <0.05与A2组比较 ★ P <0.05与S2组比较(SNK- q 检验)
2 . 3 4组细胞HMGA2 mRNA表达比较 A1组SKOV3/DDP细胞HMGA2 mRNA表达明显低于C1组,S1组SKOV3/DDP细胞HMGA2 mRNA表达明显高于C1组、A1组,VC1组SKOV3/DDP细胞HMGA2 mRNA表达高于A1组,低于S1组,差异均有统计学意义( P <0.05);A2组A2780/DDP细胞HMGA2 mRNA表达明显低于C2组,S2组A2780/DDP细胞HMGA2 mRNA表达明显高于C2组、A2组, VC2组A2780/DDP细胞HMGA2 mRNA表达高于A2组,低于S2组,差异均有统计学意义( P <0.05)。见表3。
2 . 4 4组细胞HMGA2和磷酸化ERK蛋白表达比较 A1组SKOV3/DDP细胞HMGA2和磷酸化ERK蛋白表达明显低于C1组,S1组高于C1组、A1组和VC1组,VC1组高于A1组,低于S1组,差异均有统计学意义( P <0.05);A2组A2780/DDP细胞HMGA2和磷酸化ERK蛋白表达明显低于C2组,S2组明显高于C2组、A2组,VC2组高于A2组,低于S2组,差异均有统计学意义( P <0.05)。见表4,图2。
表3 SKOV3 / DDP 、 A2780 / DDP细胞HMGA2 mRNA
表达比较
Table 3 Comparison of HMGA 2 mRNA in SKOV 3/ DDP and A 2780/ DDP cells ![]()
* P <0.05与C1组比较 # P <0.05与A1 组比较 △ P <0.05与S1组比较 ☆ P <0.05与C2组比较 ▲ P <0.05与A2组比较 ★ P <0.05与S2组比较(SNK- q 检验)
表4 SKOV3 / DDP 、 A2780 / DDP细胞HMGA2和磷酸化ERK蛋白表达比较
Table 4 Comparison of HMGA 2 and phosphorylated ERK protein in SKOV 3/ DDP and A 2780/ DDP cells ![]()
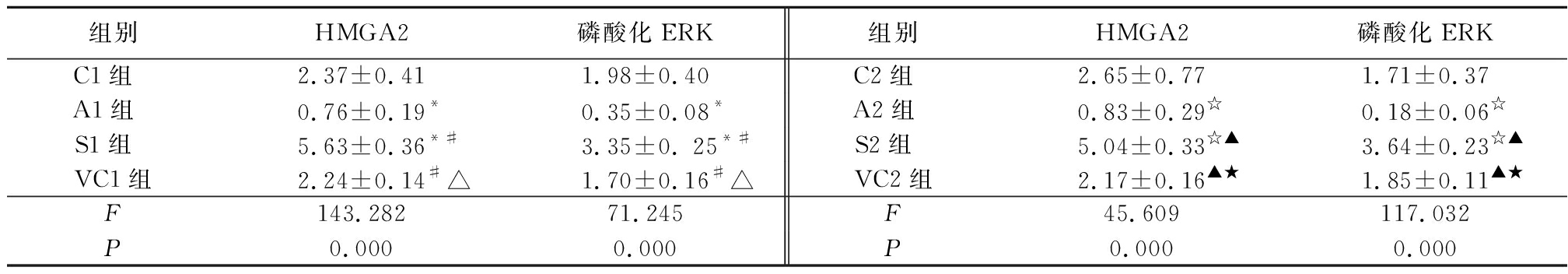
* P <0.05与C1组比较 P <0.05与A1 组比较 △ P <0.05与S1组比较 ☆ P <0.05与C2组比较 ▲ P <0.05与A2组比较 ★ P <0.05与S2组比较(SNK- q 检验)
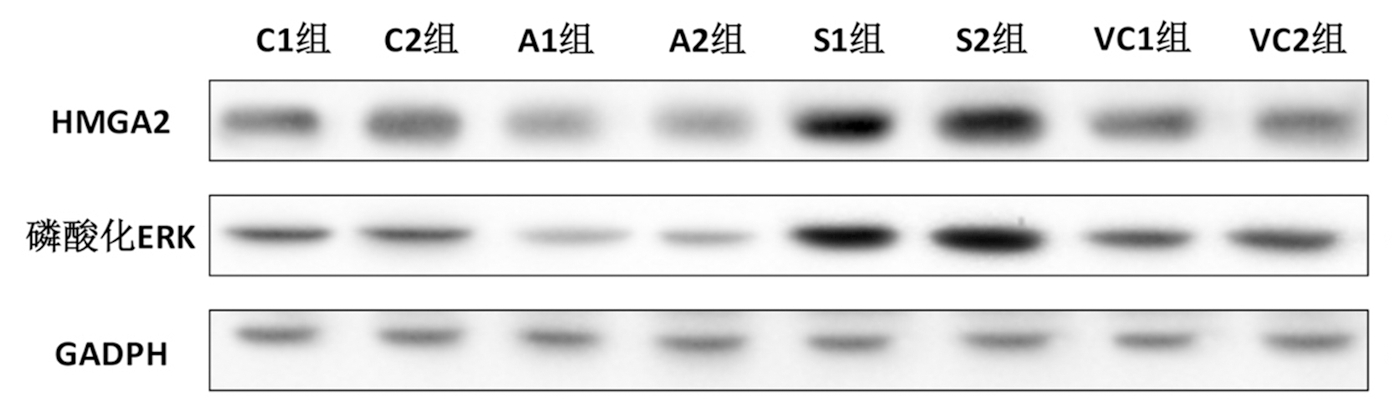
图2 SKOV3 / DDP 、 A2780 / DDP细胞HMGA2和磷酸化ERK蛋白表达
Figure 2 Expression of HMGA 2 and phosphorylated ERK protein in SKOV 3/ DDP and A 2780/ DDP cells
既往研究表明,随着顺铂浓度的升高,SKOV3/DDP和A2780/DDP细胞增殖率逐渐下降,但在3 μg/mL时到达峰值,故本研究采用顺铂3 μg/mL处理。有研究报道,微管相关肿瘤抑制基因表达下调,可抑制ATIP家族的表达,从而有效增强口腔癌细胞的有丝分裂,促进肿瘤的复发和转移 [11] 。ATIP3a作为ATIP家族的重要成员,上调ATIP3a的表达可增加口腔癌细胞的凋亡,而下调ATIP3a的表达,则可增强口腔癌细胞的增殖能力 [12] 。本研究结果显示,与SKOV3、A2780比较,顺铂耐药卵巢癌上皮细胞SKOV3/DDP和A2780/DDP中ATIP3a的表达下调;ATIP3a多肽预处理6 h能够有效降低SKOV3/DDP和A2780/DDP接受顺铂处理后的增殖率及侵袭能力,而siRNA-ATIP3a却增加了SKOV3/DDP和A2780/DDP接受顺铂处理后的增殖率及侵袭能力。以上结果表明,ATIP3a能够降低顺铂耐药卵巢癌细胞SKOV3/DDP和A2780/DDP的耐药性,下调ATIP3a的表达,增加卵巢癌细胞SKOV3/DDP和A2780/DDP的耐药性。
HMGA2在多种恶性肿瘤的发生、转移过程中发挥着重要的作用 [13] 。ERK作为丝裂原活化蛋白激酶家族的重要成员,能够有效促进细胞的有丝分裂 [14] 。已有研究表明,HMGA2能够通过增加ERK的磷酸化水平,促进直肠癌的生长及转移 [15] 。HMGA2是ATIP3a重要的靶蛋白,ATIP3a-HMGA2信号通路可能与卵巢癌细胞的发生发展存在密切联系 [10] 。本研究结果显示,ATIP3a多肽可下调SKOV3/DDP和A2780/DDP细胞HMGA2 mRNA及HMGA2蛋白的表达,同时抑制ERK的磷酸化水平;而siRNA-ATIP3a能够上调SKOV3/DDP和A2780/DDP细胞HMGA2 mRNA及HMGA2蛋白的表达,同时增加ERK的磷酸化水平。以上结果表明卵巢癌细胞的顺铂耐药机制可能与ATIP3a表达减少,导致HMGA2表达增强,并进一步增加ERK的磷酸化水平相关。
综上所述,卵巢上皮细胞癌顺铂耐药性可能与ATIP3a-HMGA2-ERK信号通路有关。
[参考文献]
[1] Lund RJ,Huhtinen K,Salmi J,et al. DNA methylation and transcriptome changes associated with cisplatin resistance in ovarian cancer[J]. Sci Rep,2017,7(1):1469.
[2] Henderson JT,Webber EM,Sawaya GF. Screening for ovarian cancer:updated evidence report and systematic review for the US preventive services task force[J]. JAMA,2018,319(6):595-606.
[3] Han X,Zhen S,Ye Z,et al. A feedback loop between miR-30a/c-5p and DNMT1 mediates cisplatin resistance in ovarian cancer cells[J]. Cell Physiol Biochem,2017,41(3):973-986.
[4] Song X,Yan L,Lu C,et al. Activation of hedgehog signaling and its association with cisplatin resistance in ovarian epithelial tumors[J]. Oncol Lett,2018,15(4):5569-5576.
[5] Shen MH,Chen LP,Ho TF,et al. Validation of the Taiwan Chinese version of the EORTC QLQ-CR29 to assess quality of life in colorectal cancer patients[J]. BMC Cancer,2018,18(1):353.
[6] Jing F,Mogi M,Min LJ,et al. Effect of angiotensin Ⅱ type 2 receptor-interacting protein on adipose tissue function via modulation of macrophage polarization[J]. PLoS One,2013,8(4):e60067.
[7] Zhao T,Ding X,Chang B,et al. MTUS1/ATIP3a down-regulation is associated with enhanced migration,invasion and poor prognosis in salivary adenoid cystic carcinoma[J]. BMC Cancer,2015,15:203.
[8] Liang C,Xu Y,Ge H,et al. miR-564 inhibits hepatocellular carcinoma cell proliferation and invasion by targeting the GRB2-ERK1/2-AKT axis[J]. Oncotarget,2017,8(64):107543-107557.
[9] Li Y,Zhao Z,Xu C,et al. HMGA2 induces transcription factor Slug expression to promote epithelial-to-mesenchymal transition and contributes to colon cancer progression[J]. Cancer Lett,2014,355(1):130-140.
[10] Ping H,Guo L,Xi J,et al. Angiotensin Ⅱ type 2 receptor-interacting protein 3a inhibits ovarian carcinoma metastasis via the extracellular HMGA2-mediated ERK/EMT pathway[J]. Tumour Biol,2017,39(6):1010428317713389.
[11] Ding X,Zhang N,Cai Y,et al. Down-regulation of tumor suppressor MTUS1/ATIP is associated with enhanced proliferation,poor differentiation and poor prognosis in oral tongue squamous cell carcinoma[J]. Mol Oncol,2012,6(1):73-80.
[12] Zhao T,He Q,Liu Z,et al. Angiotensin Ⅱ type 2 receptor-interacting protein 3a suppresses proliferation,migration and invasion in tongue squamous cell carcinoma via the extracellular signal-regulated kinase-Snai2 pathway[J]. Oncol Lett,2016,11(1):340-344.
[13] Li W,Wang Z,Zha L,et al. HMGA2 regulates epithelial-mesenchymal transition and the acquisition of tumor stem cell properties through TWIST1 in gastric cancer[J]. Oncol Rep,2017,37(1):185-192.
[14] El Moussawi L,Chakkour M,Kreydiyyeh SI. Epinephrine modulates Na + /K + ATPase activity in Caco-2 cells via Src,p38MAPK,ERK and PGE2[J]. PLoS One,2018,13(2):e0193139.
[15] Kao CY,Yang PM,Wu MH,et al. Heat shock protein 90 is involved in the regulation of HMGA2-driven growth and epithelial-to-mesenchymal transition of colorectal cancer cells[J]. Peer J,2016,4:e1683.
HUANG Ping, LI Yan-ying, LI Ling-ling, QI Bing-li, SU Meng-ya, ZHANG Ji-yan
( The First Department of Gynaecology , Cangzhou Central Hospital , Hebei Province , Cangzhou 061000, China )
[ Abstract ] Objective To explore the effects of ATIP3a-HMGA2-ERK signaling pathway on cisplatin resistance in epithelial ovarian cancer. Methods DDP-resistant ovarian cancer cell lines SKOV3/DDP and A2780/DDP were cultured to exponential phase and assigned to control group(C1and C2 Group), ATIP3a group(A1 and A2 Group), siRNA-ATIP3a group(S1and S2 Group) and siRNA-vector group(VC1 and VC2 Group)( n =3), respectively. The cells in A1 and A2 groups were treated with ATIP3a polypeptides(1 nmol/L). The cells in S1 and S2 groups were treated with siRNA-ATIP3a, but VC1 and VC2 were treated with siRNA-vector as control. Then all the cells were treated with DDP for 72 h. The effects of cell proliferation and invasion were assessed by lactate dehydrogenase and transwell assays. The expression in HMGA2 was measured by Real-time PCR and western-blot. Phosphorylation of ERK was also assessed by Western-blot. Results Compared with C1, ATIP3a polypeptides treatment decreased cell proliferation,invasion, mRNA and protein expression of HMGA2, and phosphorylation of ERK in A1 group. Compared with C1 and A1 groups, siRNA-ATIP3a increased cell proliferation, invasion, mRNA and protein expression of HMGA2, and phosphorylation of ERK in S1 group. The cell proliferation, invasion, mRNA and protein expression of HMGA2, and phosphorylation of ERK in VC1 group were increased compared with A1, but decreased compared with S1. Compared with C2, ATIP3a polypeptides treatment decreased cell proliferation, invasion, mRNA and protein expression of HMGA2, and phosphorylation of ERK in A1 group. Compared with C2 and A2 groups, siRNA-ATIP3a increased cell proliferation, invasion, mRNA and protein expression of HMGA2, and phosphorylation of ERK in S2 group.The cell proliferation, invasion, HMGA2 expression of mRNA and protein, and phosphorylation of ERK in VC2 group were increased compared with A2, but decreased compared with S2. Conclusion The DDP-resistant of human epithelial ovarian cancer might be associated with ATIP3a-HMGA2-ERK signal pathway.
[ Key words ] ovarian neoplasms; cisplatin resistance; ATIP3a-HMGA2-ERK signal pathway
[作者简介] 黄平(1978-),女,河北沧州人,河北省沧州市中心医院主治医师,医学硕士,从事妇科疾病诊治研究。
[修回日期] 2018-08-16
[收稿日期] 2018-05-11;
[文章编号] 1007-3205(2018)10-1179-06
[文献标志码] A
[ 中图分类号 ] R737.31
doi: 10.3969/j.issn.1007-3205.2018.10.015
(本文编辑:许卓文)