Table 1 Comparison of general data among three groups of PCOS patients
· 论 著 ·
刘 盼,郭丽娜,赵敏英
(河北省石家庄市第一医院生殖医学科,河北 石家庄 050011)
[ 摘要 ] 目的 评估多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者内分泌状态对其宫腔内人工授精(intrauterine insemination,IUI)成功率的影响。 方法 收集生殖医学科行夫精宫腔内人工授精助孕的PCOS患者的临床资料,共180个周期,按抗苗勒管激素(anti-Mullerian hormone,AMH)值高低分为3组,1组AMH值≤16.32 pmol/L(第25百分位),2组>16.32~29.35 pmol/L,3组AMH值>29.35 pmol/L(第75百分位),比较各组的黄体生成素(luteinizing hormone,LH)、黄体生成素/卵泡刺激素(luteinizing hormone/follicle-stimulating hormone,LH/FSH)、睾酮(testosterone,T)值和妊娠率。 结果 3组PCOS患者年龄、体重指数(body mass index,BMI)和不孕年限差异均无统计学意义( P >0.05)。2组和3组LH、LH/FSH、T值均高于1组,3组又高于2组,差异均有统计学意义( P <0.05)。PCOS患者AMH值与LH、LH/FSH、T值呈正相关( P <0.05)。1组妊娠率为24.4%,2组妊娠率为14.4%,3组妊娠率为8.9%,3组间妊娠率差异无统计学意义( P >0.05)。 结论 高AMH水平的PCOS患者,同时也存在高LH、T和LH/FSH。AMH水平对PCOS患者行IUI治疗的妊娠结局预测价值有限,但是其水平过高还是会降低妊娠率。
[ 关键词 ] 多囊卵巢综合征;授精,人工;妊娠结局
多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者多表现为卵泡发育成熟障碍、卵子质量差、不排卵或稀发排卵,这些表现可能与其异常的内分泌状态和异常的代谢功能有关 [1] 。女性抗苗勒管激素(anti-mullerian hormone,AMH)是由窦前卵泡和早期窦卵泡周围的颗粒细胞产生的。PCOS患者血清AMH水平比正常女性高2~4倍,这与PCOS患者窦卵泡数量增多和相应的颗粒细胞数量增多有关 [2] 。虽然AMH是目前公认的最佳的卵巢储备指标,但是其对妊娠结局的预测价值仍然存在争议 [3] ,而且关于AMH与PCOS患者宫腔内人工授精(intrauterine insemination,IUI)妊娠结局的相关研究并不多。本研究旨在对AMH水平与性激素、PCOS患者诱导排卵后行IUI的妊娠结局关系进行分析。
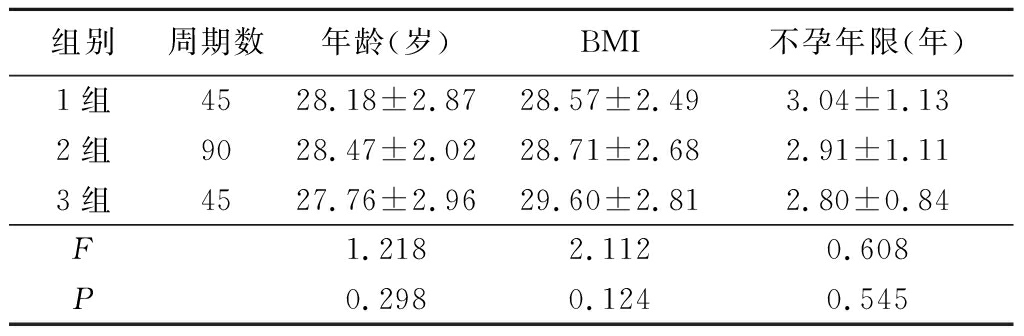
1 . 1 一般资料 收集2013年1月—2017年6月于我院生殖医学科行夫精宫腔内人工授精(intrauterine insemination-husband,IUI-H)助孕的PCOS患者的临床资料,对其180个周期的数据进行回顾性分析。按AMH值高低分为3组:1组AMH值≤16.32 pmol/L(第25百分位)45个周期;2组>16.32~29.35 pmol/L 90个周期;3组AMH值>29.35 pmol/L(第75百分位)45个周期。3组间年龄、体重指数(body mass index,BMI)、不孕年限差异均无统计学意义( P >0.05),具有可比性,见表1。
1 . 2 入选标准 (1)符合2003年欧洲人类生殖与胚胎学会、美国生殖医学会在鹿特丹会议中制定的标准:①稀发排卵或无排卵;②高雄激素的临床表现和(或)高雄激素血症;③卵巢多囊性改变一侧或双侧卵巢直径2~9 mm的卵泡≥12个,和(或)卵巢体积≥10 mL。符合上述任意2条,排除其他内分泌及代谢异常疾病,即可诊断为PCOS。其中稀发排卵或无排卵判断标准:①初潮2年不能建立规律月经;②闭经(停经时间超过3个以往月经周期或月经周期≥6个月);③月经稀发≥35 d及每年≥3个月不排卵;高雄激素血症的临床症状[包括多毛、痤疮、脱发(男性型秃发)和男性化体征]。(2)行子宫输卵管造影或腹腔镜检查证实至少一侧输卵管通畅。(3)诱排3~6个周期未孕。(4)手术日,男方精液优化后前向运动精子总数≥10×10 6 /mL。
表1 3组PCOS患者一般资料比较
Table 1 Comparison of general data among three groups of PCOS patients ![]()
1 . 3 排除标准 ①存在IUI手术禁忌证:患有严重的遗传、躯体疾病或精神心理疾病;患有生殖泌尿系统急性感染或性传播疾病;有吸毒、酗酒等严重不良嗜好;接触致畸量的药品、射线、毒物,并处于作用期;②患者合并输卵管、子宫、宫颈及免疫因素等导致不孕的原因;③因个人因素放弃治疗的不计入统计范围。
1 . 4 研究方法
1 . 4 . 1 诱导排卵及卵泡监测 所有患者于月经第2~4天检测黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH)、雌二醇(estradiol,E 2 )、睾酮(testosterone,T)和AMH,根据结果和既往诱导排卵情况在卵泡期使用枸橼酸克罗米芬诱导排卵。从月经第10天开始监测卵泡的数目、大小,以及子宫内膜的类型和厚度,当优势卵泡直径≥18 mm、出现尿LH峰或E 2 ≥734 pmol/L时,肌注人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)5 000~10 000 U。阴道B超下的排卵征象:优势卵泡壁发生塌陷,卵泡体积缩小,轮廓清晰的卵泡内无回声区消失,同时盆腔内可见少量积液。
1 . 4 . 2 授精时机 ①排卵前授精:注射HCG 5 000~10 000 U,24~36 h行IUI。②排卵后授精:B超确认排卵后24 h内行IUI。每例均行2次人工授精,排卵前1次,排卵后1次。
1 . 4 . 3 精液处理及IUI IUI前禁欲2~7 d ,手淫法采集精液于无菌取精杯中,室温下液化,对采集的精液进行常规分析,用密度梯度离心法处理精液后,再次对优化后的精液进行分析。若优化后前向运动精子总数≥10×10 6 /mL,该周期便可纳入本研究中。IUI时用人工授精导管抽吸洗涤优化后的0.3~0.5 mL精子悬液,通过宫颈缓慢注入宫腔内。
1 . 4 . 4 黄体支持 术后口服黄体酮胶囊100 mg/次,2次/d,共14 d。
1 . 4 . 5 术后随访及妊娠确定 所有患者术后14 d返院测定血或尿HCG。HCG阳性者术后5周行阴道超声检测,若发现宫内妊娠囊或原始心管搏动,则确定为临床妊娠。
1 . 5 统计学方法 应用SPSS 17.0统计软件处理数据。计量资料比较分别采用单因素方差分析和LSD- t 法;计数资料比较采用χ 2 检验;相关性采用Pearson相关分析。 P <0.05为差异有统计学意义。
2 . 1 3组PCOS患者LH、LH/FSH、T值水平比较 2组和3组LH、LH/FSH、T值均高于1组,3组又高于2组,差异均有统计学意义( P <0.05),见表2。
表2 3组PCOS患者LH 、 LH / FSH 、 T值水平比较
Table 2 Comparison of LH , LH / FSH and T levels in the three groups of PCOS patients ![]()
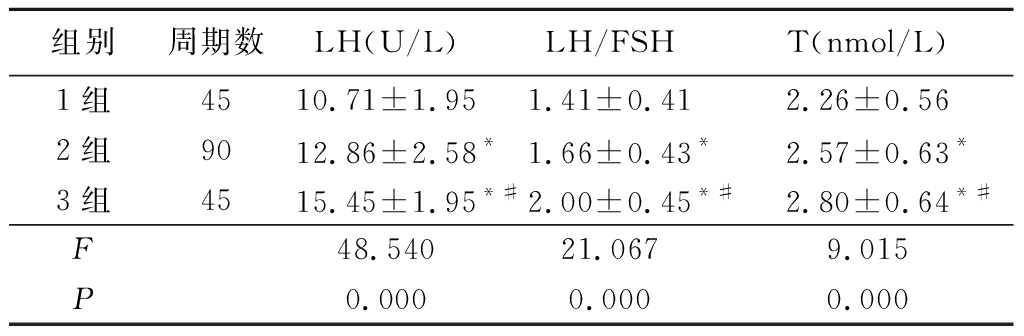
* P <0.05 与1组比较 # P <0.05与2组比较 (LSD- t 法)
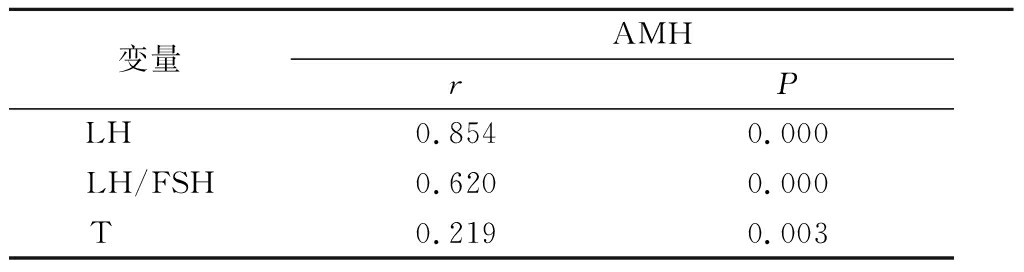
2 . 2 相关性分析 PCOS患者AMH值与LH、LH/FSH、T值呈正相关( P <0.05),见表3。
表3 PCOS患者AMH值与LH 、 LH / FSH 、 T值相关性分析
Table 3 Correlation analysis between AMH value and LH , LH / FSH and T values in PCOS patients
2 . 3 3组PCOS患者妊娠率比较 1组妊娠率为24.4%,2组妊娠率为14.4%,3组妊娠率为8.9%,3组间妊娠率差异无统计学意义( P >0.05),见表4。
表4 3组PCOS患者妊娠率比较
Table 4 Comparison of pregnancy rate in there groups of PCOS patients (周期数,%)

PCOS是一种常见的女性生殖内分泌疾病和代谢异常性疾病,发病机制至今不明,全球5%~20%的育龄妇女深受其影响 [4] 。PCOS主要表现为激素失衡、少排或不排卵,这些患者通常需要诱导排卵或行辅助生殖技术(assisted reproductive technology,ART)助孕。ART是指用医学技术手段对配子和胚胎进行操作,辅助患者受孕的技术,包括人工授精和体外受精-胚胎移植技术以及其各种衍生技术。
IUI是治疗不孕症的一种辅助生育手段,是指通过导管将优化好的精液注入女方的宫腔里,由于其操作简单、经济、损伤小,易于被患者接受。不孕不育患者,包括PCOS患者,在其至少一侧输卵管通畅的情况下,IUI是首选的治疗方法。
PCOS是年轻女性无排卵性不孕和高雄激素血症的最常见原因,患有PCOS的妇女其特征是小窦状卵泡增多,而AMH在小窦状卵泡中表达最强。AMH是转化生长因子b超家族的二聚糖蛋白成员,女性AMH是由窦前卵泡和早期窦卵泡周围的颗粒细胞产生的,在出生时血清中几乎检测不到AMH。AMH在卵巢中的主要作用是对卵泡发育的早期阶段产生抑制作用。在成年女性中,血清AMH水平随着年龄增加逐渐下降,并且在36岁后显著下降,但在整个月经周期其水平是保持稳定的,故AMH被认为是卵泡储备的预测器 [5] ,PCOS妇女其卵巢储备功能优于非PCOS妇女 [6] 。在辅助生殖技术周期中,AMH被认为是评估育龄妇女生育力和妊娠结局的指标。AMH的主要作用包括调节控制始基卵泡的募集,促进卵泡的发育成熟和优势卵泡的选择 [7] 。PCOS患者血清AMH水平一般是非PCOS患者的2~4倍,且其升高倍数与卵泡数增加倍数相当 [8] 。在诊断PCOS方面,血清AMH水平的测定已逐渐开始取代超声监测小窦卵泡数,而且其在预测妊娠结局方面的作用也明显优于FSH。AMH水平可以反映卵泡池内卵泡的数量,可以作为卵巢储备功能的评价指标,这一点已得到广泛认可。但AMH在妊娠结局预测方面的作用还存在诸多争议,其对ART的预测价值尚值得进一步研究。
有研究认为,AMH可能会引起PCOS患者颗粒细胞芳香化酶表达受抑制,雄激素无法转化生成雌激素,从而导致雄激素水平升高 [9] 。Jacob等 [10] 的研究表明,雄激素水平高的PCOS患者的AMH浓度要高于雄激素水平正常的PCOS患者的AMH浓度,且AMH水平和雄激素呈正相关。本研究结果也显示,高AMH组的雄激素水平也较高,并且3组之间差异有统计学意义。Wiweko 等 [11] 提出,AMH与LH水平呈正相关。另外,有文献报道,LH可以促进PCOS患者的AMH mRNA的表达 [12] 。本研究结果显示,高AMH组的LH水平和LH/FSH也较高,并且3组之间差异有统计学意义, AMH值与LH、LH/FSH、T值呈正相关。这些结果均表明PCOS患者AMH水平升高与其促性腺激素和性激素分泌紊乱有一定的相关性。LH水平升高和(或)LH/FSH值升高会诱使卵泡膜合成较多的雄激素,较多的窦卵泡被募集,最终导致卵泡发育成熟障碍或闭锁。另外,LH可能会协同雄激素刺激卵泡颗粒细胞产生AMH,反过来,AMH也可以促进雄激素作用于原始卵泡和颗粒细胞以促进其生长分化。
Moro 等 [13] 评估了进行IUI治疗患者的AMH水平和窦卵泡计数对妊娠结局的预测价值,认为AMH可以被用来预测IUI的妊娠结局。Wang 等 [14] 的研究显示,AMH是IUI妊娠结局的独立影响因素,高AMH水平与低妊娠失败风险相关。Dondik 等 [15] 研究发现,行IUI治疗的患者,其血清AMH水平在临床妊娠的妇女中明显升高,但是AMH的预测价值并不比其他的卵巢储备定量指标更好。Bakas 等 [16] 对控制性促排卵后实施IUI治疗的患者进行研究,结果显示血清AMH水平与临床妊娠率呈正相关,且AMH水平在临床妊娠和活产方面的预测能力优于LH,但是尚不能将AMH作为预测妊娠结局的唯一因素。另外,也有文献报道,血清AMH水平与体外受精妊娠率呈正相关 [17] 。近期有研究显示,对于行体外受精或卵胞浆内单精子注射的PCOS患者来说,AMH与窦卵泡数、获卵数、可利用胚胎数和优质胚胎数呈正相关,但是AMH对其妊娠结局无预测价值 [18] 。本研究对AMH与PCOS患者实施IUI治疗结局的关系进行了研究,发现高AMH组的妊娠率较低,低AMH组的妊娠率较高,但3组间的妊娠率差异无统计学意义。说明AMH水平对IUI的妊娠结局预测价值有限,但是其水平过高还是会降低妊娠率。此结果与非PCOS患者AMH对妊娠结局的影响是不同的。究其原因,可能是PCOS患者的AMH水平升高程度与卵巢中卵泡形成和颗粒细胞功能受损程度相关。
综上所述,高AMH水平的PCOS患者,同时也存在高LH、T和LH/FSH,且AMH值与LH、LH/FSH、T值呈正相关,此内分泌状态可以抑制其卵泡的发育和募集,从而引起排卵障碍。另外,AMH水平对PCOS患者进行IUI治疗的妊娠结局预测价值有限,但是其水平过高还是会降低妊娠率。基于此结果,在今后对PCOS的诊疗中,可以先调解其内分泌状态,包括AMH、LH、T等,再实施促排卵及ART治疗,这样可以改善PCOS患者的妊娠结局。
[参考文献]
[1] Lathi RB,Dahan MH,Reynolds-May MF,et al. The role of serum testosterone in early pregnancy outcome:a comparison in women with and without polycystic ovary syndrome[J]. J Obstet Gynaecol Can,2014,36(9):811-816.
[2] Tian X,Ruan X,Mueck AO,et al. Anti-Müllerian hormone levels in women with polycystic ovarian syndrome compared with normal women of reproductive age in China[J]. Gynecol Endocrinol,2014,30(2):126-129.
[3] Iwase A,Nakamura T,Osuka S,et al. Anti-Müllerian hormone as a marker of ovarian reserve:what have we learned,and what should we know?[J]. Reprod Med Biol,2015,15(3):127-136.
[4] Yao K, Bian C, Zhao X. Association of polycystic ovary syndrome with metabolic syndrome and gestational diabetes:aggravated complication of pregnancy[J]. Exp Ther Med,2017,14(2):1271-1276.
[5] Kruszy  ska A, Sowi
ska A, Sowi  ska-Srzednicka J. Anti-Müllerian hormone (AMH) as a good predictor of time of menopause[J]. Prz Menopauzalny,2017,16(2):47-50.
ska-Srzednicka J. Anti-Müllerian hormone (AMH) as a good predictor of time of menopause[J]. Prz Menopauzalny,2017,16(2):47-50.
[6] 赵敏英,孙东霞,刘盼,等.35~40岁多囊卵巢综合征患者卵巢功能评估[J].河北医科大学学报,2016,37(7):841-843.
[7] 何艺磊,李蓉,乔杰.抗苗勒氏管激素与卵巢储备及反应性相关研究进展[J].生殖与避孕,2016,36(8):653-659.
[8] Garg D,Tal R. The role of AMH in the pathophysiology of polycystic ovarian syndrome[J]. Reprod Biomed Online,2016,33(1):15-28.
[9] Leader B,Baker VL. Maximizing the clinical utility of antimüllerian hormone testing in women′s health[J]. Curr Opin Obstet Gynecol,2014, 26(4):226-236.
[10] Jacob SL,Field HP,Calder N,et al. Anti-Müllerian hormone reflects the severity of polycystic ovary syndrome[J]. Clin Endocrinol(Oxf),2017,86(3):395-400.
[11] Wiweko B,Maidarti M,Priangga MD,et al. Anti-Mullerian hormone as a diagnostic and prognostic tool for PCOS patients[J]. J Assist Reprod Genet,2014,31(10):1311-1316.
[12] Pierre A, Peigné M, Grynberg M,et al. Loss of LH-induced down-regulation of anti-Müllerian hormone receptor expression may contribute to anovulation in women with polycystic ovary syndrome[J]. Hum Reprod,2013,28(3):762-769.
[13] Moro F,Tropea A,Scarinci E,et al. Anti-Mullerian hormone concentrations and antral follicle counts for the prediction of pregnancy outcomes after intrauterine insemination[J]. Int J Gynaecol Obstet,2016,133(1):64-68.
[14] Wang MH,Chen CH,Wang CW,et al. A higher anti-Müllerian hormone level is associated with an increased chance of pregnancy in patients undergoing controlled ovarian stimulation and intrauterine insemination[J]. J Obstet Gynaecol,2015,35(1):64-68.
[15] Dondik Y,Virji N,Butler TS,et al. The Value of Anti-Müllerian Hormone in Predicting Clinical Pregnancy After Intrauterine Insemination[J]. J Obstet Gynaecol Can,2017,39(10):880-885.
[16] Bakas P,Boutas I,Creatsa M,et al. Can anti-Mullerian hormone (AMH) predict the outcome of intrauterine insemination with controlled ovarian stimulation?[J]. Gynecol Endocrinol,2015,31(10):765-768.
[17] Bolat SE,Ozdemirci S,Kasapoglu T,et al. The effect of serum and follicular fluid anti-Mullerian hormone level on the number of oocytes retrieved and rate of fertilization and clinical pregnancy [J]. North Clin Istanb,2016,3(2):90-96.
[18] 李轶,谭嘉琦,麦卓瑶,等.抗苗勒管激素水平对多囊卵巢综合征辅助生殖治疗结局的预测价值[J].中华妇产科杂志,2018,53(1):23-30.
LIU Pan, GUO LI-na, ZHAO Min-ying
( Department of Reproductive Medicine , the First Hospital of Shijiazhuang , Hebei Province , Shijiazhuang 050011, China )
[ Abstract ] Objective To evaluate the effect of endocrine status on success rate of intrauterine insemination (IUI)in patients with polycystic ovary syndrome(PCOS). Methods The clinical data of polycystic ovary syndrome patients who was implemented intrauterine insemination by husband in reproductive medicine department were collected, with 180 cycles. It was divided into three groups according to the anti-mullerian hormone (AMH) value. In group 1,AMH values were equeal to or less than 16.32 pmol/L(25 th percentile). In group 2, AMH values were more than 16.32 pmol/L,but equeal to or less than 29.35 pmol/L. In group 3,AMH values were more than 29.35 pmol/L(75 th percentile). The value of luteinizing hormone (LH), luteinizing hormone/follicle-stimulating hormone(LH/FSH) and testosterone(T) and pregnancy rate were compared in each group. Results There was no significant difference in age, body mass index (BMI) and infertility among the three groups( P >0.05).The values of LH, LH/FSH and T in group 2 and 3 were higher than those in group 1, and the values of LH, LH/FSH and T in group 3 were higher than those in group 2, the difference were all statistically significant( P <0.05). The AMH value of PCOS patients was positively correlated with the value of LH, LH/FSH and T. The pregnancy rate of group 1 was 24.4%. The pregnancy rate of group 2 was 14.4%. The pregnancy rate of group 3 was 8.9%.There was no significant difference in the pregnancy rate among the three groups( P >0.05). Conclusion High AMH levels of PCOS patients also have high LH, T and LH/FSH. The level of AMH is limited in predicting the pregnancy outcome of PCOS patients treated with IUI, but its high level will reduce the pregnancy rate.
[ Key words ] polycystic ovary syndrome; insemination, artificial; pregnancy outcome
[作者简介] 刘盼(1983-),女,河北藁城人,河北省石家庄市第一医院主治医师,医学硕士,从事生殖医学研究。
[基金项目] 河北省科技计划项目(152777192)
[修回日期] 2018-08-09
[收稿日期] 2018-06-28;
[文章编号] 1007-3205(2018)10-1185-05
[文献标志码] A
[ 中图分类号 ] R711.75
doi: 10.3969/j.issn.1007-3205.2018.10.016
(本文编辑:许卓文)