·论著·
仝宇红1,杨 茜2,尹 默2,沈佳程3,王恩平2,钱雪松4*
(1.河北省石家庄市第一医院感染管理控制处,河北 石家庄 050011;2.河北医科大学公共卫生学院预防医学2014级,河北 石家庄 050017;3.河北医科大学基础医学院临床医学2014级,河北 石家庄 050017;4.河北医科大学基础医学院免疫学教研室,河北 石家庄 050017)
[摘要]目的探讨细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路对凋亡细胞抑制脂多糖(lipopolysaccharides,LPS)诱导巨噬细胞分泌炎症性趋化因子5(CC cehemokine ligand 5,CCL5)的影响。方法用Jurakt细胞制备凋亡细胞,并用流式细胞仪检测细胞凋亡率。用LPS刺激骨髓诱导巨噬细胞(bone marrow induced macrophages,BMDM)和RAW264.7细胞,观察凋亡细胞对LPS诱导的CCL5表达的影响。观察ERK通路在凋亡细胞抑制CCL5表达中的作用,用对照质粒PcDNA3.1、MEKK2/3和MEK5质粒转染RAW264.7细胞,分别以LPS(1 mg/L)、凋亡细胞(apo)和LPS(1mg/L)+apo作用RAW细胞6 h,收集细胞,实时定量PCR技术检测CCL5 mRNA表达。阻断ERK通路,观察CCL5 mRNA表达量的变化。结果LPS刺激组和LPS+凋亡细胞刺激组CCL5 mRNA表达明显高于空白组和凋亡细胞刺激组,LPS+凋亡细胞刺激组CCL5 mRNA表达明显低于LPS刺激组(P<0.05)。PD98059 5 mmoL/L、10 mmoL/L、20 mmoL/L组mCCL5 mRNA表达低于DMSO组,PD98059 10 mmoL/L、20 mmoL/L组mCCL5 RNA表达低于PD98059 5 mmoL/L组,PD98059 20 mmoL/L组CCL5 mRNA表达低于PD98059 10 mmoL/L组(P<0.05)。PcDNA3.1转染组、MEKK2/3转染组和MEK5转染组CCL5 mRNA水平明显高于对照组,MEKK2/3转染组和MEK5转染组CCL5 mRNA水平明显高于PcDNA3.1转染组,MEK5转染组CCL5 mRNA水平明显高于MEKK2/3转染组(P<0.05)。D98059组CCL5 mRNA衰变速度快于空白组(P<0.05)。结论凋亡细胞能够抑制LPS诱导的CCL5表达,ERK通路在凋亡细胞抑制CCL5表达中发挥重要作用。
[关键词]炎症趋化因子类;脂多糖;细胞外调节蛋白激酶通路 doi:10.3969/j.issn.1007-3205.2018.11.002
细胞凋亡在维持机体内环境稳定中至关重要,尤其在机体清除有害的细胞和无作用的细胞等方面发挥着重要的作用[1]。凋亡细胞的识别和清除通常会促进抗炎反应和免疫耐受,从而与多种炎性疾病和自身免疫病相关。研究发现,抗原提呈细胞(如巨噬细胞等)吞噬凋亡细胞的过程中会调控其细胞因子的表达水平[2],且这些细胞因子表达水平与许多疾病相关,如炎症性趋化因子5(CC chemokine ligand 5,CCL5)可以促进乳腺癌的侵袭和转移[3-4],并被证实为肿瘤转移的重要因素[5]。然而,关于凋亡细胞对巨噬细胞分泌CCL5调控的机制尚未阐明。CCL5是趋化因子家族的一员,在单核细胞分化为巨噬细胞时,CCL5起调控巨噬细胞的表型和功能的作用[6]。本研究用Jurkat细胞系制备了凋亡细胞,在mRNA水平上研究了凋亡细胞对脂多糖(lipopolysaccharides,LPS)诱导的巨噬细胞分泌CCL5的影响。另外,通过阻断细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路关键分子MEKK2/3和MEK5,探索了凋亡细胞影响LPS诱导的巨噬细胞分泌CCL5的机制。
1.1材料 小鼠腹腔巨噬细胞系RAW264.7和Jurkat细胞系由河北医科大学免疫学教研室保存。已构建好的PcDN3.1、MEKK2/3、MEK5质粒冻存于河北医科大学免疫学教研室的。星形孢菌素(Staurosporine)购于Wako公司,胎牛血清来自美国Ex CellBiology公司,SYBR-Premix ExaqTM、TrizolTM Reagent核酸分离试剂购于日本TaKaRa公司,RealTime PCR引物由上海生工合成,Annexin-V-Biotin凋亡检测试剂盒购于美国Biovision公司,M-MLV逆转录酶购于美国Invitrogen公司。
1.2方法
1.2.1骨髓诱导的巨噬细胞(bone marrow induced macrophages,BMDM)、RAW264.7和Jurkat细胞的培养 BMDM用B6小鼠股骨骨髓细胞诱导,使用L细胞培养液培养1周后,贴壁细胞即为BMDM。诱导成功后,BMDM、RAW264.7和Jurkat细胞均使用含10%胎牛血清的RPMI-1640培养。
1.2.2凋亡细胞的制备 将Jurkat细胞分为2组:一组用终浓度为0.1 mmol/L的星形孢菌素处理细胞6 h和24 h;另一组用6 000 Rad X射线照射,处理6 h和24 h,分别收集细胞。
1.2.3凋亡细胞的检测 分别取培养状态良好的经星形孢菌素处理6 h和24 h、6 000 Rad X射线处理6 h和24 h,以及未经处理的 Jurkat细胞100 μL,加入到已经标记好的Falcon管中,之后于管中分别加入5 μL碘化丙啶和5 μL依赖性磷脂结合蛋白轻轻混匀,避光染色15 min,然后使用流式细胞仪检测细胞凋亡。
1.2.4小鼠腹腔巨噬细胞RNA收集 LPS及凋亡细胞刺激巨噬细胞,LPS及凋亡细胞刺激小鼠腹腔巨噬细胞,小鼠腹腔巨噬细胞和RAW264.7细胞接种于6孔板后过夜培养,第2天观察细胞生长状态,如果细胞状态良好,将细胞培养液换成无血清的DMEM,分别以空白组、凋亡细胞、LPS(1 mg/L)和LPS(1 mg/L)+凋亡细胞刺激小鼠腹腔巨噬细胞6 h后收集小鼠腹腔巨噬细胞RNA。
1.2.5SYBR Green荧光染料法实时定量PCR检测CCL5 mRNA的表达 PCR扩增引物。CCL5:sense,5′-GATGGACATAGAGGACACAACT-3′,antisense,5′-TGGGACGGCAGATCTGAGGG-3′;GAPDH:sense,5′-AACTTTGGCATTGTGGAA-GG-3′,antisense,5′-ACACATTGGGGGTAGGA-ACA-3′。
1.2.6ERK通路阻断实验 6孔板中培养的RAW264.7细胞分别加入DMSO、PD98059(溶于DMSO)5 mmol/L、PD98059 10 mmol/L、PD98059 20 mmol/L作用30min,然后用LPS(1 mg/L)作用1 h,提取RNA用实时定量PCR检测CCL5 mRNA的表达。
1.2.7ERK通路强化实验 将生长状态良好的细胞RAW264.7置于24孔板,24 h后使用Lipofectamine 2000分别转染空白质粒(PcDNA3.1)、MEKK2/3和MEK5质粒。转染方法参考Invitrogen公司说明书。将转染后的细胞分别以LPS(1 mg/L)作用6 h后收集细胞mRNA。
1.2.8CCL5 mRNA衰变实验 取RAW264.7细胞,分为2组,一组加入PD98059 5 mmol/L,另一组不加,用LPS激活,活化后收集0,30,60,120 min时间点各孔细胞。取RAW264.7细胞分2组,一组加入PD98059 5 mmol/L,另一组不加入,用apo+LPS激活,活化后收集0,30,60,120 min时间点各孔细胞。实时定量PCR检测上述各组CCL5 mRNA表达。
1.3统计学方法 应用SPSS 18.0统计软件分析数据。计量资料比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
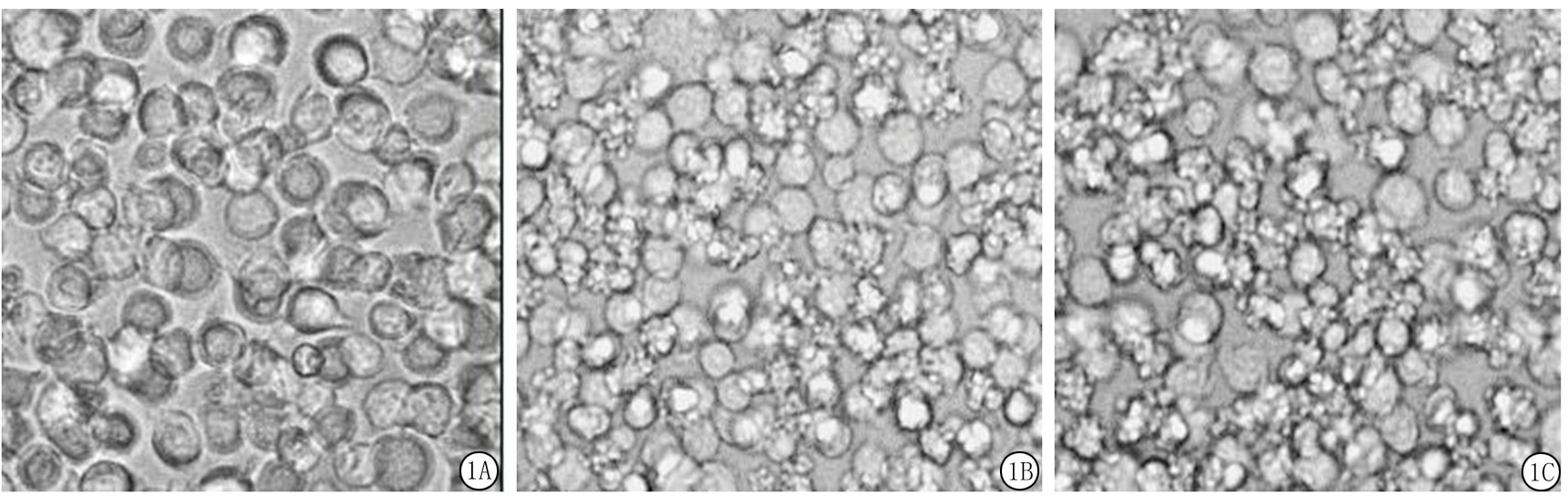
2.1凋亡细胞的制备 经6 000 Rad X线照射或星形孢菌素作用6 h后,光镜下的Jurkat细胞明显可见凋亡小体(图1)。经流式细胞术检测,右下象限为早期凋亡细胞[FITC(+)/PI(-)]。无刺激时,凋亡细胞数量很少。6 000 Rad X射线照射6 h和24 h的早期凋亡率分别为(43.6±3.2)%和(21.35±4.1)%;星形孢菌素处理6 h和24 h的细胞凋亡率分别为(54.9±2.8)%和(14.7±3.4)%(图2)。综合实验条件及成本,最终选用星形孢菌素处理6 h的Jurkat细胞。

图1光镜下Jurkat细胞形态(×40)
A.正常Jurkat细胞未见凋亡细胞;B.经6 000 Rad X射线照射6 h后可见大量凋亡细胞;C.经星形孢菌素处理6 h后可见大量凋亡细胞
Figure1MorphologyofJurkatcellsunderlightmicroscope( ×40)
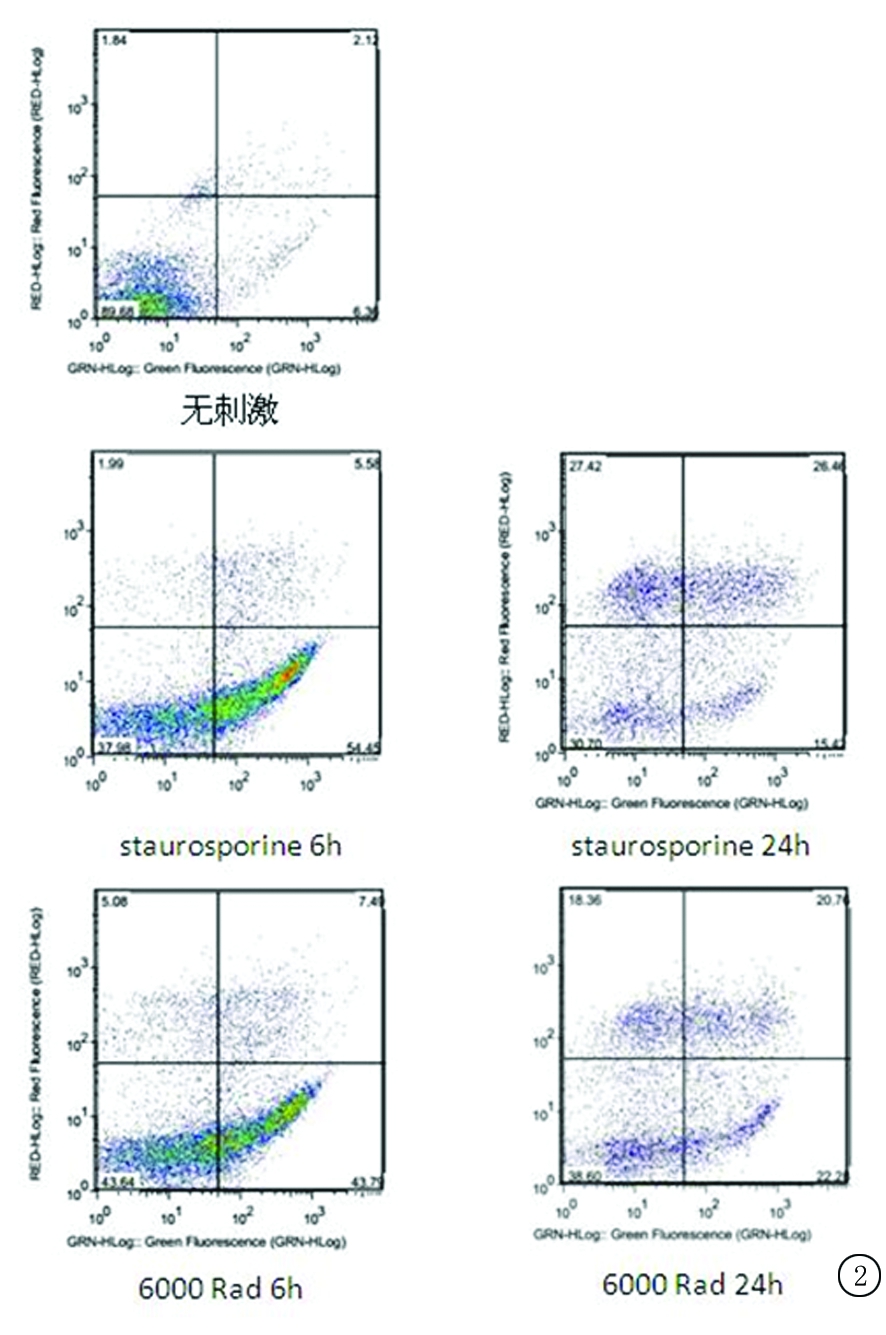
图2X射线与星形孢菌素诱导细胞凋亡
Figure2X-raysorstaurosporineinducedcellapoptosisinJurkatcells
2.2凋亡细胞在BMDM抑制LPS诱导的CCL5 mRNA的表达 实时定量PCR检测CCL5 mRNA表达情况,LPS刺激组和LPS+凋亡细胞刺激组CCL5 mRNA表达明显高于空白组和凋亡细胞刺激组,LPS+凋亡细胞刺激组CCL5 mRNA表达明显低于LPS刺激组,差异均有统计学意义(P<0.05),见表1。
表1不同刺激后BMDM细胞中CCL5mRNA表达比较
Table1ComparisonofCCL5mRNAexpressioninBMDMcellsafterdifferentstimulation(n=3,![]() ±s)
±s)
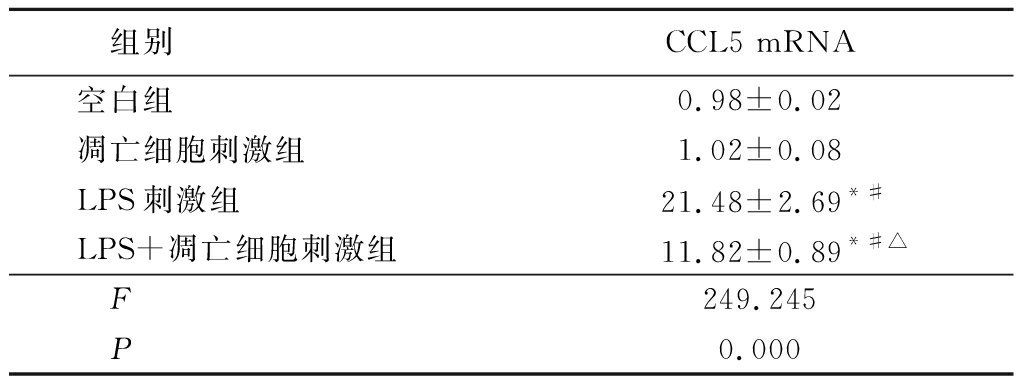
*P<0.05与空白组比较 #P<0.05与凋亡细胞刺激组比较 △P<0.05与LPS刺激组比较(SNK-q检验)
2.3阻断ERK通路后CCL5 mRNA的表达 将RAW细胞分4组,分别加入DMSO及PD98059 5 mmoL/L、10 mmoL/L、20 mmoL/L,随后再用med或LPS刺激。结果显示,PD98059 5 mmoL/L、10 mmoL/L、20 mmoL/L组CCL5 mRNA表达低于DMSO组,PD98059 10 mmoL/L、20 mmoL/L组CCL5 mRNA表达低于PD98059 5 mmoL/L组,PD98059 20 mmoL/L组CCL5 mRNA表达低于PD98059 10 mmoL/L组,差异均有统计学意义(P<0.05),见表2。
表2阻断ERK通路后CCL5mRNA表达比较
Table2ComparisonofCCL5mRNAexpressionafterblockingERKpathway(n=3,![]() ±s)
±s)

*P<0.05与DMSO组比较 #P<0.05与PD98059 5 mmoL/L组比较 △P<0.05与PD98059 10 mmoL/L组比较(SNK-q检验)
2.4强化ERK通路后mCCL5 mRNA的表达 分别用PcDNA3.1对照质粒、MEKK2/3、MEK5质粒转染RAW细胞使其高表达,随后用LPS刺激,结果显示,PcDNA3.1转染组、MEKK2/3转染组和MEK5转染组CCL5 mRNA水平明显高于对照组,MEKK2/3转染组和MEK5转染组CCL5 mRNA水平明显高于PcDNA3.1转染组,MEK5转染组CCL5 mRNA水平明显高于MEKK2/3转染组,差异均有统计学意义(P<0.05),见表3。
表3RAW细胞强化ERK通路后CCL5mRNA水平比较
Table3ComparisonofCCL5mRNAlevelsafterRAWcellsenhanceERKpathway(n=3,![]() ±s)
±s)

*P<0.05 与对照组比较 #P<0.05与PcDNA3.1转染组比较 △P<0.05与MEKK2/3转染组比较(SNK-q检验)
2.5凋亡细胞对CCL5的抑制作用与ERK信号通路 在LPS+apo活化的RAW细胞中加入转录抑制剂ACD和DRB,在确保没有新的RNA合成的情况下,一组加PD98059 20 mmoL/L,一组不加,在0,30,60,120 min检测CCL5 mRNA水平并绘制曲线,结果显示PD98059组CCL5 mRNA衰变速度快于空白组(P<0.05),见图3。
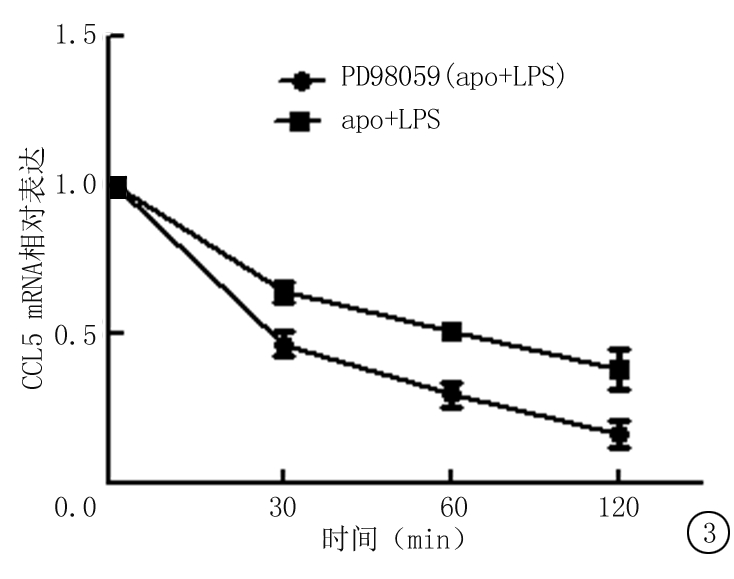
图32组CCL5mRNA衰变速度比较
Figure3Comparisonofdecayratesbetween2setsofCCL5mRNA
细胞凋亡在维持体内细胞数量动态平衡和人体正常发育起到重要作用。本研究首先制备凋亡细胞,细胞凋亡后在光学显微镜下可以发现染色质发生凝缩,细胞质起泡,形成凋亡小体,凋亡小体可以被吞噬细胞吞噬,在体内细胞凋亡后会被组织内的专职吞噬细胞或相邻的非专职吞噬细胞清除[7],且与机体稳态的维持和疾病的发生发展关系密切[8]。为了进一步证实细胞凋亡的情况,本研究采用流式细胞技术检测了细胞凋亡率,结果显示射线和星形孢菌素均可以诱导细胞凋亡,但是时间过长会有大量细胞坏死,所以选择处理6 h的细胞,因为此时间段有较多的凋亡细胞。有研究显示凋亡细胞清除障碍与很多疾病发病有关,如在紫外线辐射后皮肤内、系统性红斑狼疮患者的淋巴结及血液中,均发现凋亡细胞增多。巨噬细胞是重要的吞噬凋亡小体的细胞,巨噬细胞在吞噬凋亡细胞的过程中会发生细胞因子的表达水平的变化。本研究关注凋亡细胞对CCL5 mRNA表达的影响。CCL5是趋化因子的一种,趋化因子是一种能够诱导细胞迁移的可溶性小分子蛋白质,在炎症和感染中,趋化因子诱导白细胞迁移的能力尤为突出,并参与变态反应、自身免疫性疾病、人类免疫缺陷病毒感染和肿瘤的形成等调控过程[9]。CCL5在血小板、巨噬细胞、肾小管上皮、滑膜成纤维细胞和一些特定肿瘤细胞均有表达。CCL5可以吸引T细胞等很多与感染相关的细胞移行到炎症和感染部位,在炎症反应中发挥重要作用[10]。除了作为一个强大的化学引诱物,CCL5通过促进Th1细胞的分化和增殖在T细胞应答中发挥重要作用,这些过程包括可以协同干扰素γ激活巨噬细胞、T细胞和NK细胞。因此,CCL5的产生对诱导抗感染免疫反应十分重要。虽然CCL5在抗感染免疫中发挥重要作用,但是细胞因子和趋化因子在抗感染中是一把双刃剑,适当剂量的细胞因子对机体防御感染是有益的,如果过多产生反而对机体是有害的,众所周知细胞因子风暴可以带来严重的后果。当然机体自身有自我调控机制,包括对趋化因子,本研究关注于凋亡细胞对CCL5 mRNA表达的调控,探讨巨噬细胞受到LPS刺激后凋亡细胞对趋化因子CCL5 mRNA表达的影响。
LPS是革兰阴性菌外膜的主要成分,通过与宿主表达的模式识别受体TLR的相互作用,刺激宿主免疫应答。LPS可以激活核因子κB和MAPK家族,MAPK家族至少可分为3个亚族:ERKs、JNK和p38 MAPK。干扰素γ、LPS和(或)TNF-α激活巨噬细胞,诱导M1极化,促进促炎细胞因子的产生,产生活性氧,诱导诱导型一氧化氮合酶[11]。另一方面,Th2细胞因子导致巨噬细胞M2极化并产生相应的趋化因子和细胞因子[12]。巨噬细胞是机体内一种重要的免疫细胞,在LPS作用下对CCL5分泌是否有影响以及凋亡细胞对CCL5分泌的影响引起了研究者的兴趣。本研究采用BMDM和RAW264.7细胞。BMDM细胞虽更接近于原代细胞,但建立细胞系较难,BMDM和RAW264.7细胞有类似的反应,所以后期机制研究采用RAW264.7细胞完成。用凋亡细胞刺激BMDM后,对比对照组,CCL5 mRNA表达没有明显升高,用LPS刺激后,CCL5 mRNA表达明显升高,而LPS+凋亡细胞刺激组mCCL5 mRNA表达水平低于LPS刺激组。由此发现,凋亡细胞能够有效抑制LPS诱导巨噬细胞CCL5的表达。
对机制探讨的研究发现,MAPK信号通路与CCL5的分泌有密切关系,其中ERK通路显示很强的相关性。阻断ERK通路发现LPS刺激后的RAW264.7中CCL5 mRNA表达水平明显降低,而在上调ERK通路中MEKK2/3和MEK5后,CCL5 mRNA水平明显升高,这充分说明了ERK通路与CCL5分泌的密切关系。为了进一步验证此结论,对LPS+凋亡细胞刺激组细胞进行衰变实验,其中加入阻断剂的PD98059组CCL5 mRNA衰变速度更快,表明抑制ERK通路会抑制CCL5的表达。
综上所述,凋亡细胞能够抑制LPS对CCL5的诱导,且这种抑制作用可能是通过ERK通路实现的。
[参考文献]
[1] PoonI K,Lucas CD,Rossi AG,et al. Apoptotic cell clearance: basic biology and therapeutic potential[J]. Nat Rev Immunol,2014,14(3):166-180.
[2] Ch vez-Gal
vez-Gal n L,Vesin D,Martinvalet D,et al. Low dose BCG infection as a model for macrophage activation maintaining cell viability[J]. J Immunol Res,2016,2016:4048235.
n L,Vesin D,Martinvalet D,et al. Low dose BCG infection as a model for macrophage activation maintaining cell viability[J]. J Immunol Res,2016,2016:4048235.
[3] Khalid A,WolframJ,Mu CF,et al. Recent advances in discovering the role of CCL5 in metastatic breast cancer[J]. Mini Rev Med Chem,2015,15(13):1063-1072.
[4] Svensson S,Abrahamsson A,Rodriguez GV,et al. CCL2 and CCL5 Are Novel Therapeutic Targets for Estrogen-Dependent Breast Cancer[J]. Clin Cancer Res,2015,21(16):3794-3805.
[5] Wang LH,Lin CY,Liu SC,et al. CCL5 promotes VEGF-C production and induces lymphangiogenesis by suppressing miR-507 in human chondrosarcoma cells[J]. Oncotarget,2016,7(24):36896-36908.
[6] Hussen J,FrankC,Düvel A,et al. The chemokine CCL5 induces selective migration of bovine classical monocytes and drives their differentiation into LPS-hyporesponsive macrophages in vitro[J]. Dev Comp Immunol,2014,47(2):169-177.
[7] Pérez-Garijo A,Steller H. Spreading the word:non-autonomous effects of apoptosis during development,regeneration and disease[J]. Development,2015,142(19):3253-3262.
[8] Kawamoto Y,Nakajima YI,Kuranaga E. Apoptosis in Cellular Society: Communication between Apoptotic Cells and Their Neighbors[J]. Int J Mol Sci,2016,17(12): E2144.
[9] Marques RE,Guabiraba R,Russo RC,et al. Targeting CCL5 in inflammation[J]. Expert Opin Ther Targets,2013,17(12):1439-1460.
[10] Zi J,Yuan SS,Qiao JL,et al. Treatment with the C-C chemokine receptor type 5(CCR5)-inhibitor maraviroc suppresses growth and induces apoptosis of acute lymphoblastic leukemia cells[J]. Am J Cancer Res,2017,7(4):869-880.
[11] Chen L,Sha ML,Li D,et al. Relaxin abrogates renal interstitial fibrosis by regulating macrophage polarization via inhibition of Toll-like receptor 4 signaling[J]. Oncotarget,2017,8(13):21044-21053.
[12] Almatroodi SA,McDonald CF,Darby IA,et al. Characterization of M1/M2 tumour-associated macrophages(TAMs) and Th1/Th2 cytokine profiles in patients with NSCLC[J]. Cancer Microenviron,2016,9(1):1-11.
TONG Yu-hong1, YANG Xi2, YIN Mo2, SHEN Jia-cheng3, WANG En-ping2, QIAN Xue-song4*
(1.DepartmentofNosocomialInfectionManagement,theFirstHospitalofShijiazhuang,HebeiProvince,Shijiazhuang050011,China; 2.PreventiveMedicineGrade2014,SchoolofPublicHealth,HebeiMedicalUniversity,Shijiazhuang050017,China; 3.ClinicalMedicineGrade2014,SchoolofBasicMedicalSciences,HebeiMedicalUniversity,Shijiazhuang050017,China; 4.DepartmentofImmunology,SchoolofBasicMedicalSciences,HebeiMedicalUniversity,Shijiazhuang050017,China)
[Abstract]ObjectiveTo investigate the effect of extracellular regulated protein kinases(ERK) pathway on apoptotic cells inhibiting lipopolysaccharides(LPS) induced inflammatory CC chemokine ligand 5(CCL5) secreted by macrophages.MethodsApoptotic cells were prepared by Jurakt cells and the apoptosis rate was detected by flow cytometry. Bone marrow induced macrophages(BMDM) and RAW264.7 cells were stimulated by LPS to observe the effect of apoptotic cells on the expression of CCL5 induced by LPS. To observe the role of ERK pathway in inhibiting CCL5 expression in apoptotic cells, RAW264.7 cells were transfected with control plasmids PcDNA3.1, MEKK2/3 and MEK5. The cells were treated with LPS(1 mg/L), apoptotic cells(apo) and LPS(1 mg/L) + apo for 6 hours respectively. The expression of CCL5 mRNA was detected by real-time quantitative PCR. The ERK pathway was blocked and the expression of CCL5 mRNA was observed.ResultsThe expression of CCL5 mRNA in LPS stimulation group and LPS + apoptotic cell stimulation group was significantly higher than that in blank group and apoptotic cell stimulation group. The expression of CCL5 mRNA in LPS + apoptotic cell stimulation group was significantly lower than that in LPS stimulation group(P<0.05). The expression of CCL5 mRNA in PD98059 5 mmoL/L, 10 mmoL/L, 20 mmoL/L group was lower than that in DMSO group, the expression of CCL5 mRNA in PD98059 10 mmoL/L, 20 mmoL/L group was lower than that in PD98059 5 mmoL/L group, and the expression of CCL5 mRNA in PD98059 20 mmoL/L group was lower than that in PD98059 10 mmoL/L group(P<0.05). CCL5 mRNA levels in PcDNA3.1 transfection group, MEKK2/3 transfection group and MEK5 transfection group were significantly higher than those in control group, MEKK2/3 transfection group and MEK5 transfection group were significantly higher than those in PcDNA3.1 transfection group, and CCL5 mRNA levels in MEK5 transfection group were significantly higher than those in MEKK2/3 transfection group(P<0.05). The decay rate of CCL5 mRNA in group D98059 was faster than that in blank group(P<0.05).ConclusionApoptotic cells can inhibit the expression of CCL5 induced by LPS, and ERK signaling pathway plays an important role in the inhibition of CCL5 expression by apoptotic cells.
[Keywords]chemokines; lipopolysaccharides; extracellular regulated protein kinases pathway
*通讯作者。E-mail:1979373483@qq.com
[作者简介]仝宇红(1970-),女,河北无极人, 河北省石家庄市第一医院副主任医师,医学博士,从事医院感染研究。
[基金项目]河北省留学人员科技活动资助项目(2014003031);河北省科技计划项目(17397744D)
[修回日期]2018-04-16
[收稿日期]2018-03-22;
[文章编号]1007-3205(2018)11-1244-06
[文献标志码]A
[中图分类号]R392.11
(本文编辑:赵丽洁)