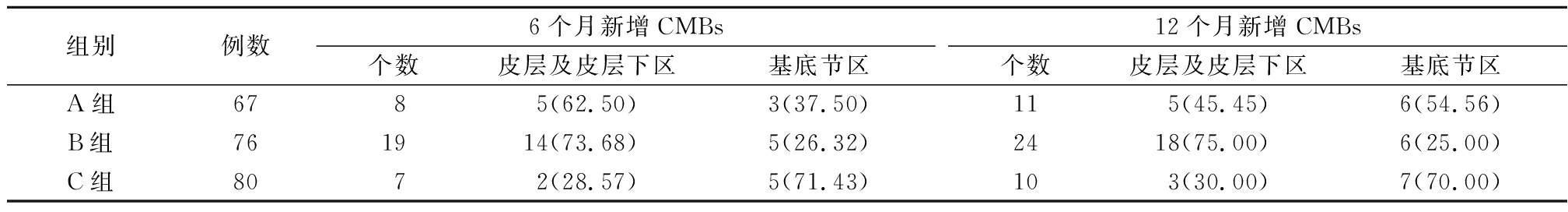
表1CMBs影像学分布
Table1ImagingdistributionofCMBs(个数,%)
张 军1,赵 娴2*,曹献国1,宋 哲1,刘惠钦1
(1.河北省石家庄市第一医院神经内科,河北 石家庄 050011;2. 河北省石家庄市第一医院眼科,河北 石家庄 050011)
[摘要]目的探讨缺血性脑卒中患者颈动脉支架成形术(carotid angioplasty and stenting,CAS)后脑微出血(cerebral microbleeds,CMBs)的变化情况。方法选取颈动脉血管狭窄≥70%的缺血性脑卒中患者67例作为A组,经数字减影血管造影(digital subtraction angiography,DSA)检查符合介入治疗指征,行CAS治疗;选取颈动脉血管狭窄≥70%的缺血性脑卒中患者76例作为B组,未经CAS治疗;选取血管狭窄程度<50%的缺血性脑卒中患者80例作为C组。应用3.0 T Philips磁共振成像(magnetic resonance imaging,MRI)行磁敏感加权成像(susceptibility weighted imaging, SWI)扫描,计数6个月及12个月时新增CMBs数目。结果6个月时,A组新增8个CMBs(11.94%),B组新增19个CMBs(25.00%),C新增7个CMBs (8.75%),A组与B组、B组与C组比较差异均有统计学意义(P<0.05)。12个月时,A组新增11个CMBs(16.42%),B组新增24个CMBs(31.58%),C组新增10个(12.50%),A组与B组、B组与C组比较差异均有统计学意义(P<0.05)。结论颈动脉狭窄程度≥70%的缺血性脑卒中患者经CAS治疗后,远期新增CMBs数目能够达到血管狭窄<50%患者水平,可在一定程度上改善缺血性脑卒中患者的预后。
[关键词]颈动脉狭窄;介入治疗;脑微出血 doi:10.3969/j.issn.1007-3205.2018.11.004
缺血性脑卒中是全球中老年患者的主要死亡原因之一,可导致严重长期残疾,明显影响患者生活质量[1-2]。颈动脉狭窄是导致缺血性脑卒中的重要原因,所致脑组织低灌注是造成脑缺血的重要机制[3]。颈动脉支架成形术(carotid artery stenting,CAS)是目前治疗颈动脉狭窄的重要手段,其有效性及安全性已得到临床普遍认可[4-5]。脑微出血(cerebral microbleeds,CMBs)被认为与脑梗死、痴呆及脑出血等高度相关,并可预测缺血性脑卒中的复发及脑梗死的出血转化等,已成为研究热点之一[6]。本研究旨在探讨颈动脉血管狭窄≥70%的缺血性脑卒中患者介入治疗对CMBs的影响,以了解远期缺血性脑血管病的复发及出血转化情况。
1.1一般资料 选取2012—2018年我院收治的年龄50~75岁、颈动脉血管狭窄≥70%的缺血性脑卒中患者67例,行CAS治疗为A组。选取年龄50~75岁,血管狭窄程度≥70%的缺血性脑卒中患者76例,未行CAS治疗为B组。选取年龄50~75岁、血管狭窄程度<50%缺血性脑卒中患者80例为C组。颈动脉狭窄分级标准:应用Philips血管彩超仪,按北美症状性颈动脉内膜切除试验[7]计算狭窄率,狭窄率(%)=(1-血管最狭窄处的直径/狭窄远端正常颈动脉直径)×100%。
1.2诊断与排除标准 诊断标准:临床确诊缺血性脑卒中,包括短暂性脑缺血发作及脑梗死[头颅磁共振成像(magnetic resonance imaging,MRI)可见新发梗死病灶,脑梗死患者NIHSS评分≤3分];无严重合并症(如心肝肾功能不全、恶性肿瘤等);高血压患者血压控制在140/90 mmHg以下,糖尿病患者糖化血红蛋白≤7.0,血脂控制在正常范围;既往无颅内出血史,无心源性脑栓塞史,无出血倾向患者(血凝检查APTT或PT明显延长);应用磁共振血管成像(magnetic resonance angiography,MRA)或CT血管成像(CT angiography,CTA)检查,符合颈动脉狭窄介入指征并行CAS治疗。排除标准:①颈动脉已经闭塞的患者;②存在肌纤维发育不良及非特异性动脉炎性改变等所致颈动脉狭窄的患者;③既往曾行颅内外动脉旁路移植术、颈动脉支架植入术及颈动脉内膜剥脱术的患者;④伴有心、肺、肾严重疾病及其他器官严重损害的患者;⑤对碘造影剂过敏的患者。
1.3数字减影血管造影(digital subtraction angiography,DSA) 应用DSA仪(德国西门子公司生产的Angio StarPlus),采用改良Seldinger技术,经股动脉穿刺进行DSA,显示其狭窄血管部位、长度及狭窄处直径。
1.4治疗方法 ①术前准备:在行CAS治疗前3 d,予以阿司匹林100 mg,1次/d、氯吡格雷75 mg,1次/d口服。CAS术前6 h禁食、水,术前0.5 h予以苯巴比妥100 mg,阿托品0.5 mg肌内注射。②手术操作:术前在左上肢建立静脉通道(心电、血压及血氧饱和度监测下),2%利多卡因局部麻醉右股动脉穿刺点皮肤,采用Seldinger技术成功穿刺右股动脉后置入8 F动脉鞘,在泥鳅导丝引导下将8 F导引导管放置颈动脉狭窄段近端2~3 cm处,行DSA测量狭窄血管的确切长度和直径,选择合适动脉支架,在路图引导下,将微导丝通过狭窄部位,送至颈内动脉远端并固定位置,沿微导丝将保护伞送至颈内动脉岩段释放保护伞,撤出微导丝;在路图指导下,选用适合球囊沿保护伞指引导丝放置血管狭窄段,透视下对位准确后扩张球囊,扩张满意后立即减压,同时密切观察患者血压、心率变化,回撤球囊输送系统;选用适合支架沿保护伞指引导丝送至狭窄处,透视下对位准确后释放支架,支架释放过程中,避免拉拽保护伞指引导丝,以免保护装置移位,最后撤出保护装置;释放支架后观察5~10 min,再行DSA,治疗后狭窄程度≤30%,若未发生异常则结束手术。③术后观察:术后于神经内科监护病房行多参数监护24 h,监测生命体征变化,重点监测血压和心率,血压需控制在120~140/70~80 mmHg,术后继续双抗治疗(阿司匹林+氯吡格雷)9~12个月。
1.5影像学检查 CMBs在磁敏感加权成像(susceptibility weighted imaging,SWI)扫描上表现为圆形或类圆形、质地均匀一致、周围界限相对清楚的直径2~10 mm病灶,相应部位的T1及T2加权成像上未显示出高信号,是含铁血黄素在小血管周围局部范围的沉积[8]。应用3.0T Philips MIR行SWI扫描,计算颈动脉狭窄或闭塞血管血流分布区内6个月以及12个月新增CMBs数目。
1.6统计学方法 应用SPSS 19.0统计软件分析数据,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2.1影像学分布 6个月时,A组新增CMBs主要分布于皮层及皮层下区,少量可见于基底节区; B组新增CMBs主要分布于皮层及皮层下区,少数见于基底节区;C组新增CMBs主要分布于基底节区。12个月时,A组及C组新增CMBs主要分布于基底节区;B组新增CMBs分布情况与6个月时相似。见表1,图1~4。
表1CMBs影像学分布
Table1ImagingdistributionofCMBs(个数,%)

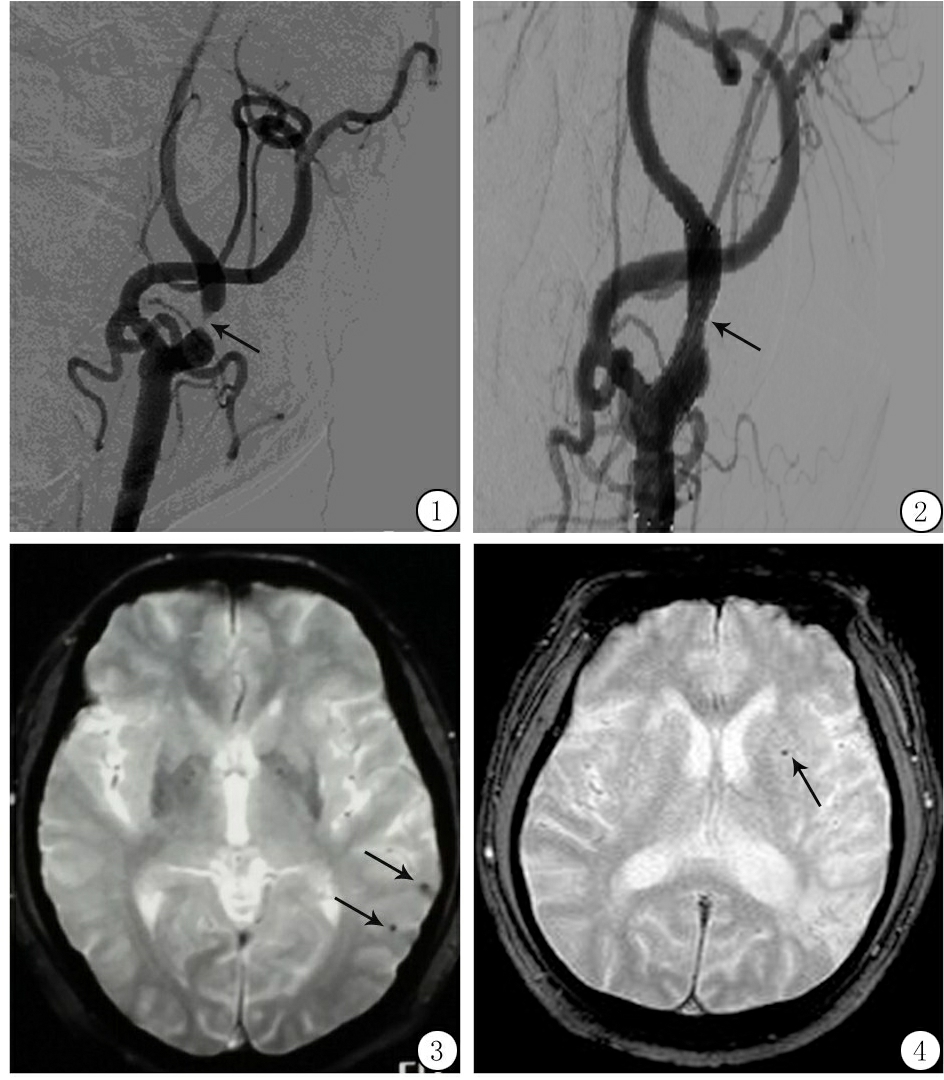
图1CAS治疗前,箭头示颈内动脉开口处重度狭窄
Figure1ThearrowindicatesthestenosisoftheinternalstenosisarteryopengingbeforeCAS
图2CAS治疗后,箭头示颈内动脉狭窄解除
Figure2ThearrowindicatesthereleaseoftheoftheinternalcarotidafterCAS
图3未行CAS治疗患者12个月时新增CMBs
Figure3ThenewCMBsat12monthswithoutCAS
图4经CAS治疗患者12个月时新增CMBs
Figure4ThenewCMBSat12monthsafterCAS
2.2各组新增CMBs数目 6个月时,A组新增CMBs 8个(11.94%),B组新增CMBs 19个(25.00%),C组新增CMBs 7个(8.75%),A组与B组、B组与C组比较差异均有统计学意义(P<0.05),A组与C组比较差异无统计学意义(P>0.05)。12个月时,A组新增CMBs 11个(16.42%),B组新增CMBs 24个(31.58%),C组新增CMBs 10个(12.50%),A组与B组、B组与C组比较差异均有统计学意义(P<0.05)。而A组与C组比较差异无统计学(P>0.05)。见表2。
表2各组新增CMBs数目
Table2NewnumbersofCMBsineachgroup(个数,%)
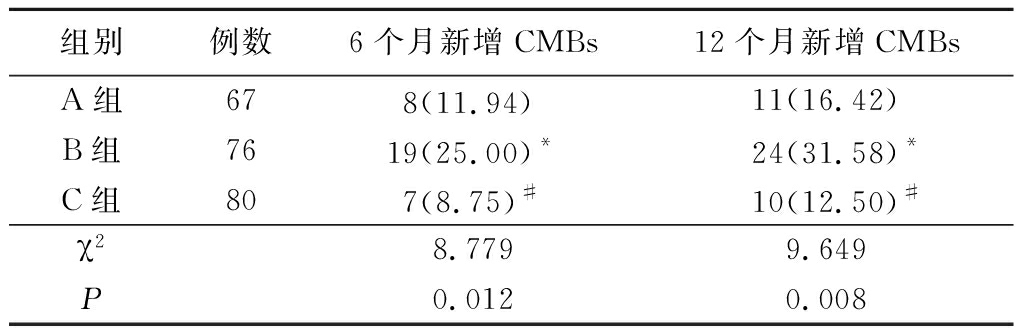
*P<0.05 与A组比较 #P<0.05与B组比较(χ2检验)
颈动脉作为颅脑的主要供血血管,是保证颅内灌注及颅脑正常功能的重要血管之一。有研究指出,缺血性脑卒中与其颈动脉狭窄关系密切[9-10]。颈动脉严重狭窄可导致脑组织低灌注,从而反复出现脑卒中[11],各种神经功能缺损症状严重影响患者生活质量,且有证据表明颈动脉狭窄是血管性认知功能障碍的独立危险因素[12]。因此,尽早解除颈动脉的狭窄,对于改善缺血缺氧状态、减少缺血性脑卒中事件发生有重要意义。对于解除颈动脉狭窄,CAS是目前公认的有效方法,可明显减少因颈动脉狭窄而引发的缺血性脑卒中和脑梗死,降低患者致残、致死率,降低出现血管性认知功能障碍的风险。CMBs是一种脑实质的亚临床损害,主要特点是颅内微小血管病变所致的微小出血[13],CMBs对脑出血的预测、认知功能评估[14]、抗栓药物选择[15]等均有重要意义。故研究CAS治疗狭窄颈动脉后相应颈动脉供血区CMBs的形成情况至关重要。
本研究影像学显示,经CAS治疗后6个月新形成的CMBs主要位于皮层及皮层下区, 12个月时新增CMBs主要分布于基底节区,与颈动脉狭窄<50%患者分布区域相似。考虑经CAS治疗后,原狭窄侧的血流逐步恢复,侧支循环代偿血供的“小马拉大车”现象得到改善,狭窄血管近端微、小动脉的灌注增加,可减缓或停止CMBs的形成进程,远端或末端的微、小动脉供血虽有缓解,但短期内仍有内皮细胞损伤,故远端皮层及皮层下区仍有CMBs形成;后期随着微、小动脉的血供的缓解,血管内皮细胞逐渐修复,血脑屏障功能恢复,新出现的CMBs主要分布于基底节区。这与Shoamanesh等[16]的报道一致。未经CAS治疗的患者,远端或末端的微、小动脉缺血症状始终存在,虽有部分患者能够产生Willis环的前交通动脉和后交通动脉侧支循环的开放,部分患者出现软脑膜侧支吻合血管及其他颅内外动脉分支的吻合穿通颅内外,与狭窄侧皮层动脉相交通,但与CAS治疗组相比,缺血症状始终存在,新增CMBs多出现于微小动脉远端供血的区域——皮层及皮层下区。
CMBs的形成是由于长期慢性脑缺血损害内皮细胞,影响紧密连接蛋白的正常表达,导致血脑屏障通透性明显增加,血液中的蛋白与脂质成分进入血管壁和周围的脑组织,造成微、小动脉血管壁玻璃样变性、周围脑组织神经细胞毒性损害等,使红细胞漏出血管外。有研究显示血流重建对重度颈动脉狭窄患者脑功能损伤有部分逆转作用[17-18],因此通过CAS治疗重建血流有重要意义。CAS治疗后可使狭窄程度恢复至30%以下,随着狭窄程度改善,缺血症状逐渐缓解,能有效减少CMBs形成。理论上CAS治疗后与血管狭窄<50%患者新增CMBs应无明显差别,本研究结果显示,6个月时CAS治疗后新增CMBs数目较血管狭窄<50%患者增多。笔者分析:CAS虽能有效改善患者狭窄侧血供,使缺血缺氧症状得到缓解,但却面对一个更加严峻的问题——缺血再灌注损伤。长期的慢性缺血性损害,导致狭窄侧微、小动脉血管内皮细胞异常脆弱。CAS是个急性改善缺血的过程,多数情况下在侧支循环代偿供血尚未切断时,更多的血流涌向狭窄侧血管。由于大血管组织结构相对严密,缺血再灌注损伤相对影响较小,而微、小动脉应对血流的改变不能显示良好的耐受性,导致微、小动脉内压力增高,内皮细胞出现新的损伤,更多的红细胞通过受损部位漏出至血管外,故新增CMBs增加。血管狭窄≥70%未经CAS治疗的患者新增CMBs与上述2组对比均有明显增多,考虑为狭窄侧颈动脉供血区远端或末端的微、小动脉缺血始终存在,不能得到有效缓解,虽有部分患者存在侧支循环代偿部分血供,但与经CAS治疗后的颈动脉相比则要相差很多,其相应区域的微、小动脉的慢性损伤过程始终不能纠正,血管内皮细胞修复困难。
本研究CAS治疗后12个月新增CMBs数目较6个月无明显增多。脑血流恢复的急性期存在缺血再灌注损伤,故6个月时形成CMBs增多,随着自身损伤的修复及血流的重新分布,微、小动脉缺血状态得到有效缓解,内皮细胞功能恢复,血管的通透性下降,血脑屏障继续发挥作用,有效减少了CMBs的形成。12个月时,CAS治疗后新增CMBs数目较血管狭窄<50%的患者略增多,笔者分析:从6个月到12个月,由于CAS治疗增加了狭窄血管的血供及缺血再灌注损伤的修复,治疗后的颈动脉狭窄程度一般不超过30%,供血情况明显改善,所以CMBs的增加速度较血管狭窄<50%的患者减慢。因血管狭窄≥70%未经CAS治疗的患者血管狭窄未纠正,缺血缺氧状态始终存在,故新增CMBs明显增多,与上述2组差异有统计学意义。
综上所述,CAS对于解除颈动脉狭窄有重要作用,可使狭窄动脉供血区CMBs的形成得到有效缓解,对防止缺血性脑卒中的复发、脑梗死的出血转化具有重要意义。针对颈动脉重度狭窄患者,早期采取CAS解除狭窄,对改善患者预后有积极作用。
[参考文献]
[1] 朱春丽,彭一鹏,欧阳存,等.远端缺血后适应处理对急性脑梗死患者血清促炎因子和抗炎因子的影响及其临床意义[J].疑难病杂志,2016,15(3):241-244.
[2] Jiang G, Li W, Wang D, et al. Epidemiological transition and distribution of stroke incidence in Tian Jin, China, 1988-2010[J]. Public Health,2016,131:11-19.
[3] Go AS,Mozaffarian D,Roger VL,et al. Heart disease and stroke statistics 2014 update:a report from the American Heart Associa cion[J]. Circulation,2014,129(3):399-410.
[4] 刘长江,李可,张大权,等.40例缺血性脑血管病患者介入治疗后效果观察[J].河北医科大学学报,2017,38(11):1327-1330.
[5] 卫杰,刘洁怡,耿昌明,等.颈动脉支架成形术治疗重度颈动脉狭窄25例效果分析[J].介入放射学杂志,2017,26(3):359-363.
[6] Park JH,Seoa SW,Kim C, et al. Pathogenesis of cerebral microbleeds:in vivo imaging of amyloid and subcortical ischemic small vessel disease in 226 individuals with cognitive impairment[J]. Ann Neurol,2013,73(5):584-593.
[7] Rnett H. North American Symptomatic Carotid Endarterectomy Trial. Methods,patient characteristics,and progress[J]. Stroke,1991,22(6):711-720.
[8] Schrag M,Greer DM. Clinical associations of cerebral microbleeds on magnetic resonance neuroimaging[J]. J Stroke Cerebrovasc Dis,2014,23(10):2489-2497.
[9] Calvet D,Mas JL,Stenting VS. Surgery for symptomatic carotid stenosis[J]. Presse Med,2015,44(5):509-514.
[10] Marrocco Trischitta MM,Chiesa R. Regarding he role of atropine in carotid stenting of recurrent stenosis after eversion endarterectomy[J]. J Vascular Surgery,2015,61(5):1380-1381.
[11] 周楚,乔彤.血管性认知障碍与颈动脉狭窄[J].中华血管外科杂志,2016,1(3):193-196.
[12] Chang XL,Zhou HQ,Lei CY,et al. Association between asymptomatie carotid stenosis and cognitive function:a systematic review[J]. Neurosci Biobehav Rev,2013,37(8):1493-1499.
[13] 张琪.脑微出血与临床疾病相关关系的研究进展[J].医学信息,2017,30(12):11-12.
[14] Akoudad S,Wolters FJ,Viswanathan A,et al. Association of cerebral microbleeds with cognitive decline and dementia[J]. JAMA Neurol,2016,73(8):934-943.
[15] 陈乐,孙晓江.脑微出血的危险因素及其临床意义研究进展[J].中国卒中杂志,2014,9(8):692-696.
[16] Shoamanesh A,Pearce LA,Bazan C,et al. Microbleeds in the secondary prevention of small subcortical strokes trial:stroke,mortality,and treatment interactions[J]. Ann Neurol,2017,82(2):196-207.
[17] Lin CJ,Tu PC,Chern CM,et al. Connectivity features for identifying cognitive impairment in presymptomatic carotid stenosis [J]. PLoS One,2014,9(1):e85441.
[18] 陆照璇,邓钢,魏恒乐,等.颈动脉支架术后脑功能与认知功能的改变[J].中华医学杂志,2017,97(39):3093-3098.
ZHANG Jun1, ZHAO Xian2*, CAO Xian-guo1, SONG Zhe1, LIU Hui-qin1
(1.DepartmentofNeurology,theFirstHospitalofShijiazhuang,HebeiProvince,Shijiazhuang050011,China; 2.DepartmentofOphtholmology,theFirstHospitalofShijiazhuang,HebeiProvince,Shijiazhuang050011,China)
[Abstract]ObjectiveTo investigate the changes of cerebral microbleeds(CBMs) after carotid angioplasty and stenting(CAS) in patients with ischemic stroke.MethodsA total of 67 patients of ischemic stroke with carotid artery stenosis greater than or equal to 70% were selected as group A. All conformed to the indications of interventional therapy by digital subtraction angiography(DSA) and CAS treatments were performed. 76 patients of ischemic stroke with carotid artery stenosis greater than or equal to 70% were selected as group B and were not treated with CAS. 80 patients with ischemic stroke with carotid artery stenosis less than 50% were selected as group C. Susceptibility weighted imaging(SWI) scanning by 3.0 T magnetic resonance imaging(MRI) was used to count the new CMBs.ResultsAt 6 months, there were 8 new CMBs(11.94%) in group A, 19 new CMBs(25.00%) in group B and 7 new CMBs(8.75%) in group C. The differences between group A and group B, group B and group C were significant (P<0.05). At 12 months, the new CMBs were 11(16.42%) in group A, 24(31.58%) in group B and 10(12.50%) in group C. There were significant statistical differences between group A and group B, group B and group C(P>0.05).ConclusionThe long-time new CMBs numbers after CAS treatment of patients with ischemic stroke whose carotid artery stenosis were greater than or equal to 70% can reach the level of patients with carotid artery stenosis less than 50%. The prognosis of patients with ischemic stroke was improved to some extent.
[Keywords]carotid stenosis; interventional therapy; cerebral microbleeds
*通讯作者。E-mail:zhangjundr@126.com
[作者简介]张军(1977-),男,河北衡水人,河北省石家庄市第一医院主治医师,医学硕士,从事神经内科疾病诊治研究。
[基金项目]石家庄市科学技术研究与发展指导计划(141462463)
[修回日期]2018-08-23
[收稿日期]2018-08-06;
[文章编号]1007-3205(2018)11-1253-05
[文献标志码]A
[中图分类号]R543.4
(本文编辑:刘斯静)