表1SNPrs2736100A>B位点多态性与肿瘤易感性的Meta分析结果
Table1MetaanalysisofSNPrs2736100A>Bpolymorphismandsusceptibilitytocancer
秦 通,韩振伟,滕志海,常学良,李景东,王亚轩*
(河北医科大学第二医院泌尿外科,河北 石家庄 050000)
[摘要]目的探讨人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)基因多态性(rs2736100)与亚洲人群肿瘤的关系。方法在中英文数据库中,依据纳入和排除标准,按关键词全面搜索文献,筛选出符合要求的文献,运用Stata 12.0统计软件对提取的数据进行合并分析,计算合并的优势比(odds ratio,OR)及其95%置信区间(95% confidence interval,95%CI)。结果本研究共纳入了34个病例对照研究,共涉及肿瘤患者47 148例和对照75 673例。Meta分析结果显示, hTERT 基因rs2736100多态性可显著升高亚洲人群肿瘤遗传易感性,(BvsA,OR=1.25,95%CI=1.20~1.29,P=0.000),(BBvsAA,OR=1.56,95%CI=1.45~1.67,P=0.000),(ABvsAA,OR=1.22,95%CI=1.17~1.28,P=0.000),(AB+BBvsAA,OR=1.30,95%CI=1.24~1.37,P=0.000),(BBvsAB+AA,OR=1.39,95%CI=1.32~1.47,P=0.000),其中肺癌患者36 815例,对照64 149例。Meta分析结果显示, hTERT 基因rs2736100多态性可显著升高亚洲人群肺癌遗传易感性[(BvsA,OR=1.28,95%CI=1.23~1.32,P=0.000),(BBvsAA,OR=1.64,95%CI=1.52~1.76,P=0.001),(ABvsAA,OR=1.27,95%CI=1.21~1.33,P=0.015),(AB+BBvsAA,OR=1.35,95%CI=1.28~1.42,P=0.001),(BBvsAB+AA,OR=1.42,95%CI=1.35~1.50,P=0.030)]。结论在亚洲人群中,hTERT 基因rs2736100多态性是肿瘤易感性增加的危险因素。
[关键词]肿瘤;逆转录聚合酶链反应;端粒酶;Meta分析 doi:10.3969/j.issn.1007-3205.2018.11.016
端粒酶也是逆转录酶的一种,其实质是RNA,是以自身的RNA为模板合成端粒DNA,其主要作用是用来保护染色体的端粒(telomere)的长度,保护染色体的稳定性。人端粒酶主要由两部分组成,人端粒酶RNA模板(human telomerase RNA,hTR)和人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)。研究表明,端粒酶与恶性肿瘤的发生发展有着密切的联系,然而到目前为止,hTERT作为在端粒酶激活中发挥着关键作用的限速酶,其表达与调控的机制还不是完全明确。而编码hTERT的基因位点定位于第5号染色体5p15.33区域,该区域上的rs2736100位点位于hTERT的1号内含子处,它主要是负责激活端粒酶,并且在hTERT蛋白质的合成中起到了不可或缺的作用。本研究通过病例对照研究,比较肿瘤患者与正常人rs2736100位点单核苷酸多态(single nucleotide polymorphism,SNP)的差异,探讨rs2736100位点与肿瘤发生是否具有相关性。
1.1研究对象 在PubMed、中国知网(CNKI)、中国生物医学文献数据库(CBM)、万方数据库、EMBASS等数据库中以检索词使用为自由词和主题词,全查为前提,兼顾特异性的方法进行检索。英文检索式:tumor OR cancer OR carcinoma,hTERT OR human telomerase reverse transcriptase OR rs2736100 polymorphism OR SNPs OR variant。中文检索式:肿瘤或癌症,hTERT或rs2736100,多态性或单核苷酸多态性。截至2017年7月。手工检索相关参考文献。
1.2纳入和排除标准
1.2.1纳入标准 ①hTERT单核苷酸的多态性与发生肿瘤的病例对照研究;②筛选的文献应为英文或者中文发表的全文;③筛选出文献中完整的数据,或者可以通过计算从而得到有用的数据,进一步从重复的数据中找出最新统计的研究数据;④研究样本的基因分型应当符合Hardy-Weinberg平衡。
1.2.2排除标准 ①与hTERT的基因多态性无关;②文献的类型为病例报告、综述、信函、摘要等不涉及病例对照的文献;③文献报道中的资料缺损,且与作者取得联系后也无法得到完整的资料计算优势比(odds ratio,OR)及其95%置信区间(95% confidence interval,95%CI)的文献;④重复性的研究。
1.3文献的筛选和质量评价 根据纳入与排除标准,由2名特定负责评价的人员筛选出符合要求的文献。评价的主要内容包括:①确定发生肿瘤的时间;②定义并且评估疾病进展的阶段;③基因检测的方式方法和质量方面的控制;④对于样本量的评估;⑤对于研究对象一般特征的描述;⑥研究数据的完整性;⑦所采用的统计学方法。对于所提取到的数据,按照统一设计的数据表格录入。如果遇到提取的数据不一致,需要共同讨论和分析确定其准确性。
1.4统计学方法 应用Stata 12.0统计软件包处理数据。首先对纳入的文献采用Q检验、I2检验的方法进行异质性检验,分析各研究之间的异质性:如果不存在异质性(P>0.1,I2<50%),数据合并时选用固定效应模型;如果存在异质性(P<0.1,I2>50%),数据合并时选用随机效应模型。计算各个研究合并的OR值以及95%CI,依据其得出的结果(表1)绘制森林图。应用Begg′s和Egger′s检验估计发表偏倚。应用固定效应模型及随机效应模型进行敏感性分析。
表1SNPrs2736100A>B位点多态性与肿瘤易感性的Meta分析结果
Table1MetaanalysisofSNPrs2736100A>Bpolymorphismandsusceptibilitytocancer

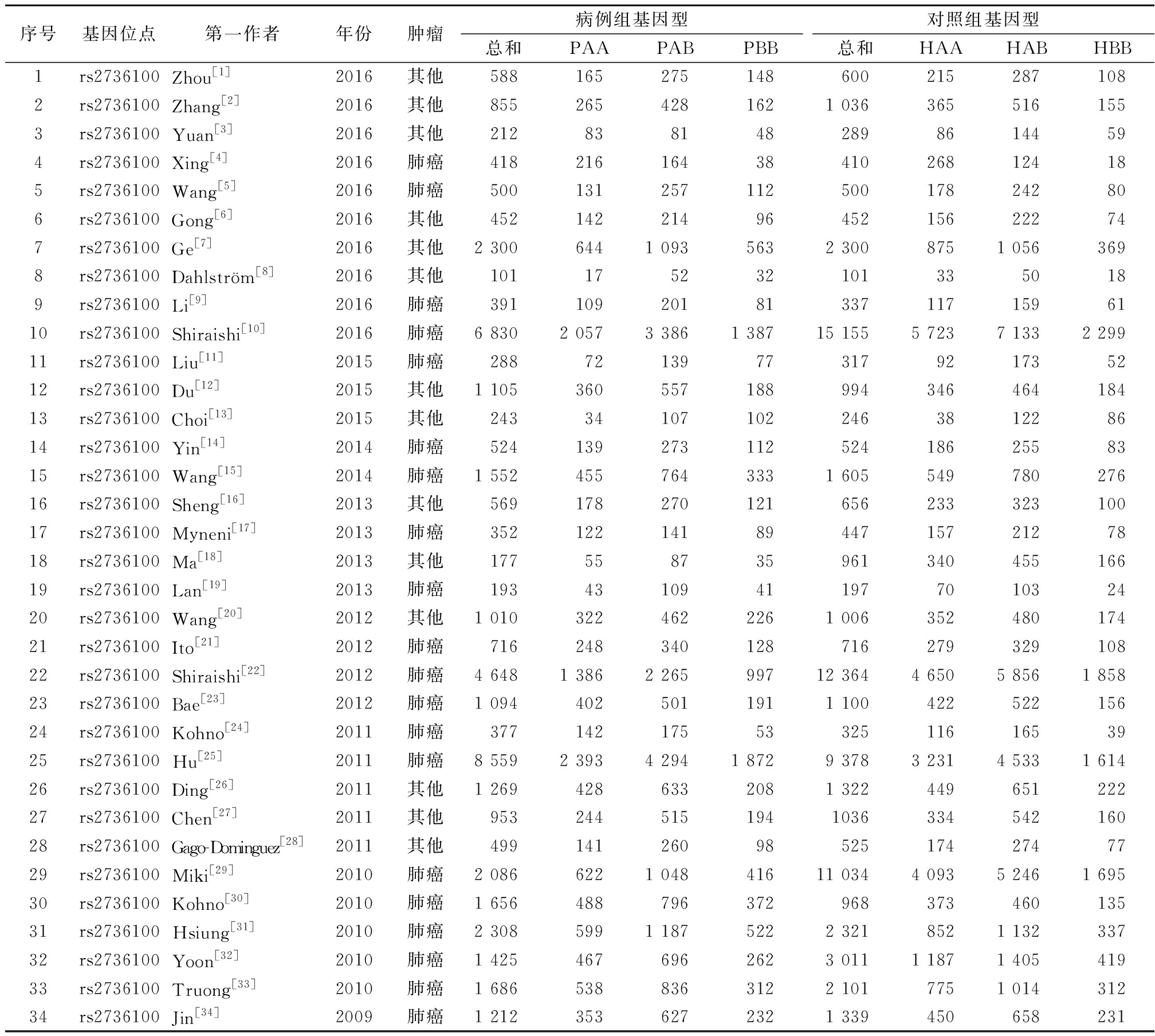
2.1纳入文献的基本特征以及其质量的评价 通过检索各个数据库,排除后共选出243篇文献。由特定评价的人员依据排除与纳入标准,并且阅读文献题目、摘要及全文后共纳入了34篇(均为英文文献)与hTERT多态性与肿瘤有关的病例对照研究,并且用于Meta分析,见表2。
表2纳入文献的一般特征和基因型分布Table2Generalcharacteristicsandgenotypedistributionincludedintheliterature
2.2hTERT基因rs2736100多态性与肿瘤易感性结果 研究hTERT基因rs2736100多态性与肿瘤的文献34篇,累计病例47 148例和对照75 673例。提取的数据在BvsA、BBvsAA、ABvsAA、AB+BBvsAA、BBvsAB+AA基因型的比较模型中进行分析,各遗传模型Meta分析结果显示,hTERT基因rs2736100多态性可显著升高肿瘤的遗传易感性[(BvsA,OR=1.25,95%CI=1.20~1.29,P=0.000)、(BBvsAA,OR=1.56,95%CI=1.45~1.67,P=0.000)、(ABvsAA,OR=1.22,95%CI=1.17~1.28,P=0.000)、(AB+BBvsAA,OR=1.30,95%CI=1.24~1.37,P=0.000)、(BBvsAB+AA,OR=1.39,95%CI=1.32~1.47,P=0.000)]。
2.3hTERT基因rs2736100多态性与肺癌易感性结果 研究hTERT基因rs2736100多态性与肺癌的文献共计20篇,累计肺癌病例36 815例,对照64 149例。提取的数据在BvsA、BBvsAA、ABvsAA、AB+BBvsAA、BBvsAB+AA基因型的比较模型中进行分析,各遗传模型meta分析结果显示,在亚洲人群中hTERT基因rs2736100多态性可显著升高肺癌的发病风险[(BvsA,OR=1.28,95%CI=1.23~1.32,P=0.000)、(BBvsAA,OR=1.64,95%CI=1.52~1.76,P=0.001)、(ABvsAA,OR=1.27,95%CI=1.21~1.33,P=0.015)、(AB+BBvsAA,OR=1.35,95%CI=1.28-1.42,P=0.001)、(BBvsAB+AA,OR=1.42,95%CI=1.35~1.50,P=0.030)]。BvsA、ABvsAA、AB+BBvsAA、BBvsAB+AA模型森林图,见图1。
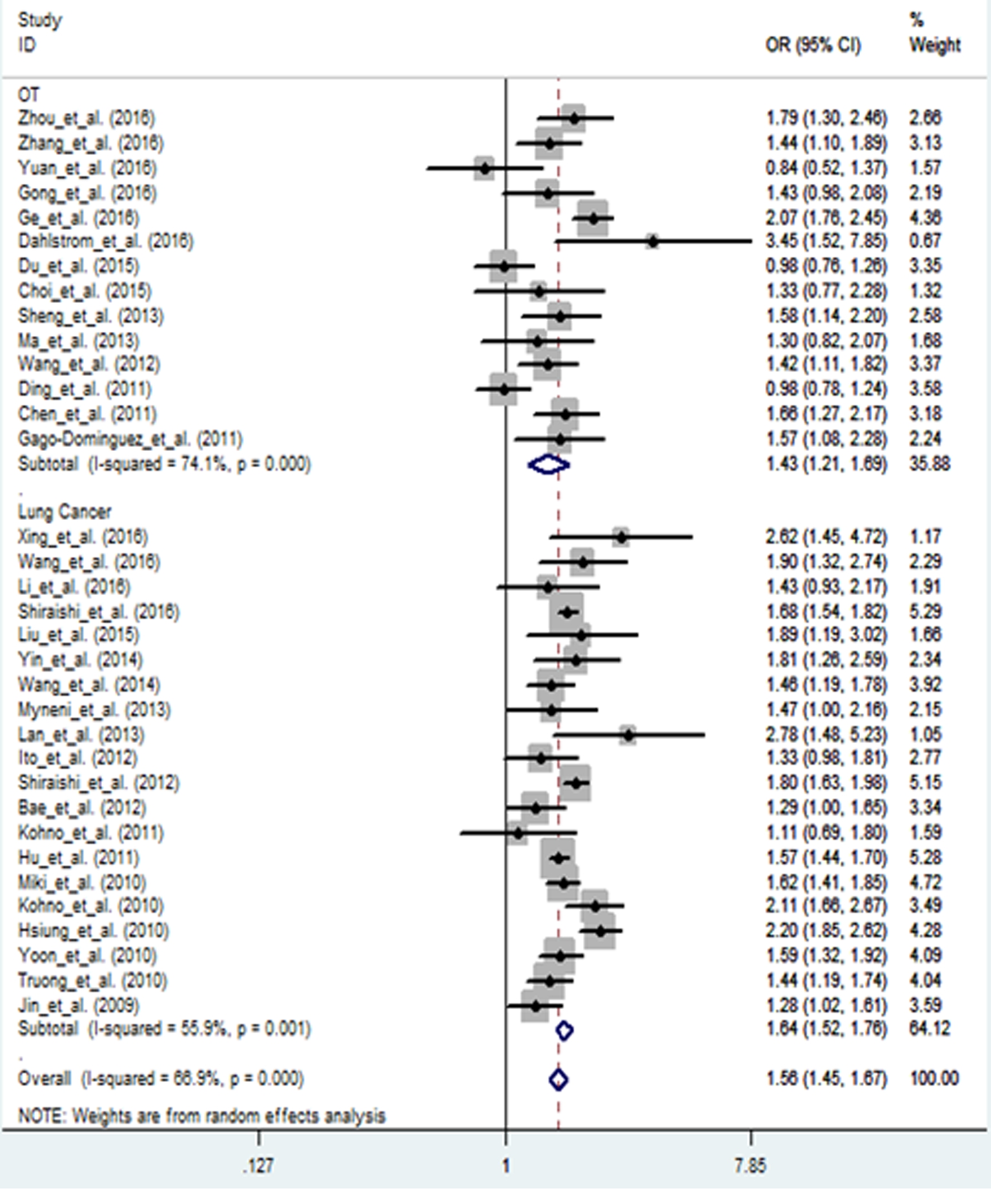
图1hTERT基因rs2736100多态性与亚洲人群肿瘤相关性的Meta分析森林图(BBvsAA)
Figure1Metaanalysisoftheassociationbetweenrs2736100polymorphismofhTERTgeneandtumorinAsianpopulation(BBvsAA)
2.4发表偏倚及敏感性分析 应用Begg′s秩相关法和Egger′s线性回归法识别和评价有无发表的偏倚(图2,3),可见2种检验结果的P值均大于0.05,提示本研究所纳入文献不存在发表偏移,因此其合并效应量的结果较为可靠。敏感性分析应用随机效应模型和固定效应模型,同时对效应量进行合并,其所得结果变化不大,表明本研究分析结果较为稳定(图2)。BvsA、ABvsAA、AB+BBvsAA、BBvsAB+AA敏感性分析,见图2。
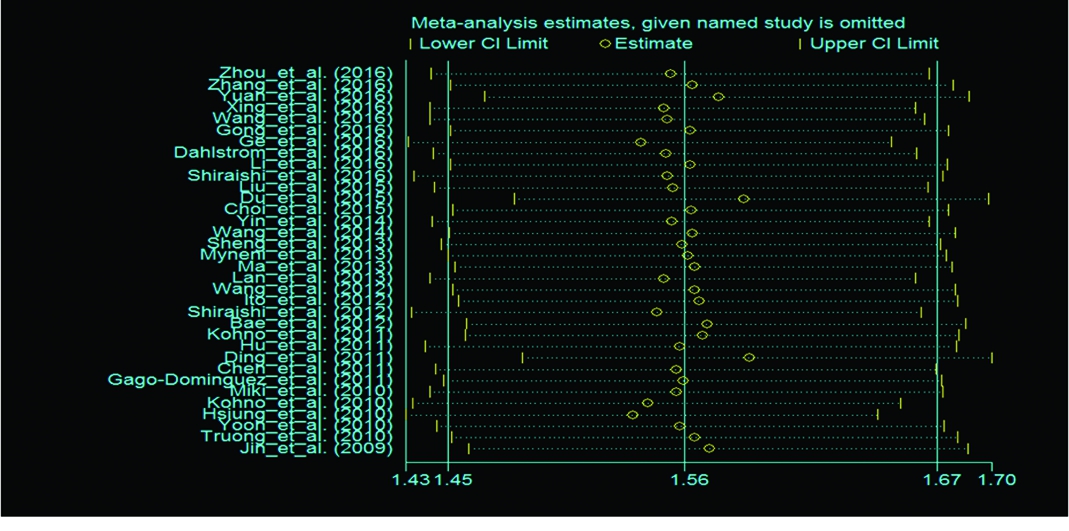
图2hTERTSNPrs2736100BBvsAA与肿瘤发病风险的敏感性分析图
Figure2SensitivityanalysisofhumantelomerasereversetranscriptaseSNPrs2736100BBvsAAandtumorrisk
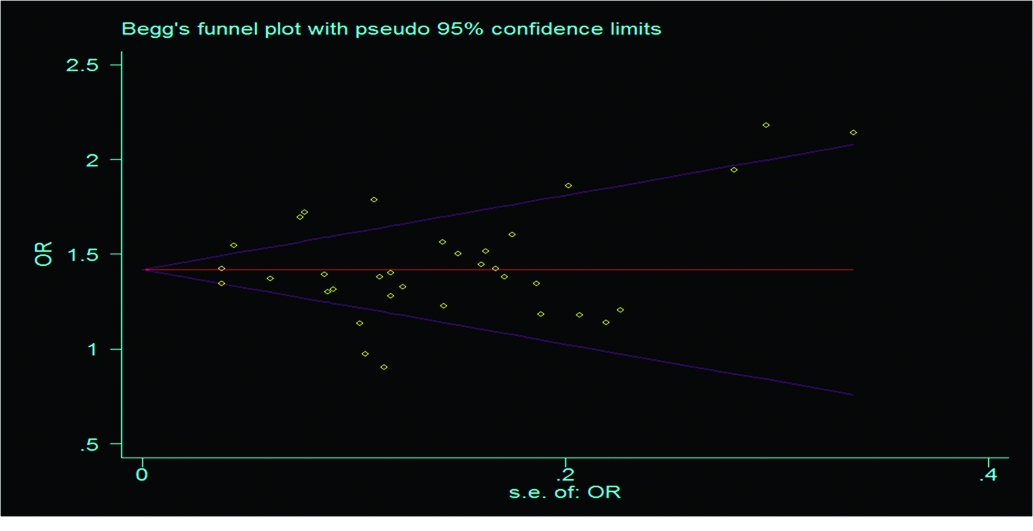
图3hTERTSNPrs2736100BBvsAA与肿瘤发病风险的Begg′s检验
Figure3Begg′smapofhumantelomerasereversetranscriptaseSNPrs2736100BBvsAAandtumorrisk
随着全球人口增加,社会步入老龄化、环境污染日益严重等因素致使癌症发生及肿瘤所致的死亡大大增加。调查发现,发展中国家的癌症跃居为死因的首位,而发达国家的癌症致死也不容乐观,位居第二位死因。癌症的发生与年龄关系较大,多发生于老年人,在所有初诊为癌症的患者中,年龄在65岁及其以上者占56%,在所有癌症死亡中占71%[35]。
RNA 组分、端粒酶相关蛋白及hTERT是人端粒酶的3个亚单位。5p15.33区域上的rs2736100位点(位于hTERT的1号内含子处),在hTERT蛋白的合成中起着负责激活端粒酶的关键性作用[36]。
端粒酶在发现时就引起了人们的重视,而hTERT作为端粒酶活性激活的关键,更是成为当前人们在端粒酶研究中的热点。目前为止研究发现,在绝大多数的恶性肿瘤细胞中hTERT表达,但是在正常的组织细胞(不包括生殖细胞和具有高度复制潜能的体细胞)中hTERT则不表达。而其他成分不管是在肿瘤细胞中还是在正常组织的细胞中均会有不同程度的表达。表明在细胞中hTERT的表达对端粒酶活性的激活起着不可或缺的决定性因素[37]。hTERT是逆转录酶的一种,主要以人端粒酶RNA组分为模板合成端粒DNA,其实质是依赖RNA的DNA聚合酶。hTERT是含有1 132个氨基酸残基的多肽链的蛋白,其相对分子质量约为127 000。hTERT作为一种逆转录酶,含有7个保守功能域,并且在氨基端有T功能领域,这是端粒酶所特有的[38]。Kim 等[39]通过利用一种高度敏感的方法检测端粒酶的活性,结果显示在18种不同的人体组织细胞中,永生化细胞(不会凋亡的细胞)检测其端粒酶活性为98%,与此相反的是非永生化细胞(可凋亡细胞)检测端粒酶活性却为零。90%的人体组织肿瘤细胞的端粒酶活性表达为阳性;但在人体正常的组织细胞中,其端粒酶活性的表达则为阴性。端粒酶的活性在正常的卵巢细胞和睾丸细胞中表达为阳性,而在一些良性肿瘤中的表达却为阴性,如端粒酶活性在纤维腺瘤中的表达为阴性。表明端粒酶的活性表达与否,除与肿瘤的发生有关外,还与细胞是否为永生化细胞密切相关。保持染色体末端的端粒长度及维持其功能稳定是端粒酶的主要功能,然而端粒酶与肿瘤细胞的发生及在不凋亡细胞中的活性表达关系密切,在端粒酶中hTERT是端粒酶活性激活的关键组分。尽管如此,目前人们关于hTRET对肿瘤细胞发生的确切机制还不是很明了。
本研究分析了34篇hTERT 基因rs2736100 多态性与亚洲肿瘤发病风险相关的临床随机对照试验。从34篇文献研究结果看,目前对于hTERT 基因rs2736100 多态性与肿瘤发病关系尤其对肺癌关系的研究结果一致。研究数据均符合Hardy-Weinberg遗传平衡定律,这说明所纳入的数据来自同一孟德尔群体,群体的遗传基因平衡。此外,本研究运用了严格的排除和纳入标准,并且Begg′s线性回归检验显示,研究无发表偏倚,Meta分析所得出的结果是客观可信的。
但本研究还是有一定的局限性:①肿瘤的发生会受到多种危险因素的影响,如多基因与环境、基因与基因交互作用等,本研究的文献数据有限,还有待今后研究人员提供更多的详细试验数据,以便于进一步探讨与环境、基因间的交互作用;②本研究所用的基因比较只采用了已经公开发表的中、英文文献,并且摘除了一些会议的摘要和一些基因型频率等数据缺失的文献以及存在选择性的偏倚;③所涉及的数据,其治疗方案的选择不同、采取标本的来源不同、运用的检测方法不同均可能对本研究的结果有影响;④与随机对照试验不同,到现在为止仍然缺乏评价前瞻性队列研究质量的标准;⑤本研究所采用的研究文献未进行有关的质量评价,尚存在一定的统计学异质性;⑥在各项研究之间对于运用暴露协变量存在很大差异,因此交互作用分析排除在本研究范围内。本研究结果提示,负责激活端粒酶的hTERT基因会增加亚洲人肿瘤的患病风险(特别是肺癌)。在hTERT的1号内含子处有rs2736100位点,此位点在hTERT蛋白的合成中发挥着关键性作用。因此,本研究通过采用病例对照研究探讨rs2736100 基因位点多态性是否与肿瘤发病有关联,结果显示在亚洲人群中,肿瘤患者的rs2736100位点上等位基因型频率与正常对照组的rs2736100位点上等位基因型频率存在明显的差异,rs2736100位点的多态性导致患肿瘤的风险增加(尤其是肺癌)。
综上所述,5p15.33区域上的rs2736100位点多态性变化是发生肿瘤的一个危险因素,应对其深入研究,以进一步明确其在肿瘤发病中的作用机制。
[参考文献]
[1] Zhou L,Fu G,Wei J,et al. The identification of two regulatory ESCC susceptibility genetic variants in the TERT-CLPTM1L loci[J]. Oncotarget,2016,7(5):5495-5506.
[2] Zhang Y,Zhang X,Zhang H,et al. Common variations in TERT-CLPTM1L locus are reproducibly associated with the risk of nasopharyngeal carcinoma in Chinese populations[J]. Oncotarget,2016,7(1):759-770.
[3] Yuan X,Meng Y,Li P,et al. The association between the TERT rs2736100 AC genotype and reduced risk of upper tract urothelial carcinomas in a Han Chinese population[J]. Oncotarget,2016,7(22):31972-31979.
[4] Xing YL,Liu F,Li JF,et al. Case-control study on impact of the telomerase reverse transcriptase gene polymorphism and additional single nucleotide polymorphism (SNP)-SNP interaction on non-small cell lung cancers risk in chinese han population[J]. J Clin Lab Anal,2016,30(6):1071-1077.
[5] Wang X,Ma K,Chi L,et al. Combining telomerase reverse transcriptase genetic variant rs2736100 with epidemiologic factors in the prediction of lung cancer susceptibility[J]. J Cancer,2016,7(7):846-853.
[6] Gong L,Xu Y,Hu YQ,et al. hTERT gene polymorphism correlates with the risk and the prognosis of thyroid cancer[J]. Cancer Biomark,2016,17(2):195-204.
[7] Ge M, Shi M,An C,et al. Functional evaluation of TERTCLPTM1L genetic variants associated with susceptibility of papillary thyroid carcinoma[J]. Sci Rep,2016,6:26037.
[8] Dahlström J,Liu T,Yuan X,et al. TERT rs2736100 genotypes are associated with differential risk of myeloproliferative neoplasms in Swedish and Chinese male patient populations[J]. Ann Hematol,2016,95(11):1825-1832.
[9] Li X,Xu X,Fang J,et al. Rs2853677 modulates Snail1 binding to the TERT enhancer and affects lung adenocarcinoma susceptibility[J]. Oncotarget,2016,7(25):37825-37838.
[10] Shiraishi K,Okada Y,Takahashi A,et al. Association of variations in HLA class Ⅱ and other loci with susceptibility to EGFR-mutated lung adenocarcinoma[J]. Nat Communi,2016,7:12451.
[11] Liu SG,Ma L,Cen QH,et al. Association of genetic polymorphisms in TERT-CLPTM1L with lung cancer in a Chinese population[J]. Genet Mol Res,2015,14(2):4469-4476.
[12] Du J,Zhu X,Xie C,et al. Telomere length,genetic variants and gastric cancer risk in a Chinese population[J]. Carcinogenesis,2015,36(9):963-970.
[13] Choi BJ,Yoon JH,Kim O,et al. Influence of the hTERT rs2736100 polymorphism on telomere length in gastric cancer[J]. World J Gastroenterol,2015,21(31):9328-9336.
[14] Yin Z,Cui Z,Ren Y,et al. Genetic polymorphisms of TERTand CLPTM1L,cooking oil fume exposure,and risk of lung cancer:a case-control study in a Chinese non-smoking female population[J]. Med Oncol,2014,31(8):114.
[15] Wang F,Fu P,Pang Y,et al. TERT rs2736100T/G polymorphism upregulates interleukin 6 expression in non-small cell lung cancer especially in adenocarcinoma[J]. Tumour Biol,2014,35(5):4667-4672.
[16] Sheng X,Tong N,Tao G,et al. TERT polymorphisms modify the risk of acute lymphoblastic leukemia in Chinese children[J]. Carcinogenesis,2013,34(1):228-235.
[17] Myneni AA,Chang SC,Niu R,et al. Genetic polymorphisms of TERT and CLPTM1L and risk of lung cancer--a case-control study in a Chinese population [J]. Lung Cancer,2013,80(2):131-137.
[18] Ma Z,Hu Q,Chen Z,et al. Systematic evaluation of bladder cancer risk-associated single-nucleotide polymorphisms in a Chinese population[J]. Mol Carcinog,2013,52(11):916-921.
[19] Lan Q,Cawthon R,Gao Y,et al. Longer telomere length in peripheral white blood cells is associated with risk of lung cancer and the rs2736100(clptm1l-tert) polymorphism in a prospective cohort study among women in China[J]. PLoS One,2013,8(3):e59230.
[20] Wang S,Wu J,Hu L,et al. Common genetic variants in TERT contribute to risk of cervical cancer in a Chinese population[J]. Mol Carcinog,2012,51(Suppl 1):E118-122.
[21] Ito H,Mckay JD,Hosono S,et al. Association between a genome-wide association study-identified locus and the risk of lung cancer in Japanese population[J]. J Thoracic Oncol,2012,7(5):790-798.
[22] Shiraishi K,Kunitoh H,Daigo Y,et al. A genome-wide association study identifies two new susceptibility loci for lung adenocarcinoma in the Japanese population[J]. Nat Genet,2012,44(8):900-903.
[23] Bae EY,Lee SY,Kang BK,et al. Replication of results of genome-wide association studies on lung cancer susceptibility loci in a Korean population[J]. Respirology,2012,17(4):699-706.
[24] Kohno T,Kunitoh H,Mimaki S,et al. Contribution of the TP53,OGG1,CHRNA3,and HLA-DQA1 genes to the risk for lung squamous cell carcinoma[J]. J Thoracic Oncol, 2011,6(4):813-817.
[25] Hu Z,Wu C,Shi Y,et al. A genome-wide association study identifies two new lung cancer susceptibility loci at 13q12.12 and 22q12.2 in Han Chinese[J]. Nat Genet,2011,43(8):792-796.
[26] Ding CY,Hu LM,Hu ZB,et al. The relationship between gene polymorphism of telomerase reverse transcriptase and susceptibility to hepatocellular carcinoma[J].Zhonghua Yu Fang Yi Xue Za Zhi,2011,45(7):593-596.
[27] Chen H,Chen Y,Zhao Y,et al. Association of sequence variants on chromosomes 20,11,and 5 (20q13.33,11q23.3,and 5p15.33) with glioma susceptibility in a Chinese population[J]. Am J Epidemiol,2011,173(8):915-922.
[28] Gago-Dominguez M, Jiang X,Conti DV,et al. Genetic variations on chromosomes 5p15 and 15q25 and bladder cancer risk: findings from the Los Angeles-Shanghai bladder case-control study[J]. Carcinogenesis,2011,32(2):197-202.
[29] Miki D,Kubo M,Takahashi A,et al. Variation in TP63 is associated with lung adenocarcinoma susceptibility in Japanese and Korean populations[J]. Nat Genet,2010,42(10):893-896.
[30] Kohno T,Kunitoh H,Shimada Y,et al. Individuals susceptible to lung adenocarcinoma defined by combined HLA-DQA1 and TERT genotypes.[J]. Carcinogenesis,2010,31(5):834-841.
[31] Hsiung CA,Lan Q,Hong YC,et al. The 5p15.33 Locus Is Associated with Risk of Lung Adenocarcinoma in Never-Smoking Females in Asia[J]. Plos Genet,2010,6(8):e1001051.
[32] Yoon KA,Park JH,Han J,et al. A genome-wide association study reveals susceptibility variants for non-small cell lung cancer in the Korean population[J]. Human Mol Genet,2010,19(24):4948-4954.
[33] Truong T,Hung RJ,Amos CI,et al. Replication of lung cancer susceptibility loci at chromosomes 15q25,5p15,and 6p21: a pooled analysis from the International Lung Cancer Consortium.[J]. J Natl Cancer Inst,2010,102(13):959-971.
[34] Jin G,Lin X,Shu Y,et al. Common genetic variants on 5p15.33 contribute to risk of lung adenocarcinoma in a Chinese population[J]. Carcinogenesis,2009,30(6):987-990.
[35] Jemal A,Bray F,Center MM,et al. Global cancer statistics[J]. Ca A Cancer J Clin,2011,61(2):69-90.
[36] Melin BS,Nordfjäll K,Andersson U,et al. hTERT Cancer risk genotypes are associated with telomere length[J]. Genet Epidemiol,2012,36(4):368-372.
[37] Wu A,Ichihashi M,Ueda M,et al.Correlation of the expression of human telomerase subunits with telomerase activity in normal skin and skin tumors[J]. Cancer,1999,86(10):2038-2044.
[38] Lingner J,Hughes TR,Shevchenko A,et al. Reverse transcriptase motifs in the catalytic subunit of telomerase[J]. Science,1997,276(5312):561-567.
[39] Kim NW,Piatyszek MA,Prowse KR,et al. Specific association of human telomerase activity with immortal cells and cancer[J]. Science,1994,266(5193):2011-2015.
QIN Tong, HAN Zhen-wei, TENG Zhi-hai, CHANG Xue-liang, LI Jing-dong, WANG Ya-xuan*
(1.DepartmentofUrology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
[Abstract]ObjectiveTo investigate the relationship between human telomerase reverse transcriptase(hTERT) gene polymorphism rs2736100 and tumor in Asian population.MethodsAccording to the inclusion and exclusion criteria, relevant literature were searched based on key words in Chinese and English databases. Documents that met the requirements were screened, and related data were extracted. Stata 12.0 statistical software was used to merge and analyze the extracted data. Meanwhile, odds ratio(OR) and its 95% confidence interval(95%CI) were calculated.ResultsTotally 34 case-control studies were included, including 47 148 tumor patients and 75 673 controls. Meta-analysis results showed that hTERT gene polymorphism rs2736100 could significantly increase tumor genetic susceptibility in Asian populations(BvsA,OR=1.25,95%CI=1.20-1.29,P=0.000), (BBvsAA,OR=1.56, 95%CI=1.45-1.67,P=0.000), (ABvsAA,OR=1.22, 95%CI=1.17-1.28,P=0.000), (AB+BBvsAA,OR=1.30, 95%CI=1.24-1.37,P=0.000), (BBvsAB+AA,OR=1.39, 95%CI=1.32-1.47,P=0.000). Moreover, 36 815 lung cancer patients and 64 149 controls were included in this study. Meta-analysis results indicated that rs2736100 could significantly increase lung cancer susceptibility in Asian populations(BvsA,OR=1.28, 95%CI=1.23-1.32,P=0.000), (BBvsAA,OR=1.64, 95%CI=1.52-1.76,P=0.001), (ABvsAA,OR=1.27, 95%CI=1.21-1.33,P=0.015), (AB+BBvsAA,OR=1.35, 95%CI=1.28-1.42,P=0.001), (BBvsAB+AA,OR=1.42, 95%CI=1.35-1.50,P=0.030).ConclusionIn Asian populations,rs2736100 polymorphism of hTERT gene is a risk factor for tumor susceptibility.
[Keywords]neoplasms; reverse transcriptase polymerase chain reaction; human telomerase; Meta-analysis
*通讯作者。E-mail:wangyaxuan87@126.com
[作者简介]秦通(1990-),男,河北永年人,河北医科大学第二医院医学硕士研究生,从事泌尿外科疾病诊治研究。
[修回日期]2018-01-29
[收稿日期]2017-12-25;
[文章编号]1007-3205(2018)11-1304-07
[文献标志码]A
[中图分类号]R370.2
(本文编辑:许卓文)