表15组小胶质细胞IL-6、TNF-α、IL-1β和LDH浓度比较
Table1ComparisonofIL-6,TNF-α,IL-1BandLDHlevelsin5groups(n=3,![]() ±s)
±s)
杨建凯1,齐雪姣2,焦保华1,赵宗茂1,吕中强1,李 琛1
(1.河北医科大学第二医院神经外科,河北 石家庄 050000;2.河北省神经病学实验室,河北 石家庄 050000)
[摘要]目的探讨胶质母细胞瘤来源外泌体(GBM cell-derived exosomes,GBM-exo)在小胶质细胞活化、炎症网络激活和肿瘤化疗耐药性中的作用及潜在机制。方法培养U87胶质瘤细胞和BV2小胶质细胞,提取U87细胞来源外泌体(U87-exo)并进行鉴定,荧光示踪验证细胞间的外泌体传递。各实验组用1 mg/L脂多糖(lipopolysaccharides,LPS)刺激BV2小胶质细胞建立体外炎症模型,对照组加入PBS,4 h后实验组加入不同浓度的U87-exo,根据U87-exo浓度不同分为4组: LPS组、LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组和LPS+exo(200 mg/L)组。加入外泌体后孵育24 h,倒置相差显微镜观察BV2细胞的形态变化。收集各组BV2细胞和上清液,ELISA检测各组上清液中乳酸脱氢酶(lactate dehydrogenase,LDH)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)和白细胞介素6(interleukin 6,IL-6)的浓度, RT-PCR检测CXC趋化因子受体5(CXC chemokine receptor type 5,CXCR5)、诱导型一氧化氮合酶(inducible nitric oxide synthesis,iNOS) mRNA的表达水平,Western blotting检测各组小胶质细胞iNOS、CXCR5蛋白表达的变化。结果U87-exo可以转移到BV2小胶质细胞中,且能够促进小胶质细胞活化和细胞形态改变。LPS组、LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度,iNOS mRNA、CXCR5 mRNA表达明显高于对照组,LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度,iNOS mRNA、CXCR5 mRNA表达明显高于LPS组,LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度,iNOS mRNA、CXCR5 mRNA表达明显高于LPS+exo(50 mg/L)组,LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度,iNOS mRNA表达明显高于LPS+exo(100 mg/L)组,CXCR5 mRNA表达明显低于LPS+exo(100 mg/L)组,差异均有统计学意义(P<0.05)。结论本研究证实GBM-exo能促进肿瘤微环境中小胶质细胞介导的炎症反应,增强肿瘤化疗耐药性,这将为进一步认识和治疗脑胶质瘤提供有力的依据。
[关键词]神经胶质瘤;小神经胶质细胞;外泌体 doi:10.3969/j.issn.1007-3205.2018.11.017
脑胶质瘤是临床最为常见的原发性颅内肿瘤,约占颅内肿瘤的46%,其治疗效果一直不佳。慢性炎症反应是恶性胶质瘤微环境的重要组成部分,可诱导免疫抑制、增强化疗耐药、促进肿瘤进展[1]。小胶质细胞是一类巨噬细胞,占全部胶质细胞的10%~20%[2],正常情况下处于静止状态,维持中枢神经系统的稳定。当胶质瘤生长迅速时,位于肿瘤微环境中的小胶质细胞被激活,活化的小胶质细胞释放大量炎症介质、趋化因子、NO及过氧化物自由基,加重局部炎症反应,从而促进胶质瘤的恶化和复发[3]。外泌体是在许多生物过程中发挥重要作用的纳米级细胞外囊泡,通过释放自身携带的mRNA、miRNA、LncRNA和蛋白质等促进肿瘤的发生、增殖和迁移,使肿瘤产生抗性,给肿瘤的治疗带来障碍[4]。从外泌体途径阻断肿瘤对微环境的改变,减轻炎症反应,有可能成为脑胶质瘤治疗的新方法。
1.1试验材料 U87恶性胶质瘤细胞和BV2小胶质细胞均购自美国ATCC公司,DMEM培养基购自美国Gibico公司,胎牛血清(fetal bovine serum, FBS)购自美国Hyclone公司,ExoQuick外泌体提取试剂盒购自上海岚兴生物科技有限公司,pCMV-CD63-GFP 质粒购自美国Biovector 公司,脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司,Westem blot相关试剂(如电泳液、转膜液等)购自北京康为世纪生物技术有限公司,小鼠乳酸脱氢酶(lactate dehydrogenase,LDH)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)和白细胞介素6(interleukin 6,IL-6)的ELISA检测试剂盒购自上海依科赛生物制品有限公司,RIPA裂解液购自美国Gibco公司,RNA提取试剂Trizol、反转录试剂盒及Real-Time PCR试剂盒购自美国AB公司,兔抗人CXC趋化因子受体5(CXC chemokine receptor type 5,CXCR5)多克隆抗体购自北京华夏远洋科技有限公司,诱导型一氧化氮合酶(inducible nitric oxide synthesis,iNOS)购于美国NeoMarkers公司。
1.2U87细胞培养及其外泌体的提取、分离与鉴定 培养条件为37 ℃、5% CO2湿润培养。待细胞融合至80%后进行外泌体提取。混合液经2 000 r/min离心20 min后,再经0.22 μm乙酸纤维素膜过滤,去除细胞碎片,得到无细胞滤液。将上清转移至另一干净的灭菌管中,加入适量的ExoQuick试剂,上下颠倒离心管,混匀,4 ℃孵育过夜(12 h),1 500 r/min离心30 min,管底可见沉淀,去除上清,1 500 r/min继续离心5 min,小心去除上层液体组分;用100 μL buffer重悬沉淀。用紫外分光光度计对U87细胞来源外泌体(U87-exo)进行定量,最后完全细胞营养液调整U87-exo浓度为1 mg/L,-20 ℃冻存。
1.3BV2细胞培养及摄取外泌体的体外验证 BV2小胶质细胞以1×105个/mL接种于10 cm2的培养皿中,加入含10%胎牛血清的DMEM培养液进行常规培养和传代,1∶3进行传代。构建 pCMV-CD63-GFP 质粒,加入无血清的U87细胞培养皿中,孵育U87细胞48 h,检测稳定表达CD63。空载体对照孵育。CD63-GFP标记外泌体(CD63-GFP显示为绿色)加入BV2细胞培养液,孵育红色荧光蛋白标记的BV2小胶质细胞4 h,然后通过荧光共聚焦显微镜在BV2细胞中观察外泌体的摄取情况。
1.4实验分组和建立体外炎症模型 实验共分为5组:PBS对照组,LPS组、LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组和LPS+exo(200 mg/L)组。设置3个复孔,每组实验3次。将指数生长期的BV2细胞配制成细胞悬液接种于96孔板,使用DMEM培养1 d。待细胞贴壁后,实验组加入1 mg/L LPS,孵育4 h后,分别加入0 mg/L、50 mg/L、100 mg/L、200 mg/L不同浓度的外泌体。
1.5ELISA法检测细胞培养上清中炎症因子LDH、TNF-α、IL-1β和IL-6的含量 各组细胞培养24 h后收集培养上清液,检测炎症因子LDH、TNF-α、IL-1β和IL-6的分泌情况。实验操作严格按照ELISA试剂盒说明书进行。酶标仪450 nm波长测定OD值。绘制标准曲线,由标准曲线计算出相应浓度。
1.6RT-PCR检测BV2小胶质细胞iNOS mRNA、CXCR5 mRNA的变化 按上述实验分组处理小胶质细胞24 h后,收集细胞,按Trizol试剂说明书提取RNA,取适量RNA经琼脂糖凝胶电泳鉴定其完整性,其余的置于-80 ℃中保存备用。RT-PCR反应采用20 μL体系:2 μL cDNA模板,上下游引物为0.4 μL、10 μL、7.2 μL DEPC水及Taq DNA多聚酶。反应条件为:预变性(95 ℃,10 s)、变性(95 ℃,5 s)、退火(62 ℃,10 s)、延伸(72 ℃,10 s),循环30次。反应完成后,应用Bio-Rad iQ5方法分析Ct结果,分别检测各组目的基因和内参基因GAPDH的Ct值,即PCR反应指数增长初期荧光信号跨越阈值时的反应循环数。2-ΔΔCt法计算目的基因的相对表达量。
1.7Western blotting测定BV2小胶质细胞iNOS、CXCR5蛋白的变化 按上述实验分组处理小胶质细胞24 h后,收集细胞进行裂解。离心后取上清,BCA法检测样品蛋白浓度。经SDS-PSGE电泳分离蛋白,转至PVDF膜,用5% BSA的TTBS室温封闭2 h,封闭完毕后用TBST洗膜5次,加兔抗CXCR5、兔抗iNOS 4 ℃孵育过夜。然后加辣根过氧化物酶标记的抗兔IgG孵育1 h,洗膜5次后加入显色剂,在暗室内显影、定影。最后用Western blot荧光成像分析仪检测图像,以iNOS、CXCR5蛋白与GAPDH蛋白条带的灰度比值进行半定量分析。
1.8统计学方法 应用SPSS 19.0统计软件处理数据,计量资料比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2.1U87细胞来源外泌体的提取及鉴定 透射电子显微镜结果显示,U87-exo为直径30~100 nm的圆形微囊泡。Western blotting检测到外泌体上普遍表达的标志蛋白CD63、TSG101和Flotillin-1。
2.2荧光示踪验证细胞间的外泌体传递 为了进一步研究U87-exo是否可以转移到小胶质细胞中,CD63-GFP标记U87-exo,并在体外与BV2小胶质细胞温育,6 h后发现超过90%的BV2为GFP阳性,说明CD63-GFP成功转移到BV2小胶质细胞质中,CD63-GFP移动到细胞核周围的区域。表明U87-exo可以成功分离,并可以有效地转移到小胶质细胞中。
2.3外泌体促进 LPS诱导的小胶质细胞活化和细胞形态改变 在静息状态下,BV2细胞胞体较小,轴突细长。PBS对照组,BV2小胶质细胞均为正常形态,呈分支状,表面有许多小棘突:而经LPS刺激后,细胞胞体变大,突起变多变短,细胞变圆,呈“阿米巴样”,显著活化。LPS联合外泌体干预组中,干预后活化BV2小胶质细胞“阿米巴样”形态改善明显,部分仍可见分支样状态。随着外泌体浓度增加,活化BV2小胶质细胞的形态无明显改变。
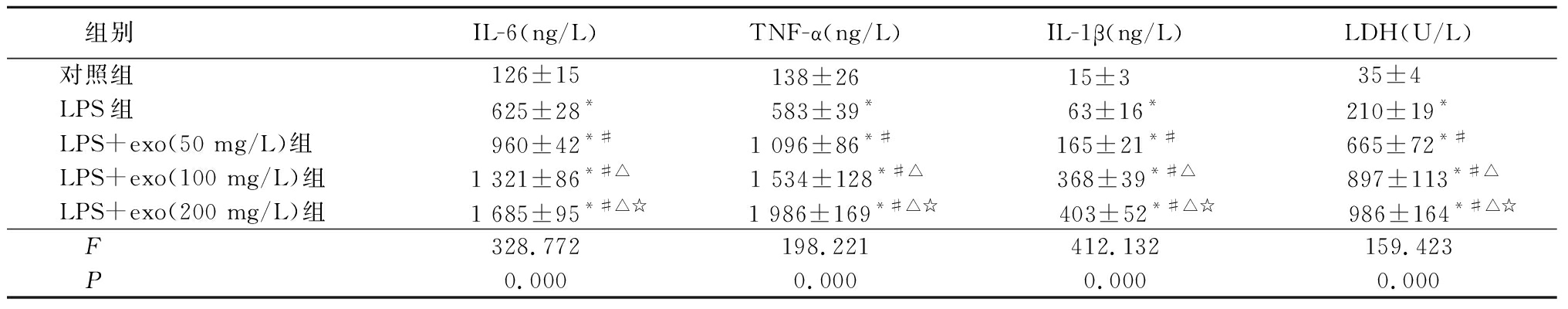
2.45组小胶质细胞LDH、TNF-α、IL-1β和IL-6浓度比较 LPS组、LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度明显高于对照组,LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度明显高于LPS组,LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度明显高于LPS+exo(50 mg/L)组,LPS+exo(200 mg/L)组的LDH、TNF-α、IL-1β和IL-6浓度明显高于LPS+exo(100 mg/L)组,差异均有统计学意义(P<0.05),见表1。
表15组小胶质细胞IL-6、TNF-α、IL-1β和LDH浓度比较
Table1ComparisonofIL-6,TNF-α,IL-1BandLDHlevelsin5groups(n=3,![]() ±s)
±s)

*P<0.05与对照组比较 #P<0.05与LPS组比较 △P<0.05与LPS+exo(50 mg/L)组比较 ☆P<0.05与LPS+exo(100 mg/L)组比较(SNK-q检验)
2.55组小胶质细胞iNOS mRNA、CXCR5 mRNA的表达比较 LPS组、LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的iNOS mRNA、CXCR5 mRNA表达明显高于对照组,LPS+exo(50 mg/L)组、LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的iNOS mRNA、CXCR5 mRNA表达明显高于LPS组,LPS+exo(100 mg/L)组、LPS+exo(200 mg/L)组的iNOS mRNA、CXCR5 mRNA表达明显高于LPS+exo(50 mg/L)组,LPS+exo(200 mg/L)组的iNOS mRNA表达明显高于LPS+exo(100 mg/L)组,CXCR5 mRNA表达明显低于LPS+exo(100 mg/L)组,差异均有统计学意义(P<0.05),见表2。
表25组小胶质细胞iNOS和CXCR-5mRNA表达比较
Table2ComparisonofiNOSandCXCR-5mRNAexpressionin5groups(n=3,![]() ±s)
±s)

*P<0.05与对照组比较 #P<0.05与LPS组比较 △P<0.05与LPS+exo(50 mg/L)组比较 ☆P<0.05与LPS+exo(100 mg/L)组比较(SNK-q检验)
2.6外泌体对小胶质细胞活化后iNOS、CXCR5蛋白表达的影响 与PBS对照组和单纯LPS刺激组相比,LPS联合U87-exo处理组BV2小胶质细胞的iNOS蛋白表达量升高,与PBS对照组和单纯LPS刺激组比较,LPS联合U87-exo处理组BV2小胶质细胞CXCR5蛋白的表达量明显升高。
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,虽然近年来治疗手段在不断进步,但其治疗效果一直欠佳。Hanahan等[1]认为炎症是肿瘤的基本特征,在恶性胶质瘤微环境中,有许多炎症细胞,这些炎症细胞是其发生、发展中不可缺少的组成部分,使得肿瘤细胞得以耐药、增殖和迁移。胶质瘤组织中浸润有大量的小胶质细胞,小胶质细胞在免疫抑制、炎症网络激活过程中扮演重要角色,并且能释放刺激因子促进肿瘤增殖和扩散[5]。小胶质细胞具有高度的可塑性,可根据所处微环境发生形态与功能改变,接受恶性胶质瘤细胞的驯化是小胶质细胞从抗肿瘤作用向促肿瘤恶性生物学行为转变的关键环节[6]。根据其功能状态可分为M1型和M2型活化,M1型活化时小胶质细胞主要表达iNOS、TNF-α、IL-1β和IL-6等促炎因子和趋化因子,促进组织炎症;M2型活化时小胶质细胞主要表达抗炎因子精氨酸酶、IL-10、TGF-β等,抑制免疫应答,促进神经修复[7-8]。TNF-α主要由活化的小胶质细胞/巨噬细胞产生,是一种很强的促炎因子,在调节机体免疫功能、炎症反应、细胞增殖、凋亡等过程中发挥着重要的作用;iNOS可作为细胞表面标志物以鉴定M1型小胶质细胞[9]。CXCR5是小胶质细胞活化的重要介质,过表达CXCR5,可以使小胶质细胞在体内定向迁移至炎症区域发挥炎症网络激活的能力[10]。本研究分析了在LPS诱导下不同浓度U87-exo对小胶质细胞活化的影响,炎症可以诱导小胶质细胞分泌LDH、TNF-α、IL-1β和IL-6增高,而U87-exo可以促进这些因子的分泌增高,呈明显的剂量依赖性。
肿瘤细胞在生长过程中释放了数百万携带着蛋白质和遗传内容物(mRNA、miRNA、LncRNA)的微囊泡,这些微囊泡就包括大量外泌体[4]。作为细胞间信息传递的载体,外泌体可以在人体中发挥调节作用。而肿瘤细胞来源的外泌体因其具有的独特成分可通过影响微环境、激发相关信号通路等方式参与肿瘤的恶性进展,使肿瘤在治疗过程中产生化疗抵抗[11-12]。为了研究GBM-exo对小胶质细胞炎症反应的作用,本研究用不同浓度的外泌体(50 mg/L,100 mg/L和200 mg/L)处理BV2 小胶质细胞 24 h,结果发现当外泌体浓度在50~100 mg/L之间时,炎症反应基因iNOS和CXCR5在小胶质细胞中的表达水平显著上调,在100~200 mg/L之间时,炎症因子的释放量达到平台期。这说明肿瘤细胞来源的外泌体运送到远端细胞时,外泌体可以保持遗传内容物的完整性,使其在受体细胞中发挥重要的调节作用,并显著促进炎症细胞的增殖及激活。研究表明,肿瘤细胞来源外泌体中的原癌miRNA的转移可以改变非癌细胞的生物学特性,而肿瘤抑制性miRNA的转移可以抑制肿瘤生长[13-14]。通过外泌体体外合成、人工干预从而抑制炎症网络激活有可能成为肿瘤治疗的潜在有效方法[15]。
综上所述, GBM-exo通过非细胞间接触的方式促进了小胶质细胞介导的炎症反应,促进了小胶质细胞分泌的炎症因子的表达。而且,多方面研究指出GBM-exo在肿瘤生长和侵袭中扮演重要角色,不仅参与炎症网络激活微环境的形成,并且能够促进肿瘤增殖和扩散[16]。虽然大量的研究已经报道过GBM-exo的信号传导作用[17],但其潜在机制仍然不是很清楚。本研究虽然初步证实了GBM-exo对小胶质细胞介导的炎症反应的促进作用,但是GBM-exo的数量与其发挥促进效应的关系及随着时间推移GBM-exo促进效应强弱的变化均有待于进一步研究,揭开GBM-exo在小胶质细胞活化、炎症网络激活和肿瘤化疗耐药中的作用及潜在机制的神秘面纱,将有可能为胶质瘤患者的治疗带来诱人的发展前景。
[参考文献]
[1] Hanahan D,Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell,2011,144(5):646-674.
[2] Fu R,Shen Q,Xu P,et al. Phagocytosis of microglia in the central nervous system diseases[J]. Mol Neurobiol,2014,49(3):1422-1434.
[3] Atretkhany KN,Drutskaya MS,Nedospasov SA,et al. Chemokines,cytokines and exosomes help tumors to shape inflammatory microenvironment[J]. Pharmacol Ther,2016,168:98-112.
[4] 刘长红,武明花,李桂源.肿瘤细胞来源的外泌体与恶性肿瘤的进展及化疗[J].中国生物化学与分子生物学报,2014,30(6):526-532.
[5] Annovazzi L,Mellai M,Bovio E,et al. Microglia immunophenotyping in gliomas[J]. Oncol Lett,2018,15(1):998-1006.
[6] 周济,易良.小胶质细胞与恶性胶质瘤相互关系的研究进展[J].国际神经病学神经外科学杂志,2013,40(4):384-387.
[7] Voisin P,Bouchaud V,Merle M,et al. Microglia in close vicinity of glioma cells:correlation between phenotype and metabolic alterations[J]. Front Neuroenergetics,2010,2:131.
[8] Li W,Graeber MB. The molecular profile of microglia under the influence of glioma[J]. Neuro Oncology,2012,14(8):958-978.
[9] 刘莎,宫蕊,吴明,等.hUCMSCs通过抑制星形胶质细胞活化引起的炎症因子表达改善Aβ损伤大鼠学习记忆能力[J].河北医科大学学报,2018,39(3):258-262.
[10] Hu F,a Dzaye OD,Hahn A,et al. Glioma-derived versican promotes tumor expansion via glioma-associated microglial/macrophages Toll-like receptor 2 signaling[J]. Neuro Oncol,2015,17(2):200-210.
[11] Liu YF,Gu Y,Cao XT. The exosomes in tumor immunity[J]. Oncoimmunology,2015,4(9):e1027472.
[12] Rooj AK,Mineo M,Godlewski J. MicroRNA and extracellular vesicles in glioblastoma:small but powerful[J]. Brain Tumor Pathol,2016,33(2):77-88.
[13] Shi R,Wang PY,Li XY,et al. Exosomal levels of miRNA-21 from cerebrospinal fluids associated with poor prognosis and tumor recurrence of glioma patients[J]. Oncotarget,2015,6(29):26971-26981.
[14] 王潇.miR-205通过靶向调控caspase-3表达调节神经胶质瘤的生物学行为[J].河北医科大学学报,2017,38(9):1024-1028,1032.
[15] Yang T,Martin P,Fogarty B,et al. Exosome delivered anticancer drugs across the blood-brain barrier for brain cancer therapy in Danio rerio[J]. Pharm Res,2015,32(6):2003-2014.
[16] Wei J,Gabrusiewicz K,Heimberger A. The controversial role of microglia in malignant gliomas [J]. Clin Dev Immunol,2013,2013:285246.
[17] Figueroa J,Phillips LM,Shahar T,et al. Exosomes from Glioma-Associated Mesenchymal Stem Cells Increase the Tumorigenicity of Glioma Stem-like Cells via Transfer of miR-1587[J]. Cancer Res,2017,77(21):5808-5819.
YANG Jian-kai1, QI Xue-jiao2, JIAO Bao-hua1, ZHAO Zong-mao1, LYU Zhong-qiang1, LI Chen1
(1.DepartmentofNeurosurgery,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China; 2.NeurologicalLaboratoryofHebeiProvince,Shijiazhuang050000,China)
[Abstract]ObjectiveTo investigate the role and mechanism of exosomes derived from glioblastoma multiforme cell(GBM-exo) in facilitating microglia-elicited activation of inflammatory network and chemotherapeutic resistance.MethodsU87 and BV2 cells were cultured, and exosomes derived from U87(U87-exo) was isolated. We labeled U87-exo with GFP, and added them to BV2 cell culture medium for monitoring cargo delivery. Except for PBS control group, BV2 microglias were treated with 1 mg/L lipopolysaccharides(LPS) and U87-exo at different concentrations, while they were divided into LPS group, LPS+exo(50 mg/L) group, LPS+exo(100 mg/L) group and LPS+exo(200 mg/L) group. Morphological changes of BV2 microglias in the five groups were observed after 24 h under phase-contrast microscoy. The BV2 cells and the cell cultured supernatant were harvested for detection of lactate dehydrogenase(LDH), tumor necrosis factor-α(TNF-α), interleukin 1β(IL-1β) and interleukin 6(IL-6) by ELISA, inducible nitric oxide synthesis(iNOS) and CXC chemokine receptor type 5(CXCR-5) mRNA level by RT-PCR, as well as protein expression changes by western blotting.ResultsU87-exo were transfered into BV2 cells and promoted microglia activation and morphological changes. Compared with control group, the levels of LDH, TNF-α, IL-1β, IL-6, iNOS mRNA and CXCR-5 mRNA were higher in LPS group, LPS+exo(50 mg/L) group, LPS+exo(100 mg/L) group and LPS+exo(200 mg/L) group(P<0.05). Compared with LPS group, the levels of LDH, TNF-α, IL-1β, IL-6, iNOS mRNA and CXCR-5 mRNA were higher in LPS+exo(50 mg/L) group, LPS+exo(100 mg/L) group and LPS+exo(200 mg/L) group(P<0.05). Compared with LPS+exo(50 mg/L) group, the levels of LDH, TNF-α, IL-1β, IL-6, iNOS mRNA and CXCR-5 mRNA were higher in LPS+exo(100 mg/L) group and LPS+exo(200 mg/L) group(P<0.05). Compared with LPS+exo(100 mg/L) group, the levels of LDH, TNF-α, IL-1β, IL-6 and iNOS mRNA were higher in LPS+exo(200 mg/L) group(P<0.05), while CXCR-5 mRNA were lower in LPS+exo(200 mg/L) group(P<0.05).ConclusionThese results proved that GBM-exo facilitated microglia-elicited activation of inflammatory network in microenvironment as well as chemotherapeutic resistance, which will provide a powerful basis for further understanding and treatment of glioma.
[Keywords]glioma; microglia; exosome
[作者简介]杨建凯(1983-),男,河北石家庄人,河北医科大学第二医院主治医师,医学博士,从事神经系统肿瘤诊治研究。
[基金项目]河北省自然科学基金项目(H2018206232);河北省医学科学研究重点课题(20180345);河北省青年拔尖人才计划项目(BJ2018060);河北医科大学第二医院科学研究基金项目(2h201814)
[修回日期]2018-08-19
[收稿日期]2018-07-16;
[文章编号]1007-3205(2018)11-1311-05
[文献标志码]A
[中图分类号]R730.264
(本文编辑:赵丽洁)