黄芪甲苷Ⅳ诱导SAMR1小鼠骨髓间充质干细胞分化为神经细胞的实验研究
李鹏涛1,高志红1,段晓亮2,张晓丽3,张 辉3*
(1.河北北方学院研究生学院,河北 张家口 075000;2.冀中能源峰峰集团总医院骨一科,河北 邯郸 056200;3.河北北方学院基础医学院,河北 张家口 075000)
[摘要]目的探讨黄芪甲苷Ⅳ可以体外诱导SAMR1小鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分化为神经细胞,证明其诱导作用对Notch-1和β-catenin的影响。方法采用全骨髓贴壁培养法培养SAMR1小鼠的BMSCs;流式细胞技术检测其CD29,CD34,CD90的表达;以0,20,40,80,160,320 g/L浓度黄芪甲苷Ⅳ诱导BMSCs,分别在0,1,6,12,24,48,72 h免疫荧光检测其NSE和Nestin的表达;Western blot检测诱导过程中Notch-1和β-catenin蛋白的表达;应用RT-qPCR检测诱导后Nestin、NSE、Notch-1、β-catenin mRNA的表达。结果SAMR1小鼠BMSCs培养至第3代,细胞基本呈长梭形,细胞体积增大,基本纯化;流式细胞技术检测CD29(+)、CD34(-)、CD90(+),证实其为BMSCs;通过对不同浓度诱导效果的统计分析得出,20,40,80 g/L黄芪甲苷Ⅳ诱导组(T1,T2,T3)诱导后,NSE和Nestin表达明显高于对照组,在组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),160,320 g/L(T4,T5)浓度组细胞出现死亡现象;诱导后1 h细胞开始表达NSE和Nestin,48 h后诱导效果明显下降, 6,12,24 h诱导效果较好,也无明显差异;40 g/L组诱导12 h神经细胞表达量最高。Western blot检测结果显示,诱导组Notch-1蛋白表达低于对照组,诱导组β-catenin 蛋白表达显著高于对照组;RT-qPCR结果显示,诱导后Nestin、NSE mRNA表达高于对照组(P<0.05),诱导组Notch-1 mRNA表达低于对照组(P<0.05),诱导组β-catenin mRNA表达高于对照组(P<0.05)。结论黄芪甲苷Ⅳ可以诱导SAMR1小鼠BMSCs体外分化为神经细胞, 40 g/L浓度诱导12 h效果较好。黄芪甲苷Ⅳ诱导分化过程中,通过提高β-catenin蛋白和mRNA的表达,抑制Notch1蛋白和mRNA的表达,从而促进BMSCs分化为神经细胞。
[关键词]阿尔茨海默病;间充质干细胞;小鼠 doi:10.3969/j.issn.1007-3205.2018.11.023
阿尔茨海默病(Alzheimer disease,AD)是一种以认知和记忆功能损害为特征,具有一定遗传倾向的中枢神经系统退行性疾病,并且患病率呈持续上升趋势[1-2]。随着人口老龄化程度的不断加剧,使得严重影响老年人生活质量的AD备受关注。目前,临床治疗AD的主要措施是控制AD症状及延缓病程,尚无有效的办法。新兴的细胞移植治疗方法,给AD的治疗提供了新的契机。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有易获得、成本低、排斥反应小及诱导分化效果好等优点,已有研究证实BMSCs移植可明显改善AD模型大鼠的症状。快速老化模型小鼠(senescence accelerated mouse,SAM)是从AKR/J系小鼠中培育出的快速老化模型,它具备稳定的老化病态特征和均一的遗传背景。SAMR1各项生理指标及生存期限与正常动物相似,常作为SAMP8的正常对照。黄芪作为我国常用的传统中药之一,基础研究证实它对AD具有一定的治疗效果,黄芪甲苷Ⅳ是黄芪的主要有效成分。本研究旨在证实黄芪甲苷Ⅳ可以诱导SAMR1小鼠BMSCs分化为神经细胞,确定诱导的最佳浓度和时间,并探讨黄芪甲苷Ⅳ诱导分化过程对Notch-1、β-catenin表达的影响。
1 材料与方法
1.1动物来源 SAMR1小鼠(SCXK(京)2016-0010),SPF级,雄性,4周龄,体重20~25 g,购于北京大学实验动物科学部。
1.2主要试剂 DMEM、胎牛血清(gibco公司);黄芪甲苷Ⅳ(sigma公司);Anti-mouse CD34FITC、Anti-mouse CD29FITC、 Anti-mouse CD90 PE(Thermo Fisher公司);Anti-NSE、Anti-nestin、Anti-Notch-1、Anti-βcatenin、Anti-βactin、Anti-rabbit IgG/HRP 、Goat Anti-rabbit IgG FITC、Goat Anti-rabbit IgG/Cy3、DAPI(Bioss公司);SDS-PAGE凝胶试剂盒、4×蛋白质上样缓冲液、蛋白抽提试剂(Solarbio公司);BCA蛋白浓度测定试剂盒(Bio Tool);Trizol(invitrogen公司);SuperReal PreMix Plus(SYBR Green)、FastQuant RT Kit(TIANGEN)。
1.3试验方法
1.3.1BMSCs培养 将SAMR1小鼠脱臼处死,75%酒精浸泡10 min,无菌条件下取小鼠胫腓骨,去除肌肉组织,用DMEM(含15%胎牛血清)充分冲洗骨髓腔,用7号针头将细胞吹打成单细胞悬液,以1×109/ L浓度接种于培养瓶中,置于37 ℃,5% CO2培养箱中,48 h首次换液,以后每2天换液1次,待细胞容合率达80%~90%时,去掉培养基,PBS洗1次,加入含EDTA的0.25%胰蛋白酶消化细胞,胎牛血清终止消化,充分吹打细胞并收集细胞悬液,1 500 r/min离心5 min,去上清,调整细胞浓度1×105浓度接种到培养瓶中,传至三代备用。
1.3.2流式细胞仪检测细胞免疫表型 取三代BMSCs,胰蛋白酶消化细胞,收集细胞,1 500 r/min离心5 min,去上清,PBS浸洗3遍,调整细胞浓度1×106置于5支流式管中,依次加入PBS、CD34FITC、CD29FITC、CD90 PE,PBS为对照。4 ℃避光30 min,离心弃上清,PBS浸洗2次,每管中加入500 μL PBS吹打成单细胞悬液,上流式细胞仪检测。
1.3.3黄芪甲苷Ⅳ诱导分化的BMSCs免疫细胞荧光检测 取黄芪甲苷Ⅳ(40 g/支)与DMEM(含15%胎牛血清)配置成0(C),20(T1),40(T2),80(T3),160(T4),320(T5) g/L浓度的诱导培养基备用。取三代BMSCs,胰蛋白酶消化收集细胞,调整细胞浓度1×105浓度接种于事先放置盖玻片的24孔板中,待细胞融合率达70%~80%,加入不同浓度的诱导培养基,分别于0,1,6,12,24,48,72 h取各组BMSCs细胞爬片,PBS洗3次,加入4%多聚甲醛固定15 min,PBS洗3次,滴加山羊血清,室温封闭30 min,吸掉封闭液,不洗,滴加1∶300稀释的一抗,放入湿盒,4 ℃过夜。次日,复温30 min,PBS-T浸洗玻片3遍,滴加1∶300稀释荧光二抗(此后均在避光处进行),湿盒中37 ℃孵育1 h,PBS-T浸洗玻片3次,滴加DAPI复染核,避光孵育5 min,PBS-T浸洗4遍,吸水纸吸干多余液体,用抗荧光猝灭的封片剂封片,共聚焦显微镜采集荧光图像,每组细胞40倍镜下选取9个视野进行阳性细胞计数分析。
1.3.4Western blot检测BMSCs诱导分化后Notch-1、β-catenin蛋白的表达 取三代BMSCs细胞,待细胞融合率达70%~80%,加入最适浓度黄芪甲苷Ⅳ进行诱导,对照组加正常培养基,诱导后提取各组细胞总蛋白,BCA上样检测蛋白浓度,经5%、12%凝胶电泳分离蛋白,每孔加15 μg蛋白,电转膜将蛋白条带转到PVDF膜上,2%脱脂奶粉摇床上封闭2 h,加Rabbit Anti-Notch-1、Anti-βcatenin、Anti-βactin一抗,4 ℃过夜,PBS-T充分洗涤后,加Goat Anti-rabbit IgG/HRP二抗,室温孵育2 h化学发光显色拍照记录,每组实验重复2次,蛋白条带用Image J软件进行吸光密度计数分析,结果用与内参比值的灰度值比表示。
1.3.5RT-qPCR检测Nestin、NSE、Notch-1、β-catenin mRNA的表达 提取诱导后诱导组和对照组细胞的总RNA,按照试剂盒说明及引物的反应条件进行反转录和目的基因Nestin、NSE、Notch-1、β-catenin扩增,β-actin为内参(表1),采用ABI7300 Real-Time检测仪完成Q-PCR,反应体系参照Yu等[3]方法。通过溶解曲线判定扩增产物特异性,以2-ΔΔCT方法计算mRNA的相对转录水平。进行数据分析。
表1RT-qPCR引物

基因上游/下游引物序列退火温度(℃)产物大小(bp)β-actinTGTCCACCTTCCAGCAGATGTAGCTCAGTAACAGTCCGCCTAGA 56.0200NestinTATGTCTGAGGCTCCCTATCCCTGTGGCTGCTTCTTTCTTTA55.5335NSETCCAGATAGTGGGCGATGACACAGTCCGACGACAAGA53.5227Notch-1TCAATGTTCGAGGACCAGATGTCACTGTTGCCTGTCTCAAG58.082β-cateninGAACCCAGAAG GCACAGACAGCGGGACACCTACTCTCATAC59.0354
1.4统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用重复测量的方差分析和两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
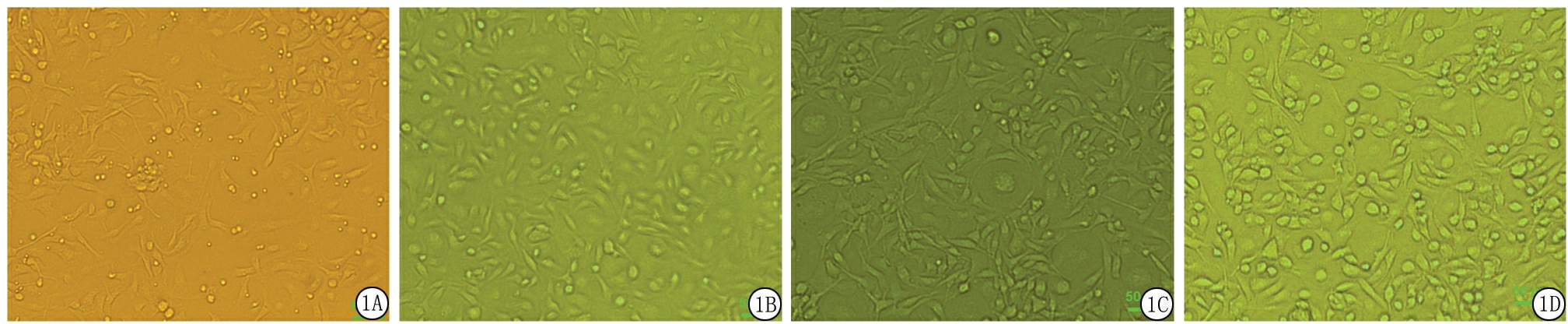
2.1BMSCs形态学观察 使用倒置显微镜观察培养瓶中原代BMSCs呈圆形,12 h后明显贴壁,24 h后细胞贴壁完成,大部分细胞呈短梭形,部分呈三角形及不规则形;首次换液后细胞生长迅速,逐渐呈长梭形,二、三代细胞呈长梭形,细胞体积增大(图1)。
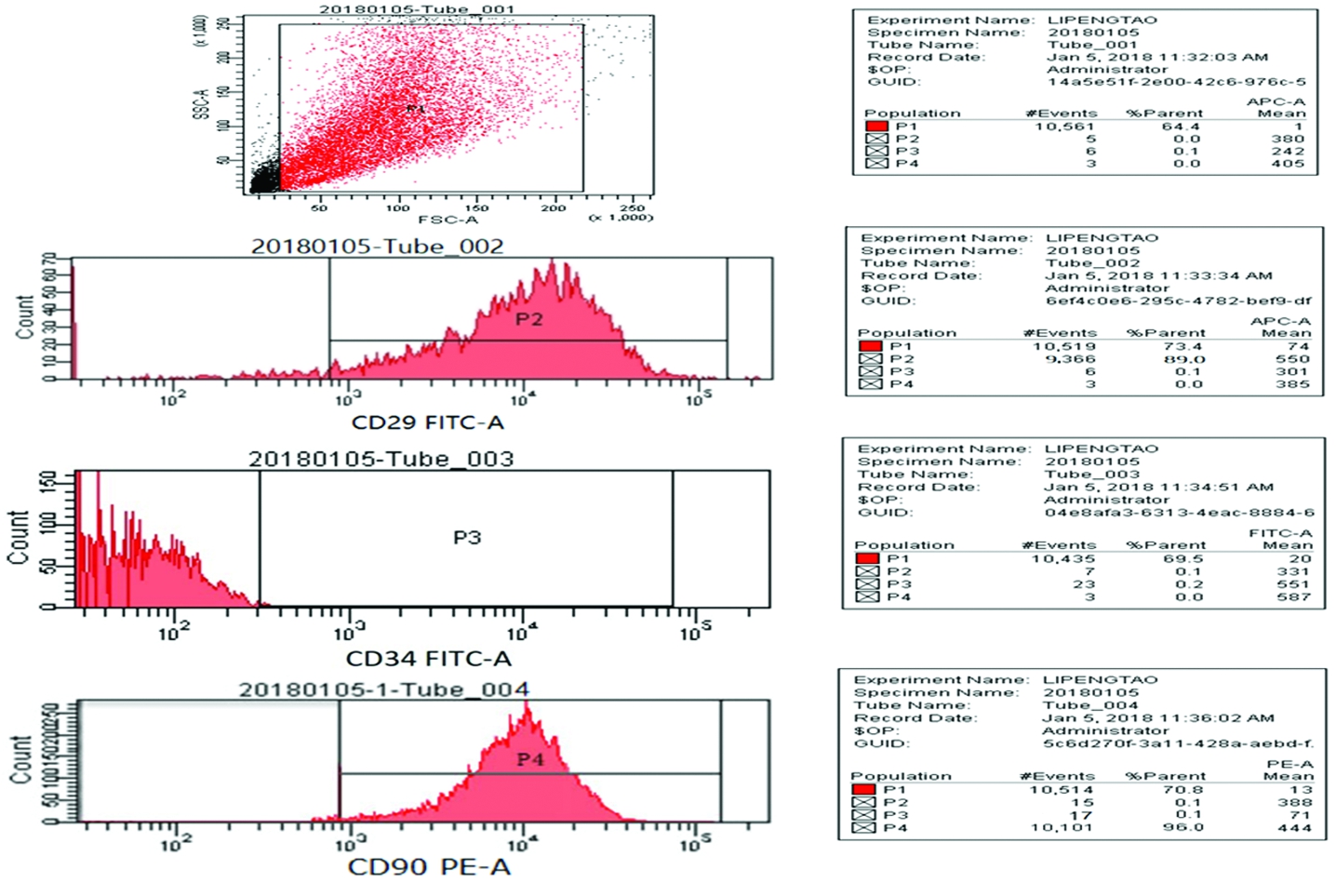
2.2BMSCs表面抗原鉴定 流式细胞仪对BMSCs表面抗原进行检测结果显示, CD29表达阳性(89.0%),CD34表达阴性(0.2%),CD90表达阳性(96.0%),结果显示所测细胞为BMSCs(图2)。
图1倒置显微镜下观察BMSCs形态
A.P0代4 d;B.P1代4 d;C.P2代5 d;D.P3代4 d
图2BMSCs流式细胞术检测其抗体表达
P2 CD29 FITC表达率为89%,P3 CD34 FITC表达率为0.2%,P4 CD90 PE阳性率为96.0%
2.3黄芪甲苷Ⅳ诱导后Nestin、NSE的表达 通过对不同时间不同浓度黄芪甲苷Ⅳ诱导BMSCs后NSE、Nestin表达检测发现,20,40,80 g/L浓度黄芪甲苷分别在6,12,24 h诱导效果好,在组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.01),见表2,3。
表2黄芪甲苷Ⅳ诱导后NSE表达(n=9,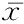 ±s,%)
±s,%)
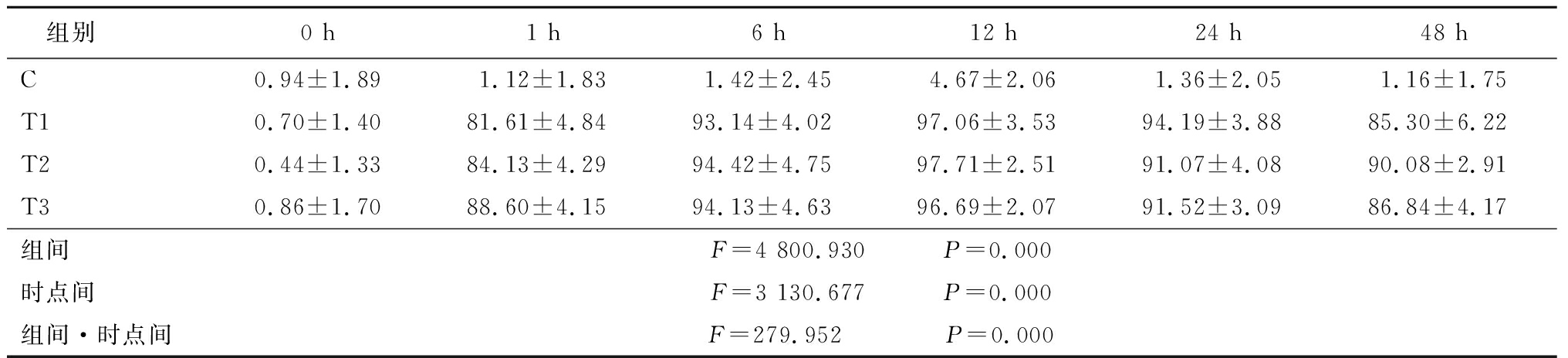
组别0 h1 h6 h12 h24 h48 hC0.94±1.891.12±1.831.42±2.454.67±2.06 1.36±2.05 1.16±1.75T10.70±1.4081.61±4.8493.14±4.0297.06±3.5394.19±3.8885.30±6.22T20.44±1.3384.13±4.2994.42±4.7597.71±2.5191.07±4.0890.08±2.91T30.86±1.7088.60±4.1594.13±4.6396.69±2.0791.52±3.0986.84±4.17组间F=4 800.930 P=0.000时点间F=3 130.677 P=0.000组间·时点间F=279.952 P=0.000
表3黄芪甲苷Ⅳ诱导后Nestin表达(n=9,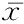 ±s,%)
±s,%)
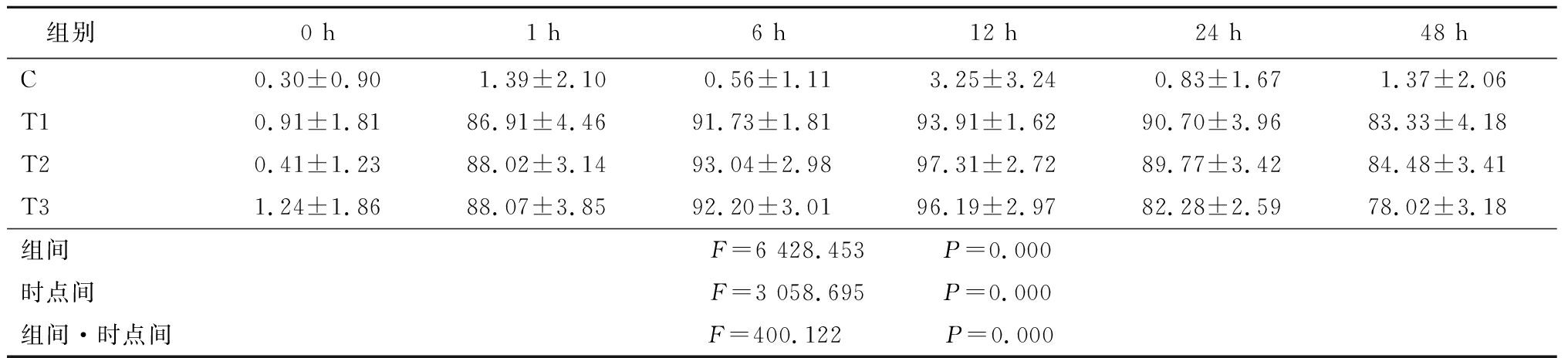
组别0 h1 h6 h12 h24 h48 hC0.30±0.901.39±2.100.56±1.113.25±3.240.83±1.671.37±2.06T10.91±1.8186.91±4.4691.73±1.8193.91±1.6290.70±3.9683.33±4.18T20.41±1.2388.02±3.1493.04±2.9897.31±2.7289.77±3.4284.48±3.41T31.24±1.8688.07±3.8592.20±3.0196.19±2.9782.28±2.5978.02±3.18组间F=6 428.453 P=0.000时点间F=3 058.695 P=0.000组间·时点间F=400.122 P=0.000
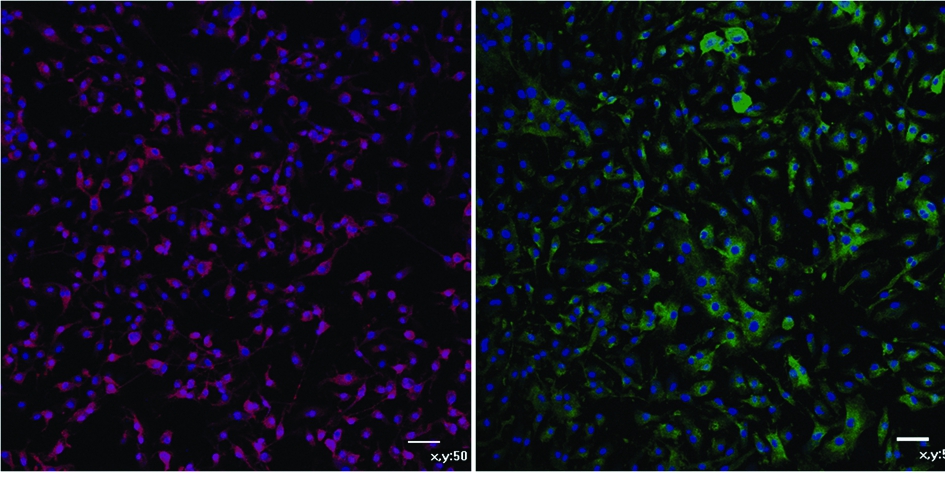
160,320 g/L浓度1,6 h诱导效果明显,12 h及超过12 h细胞出现死亡现象。黄芪甲苷Ⅳ浓度40 g/L(T2)诱导12 h后细胞形态呈现不规则形,相互之间形成网状,呈现为神经细胞的形态特征(图3)。
图3黄芪甲苷Ⅳ40g/L诱导12h后细胞NSE和Nestin表达
2.4黄芪甲苷Ⅳ诱导BMSCs后Notch1、β-catenin蛋白的表达 40 g/L黄芪甲苷Ⅳ诱导后12 h诱导结果较好,诱导12 h后诱导组Notch1的蛋白表达量显著低于对照组(P<0.05),β-catenin蛋白的表达量显著高于对照组(P<0.05),见表4。
表4对照组与诱导组Notch-1、β-catenin蛋白表达比较(n=3,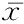 ±s)
±s)
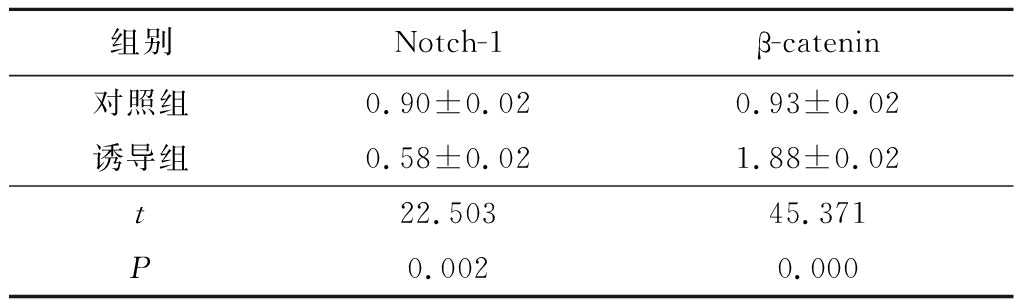
组别Notch-1β-catenin对照组 0.90±0.020.93±0.02诱导组0.58±0.021.88±0.02t22.50345.371P0.0020.000
2.5黄芪甲苷Ⅳ诱导BMSCs后Nestin、NSE、Notch-1、β-catenin mRNA的表达 经40 g/L黄芪甲苷Ⅳ诱导后12 h,诱导组Nestin、NSE、β-catenin mRNA表达均高于对照组(P<0.05),Notch-1 mRNA表达低于对照组(P<0.05),见表5。
表5对照组与诱导组Nestin、NSE、Notch-1、β-cateninmRNA表达比较(n=3,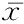 ±s)
±s)
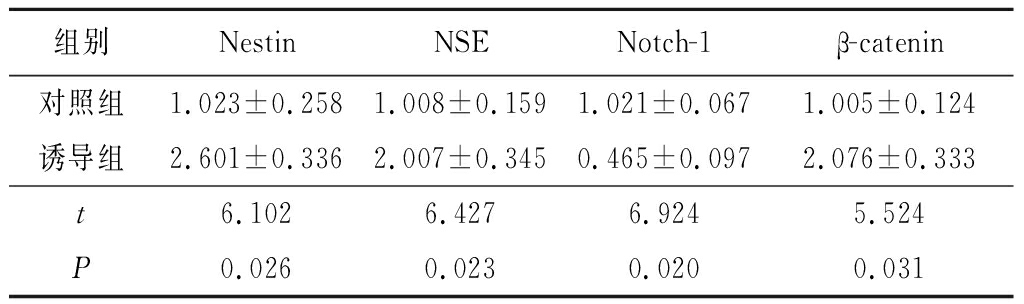
组别NestinNSENotch-1 β-catenin 对照组1.023±0.2581.008±0.1591.021±0.0671.005±0.124诱导组2.601±0.3362.007±0.3450.465±0.0972.076±0.333t6.1026.4276.9245.524P0.0260.0230.0200.031
3 讨 论
AD被认为是引发神经认知功能障碍最常见的原因,严重影响老年人的生活质量,成为一种日益迫切的全球公共卫生、社会、政治和经济问题。AD具有一定的遗传性,目前临床尚无治愈的方法,治疗主要为控制病程的发展或减轻症状。AD的发病机制尚不十分清楚,除研究最多的β淀粉样蛋白沉积和tau蛋白过度磷酸化以外[4],最新研究表明AD的发病与抑郁有关。Quattropani等[5]研究显示,抑郁发作的频率和严重程度与痴呆的发生风险相关。Z dori等[6]研究表明,AD的病理机制涉及线粒体紊乱、谷氨酸兴奋毒性和神经炎症。
dori等[6]研究表明,AD的病理机制涉及线粒体紊乱、谷氨酸兴奋毒性和神经炎症。
AD治疗除了传统的临床药物治疗之外,近期Szablewski等[7]研究表明,调节肠道微生物群的组成,也可以降低发生AD的风险,减缓AD的进展。Fang等[8]的研究表明,抗神经炎性药物治疗AD有效。最新研究显示,回忆疗法、新的药物、中医针灸疗法及纳米疗法等,对AD有一定的治疗意义[9]。随着干细胞研究的兴起,干细胞移植治疗各种疾病逐渐应用于临床,干细胞在治疗神经系统疾病中的疗效已得到证实,如干细胞在治疗多发性硬化症、亨廷顿病等方面表现出良好的治疗效果[10]。BMSCs可分化为神经细胞已得到证实,因其具有易获得、移植排斥反应小、分化效果好等优点,是目前研究较多的干细胞之一。在基础研究中,BMSCs移植治疗AD模型动物已得到证实,为治愈AD提供了新的契机。最近,de Godoy等[11]研究表明,MSC及MSC衍生的细胞外囊泡,可保护神经元免受β淀粉样蛋白诱导的氧化应激和突触损伤。衰老过程是遗传因素和环境因素共同作用的结果。目前,关于衰老过程的分子机制尚未明确。衰老的主要特征是随年龄的增加使生理完整性丧失,容易导致功能受损和易患疾病程度增加[12]。SAM是AKR/J家族自交系小鼠,其中包括9个衰老倾向系小鼠(senescence-accelerated mouse prone,SAMP)和4个抗衰老倾向系小鼠(senescence-accelerated mouse resistance,SAMR)[13]。SAMR系小鼠表现出正常衰老特征,而SAMP系小鼠表现出快速老化表型,如寿命缩短及各种老年病理变化特征[14]。目前,SAMP系小鼠已成为研究AD的模型小鼠。随着细胞移植研究和技术的不断发展,将正常衰老模型SAMR系小鼠的BMSCs,移植入快速老化模型SAMP系小鼠,可以为AD的治疗提供新的基础研究证据。
黄芪是中医中药传统的补气中药之一,广泛应用于临床。黄芪的主要成分是多糖、类黄酮和皂苷。研究显示,黄芪具有抗炎、抗纤维化、抗氧化、抗病毒等作用[15];也有研究表明,黄芪可以调节局部炎症状态,增强神经再生,促进外周神经损伤的恢复[16]。黄芪甲苷Ⅳ是黄芪有效成分之一的药物纯化品,具有抑制炎症、抗氧化、抑制细胞凋亡等作用,还对心脏和肠胃有一定的保护作用[17]。在中枢神经系统中,黄芪甲苷Ⅳ已被证实可促进脑缺血再灌注损伤后的神经修复,在小鼠海马区可促进突触的生长,减缓神经萎缩和记忆力的减退[18]。Hu等[19]研究表明,黄芪甲苷Ⅳ可通过促进Notch信号通路,促进神经干细胞的增殖和分化,提高AD模型动物的学习记忆能力。
BMSCs可诱导分化为神经细胞的研究很多,但其具体的作用机制尚未明确。MiR124和Notch-1在神经细胞分化中承担着重要角色,研究表明MiR124和Notch信号之间,通过反馈作用调节周围神经的发育[20]。Jia等[21]研究显示,Notch-1信号通路在BMSCs分化为神经细胞过程中发挥重要作用,运用药物或基因沉默Notch信号通路,可促进BMSCs分化为神经元。Xing等[22]研究表明,当hMSC被诱导分化成神经细胞时,Notch信号分子表达被抑制,低水平的Notch信号被激活,有助于神经细胞的分化。Wang等[23]在ATRA诱导神经干细胞分化为神经元的实验中发现Notch-1基因表达明显下降。此外,Zhong等[24]研究显示,黄芪注射液可诱导MSCs分化为神经元样细胞,分化过程可能是通过激活Wnt信号通路介导的。研究表明,汉黄芩素通过抑制Notch-1信号传导,诱导骨髓干细胞分化为视网膜神经元样细胞[25]。本研究在检测黄芪甲苷Ⅳ诱导细胞分化中发现,BMSCs的Notch1和β-catenin的表达明显不同;Notch1蛋白和基因的表达在12 h比对照组明显下降,而β-catenin蛋白和基因表达显著上升。表明黄芪甲苷Ⅳ通过高表达β-catenin,抑制Notch1蛋白表达,促进BMSCs向神经细胞分化。
本研究针对黄芪甲苷Ⅳ是否可以在体外诱导SAMR1小鼠BMSCs分化为神经细胞及其适宜浓度和时间的实验结果表明:黄芪甲苷Ⅳ可体外诱导SAMR1小鼠BMSCs分化为神经细胞,40 g/L浓度的黄芪甲苷Ⅳ在12 h诱导效果最好,显微镜下可见神经细胞突起伸长并相互连接成网,神经细胞特异性表达的NSE和Nestin表达明显高于对照组;诱导后Nestin、NSE mRNA的表达也明显增加,证明黄芪甲苷Ⅳ可体外诱导SAMR1小鼠BMSCs分化为神经细胞;诱导后Notch-1蛋白和mRNA表达较对照组明显降低,β-catenin蛋白和mRNA显著升高,证明黄芪甲苷Ⅳ通过抑制Notch-1通道、激活β-catenin通道,促进BMSCs分化为神经细胞,将为SAMR1小鼠BMSCs移植入AD小鼠模型SAMP8小鼠海马区和治疗AD的深入研究提供理论和实验基础。
[参考文献]
[1] Dorninger F,Moser AB,Kou J,et al. Alterations in the plasma levels of specific choline phospholipids in Alzheimer′s disease mimic accelerated aging[J]. J Alzheimers Dis,2018,62(2):841-854.
[2] Kumar D,Ganeshpurkar A,Kumar D,et al. Secretase inhibitors for the treatment of Alzheimer′s disease:long road ahead[J]. Eur J Med Chem,2018,148:436-452.
[3] Yu X,Liu S,Li J,et al. MicroRNA-572 improves early post-operative cognitive dysfunction by down-regulating neural cell adhesion molecule 1[J].PLoS One,2015,10(2):e0118511.
[4] Carmona S,Hardy J,Guerreiro R. The genetic landscape of Alzheimer disease[J]. Handb Clin Neurol,2018,148:395-408.
[5] Quattropani MC,Lenzo V,Armieri V,et al. The origin of depression in Alzheimer disease:a systematic review[J]. Riv Psichiatr,2018,53(1):18-30.
[6] Z dori D,Veres G,Szal
dori D,Veres G,Szal rdy L,et al. Alzheimer′s Disease:Recent Concepts on the Relation of Mitochondrial Disturbances,Excitotoxicity,Neuroinflammation,and Kynurenines[J]. J Alzheimers Dis,2018,62(2):523-547.
rdy L,et al. Alzheimer′s Disease:Recent Concepts on the Relation of Mitochondrial Disturbances,Excitotoxicity,Neuroinflammation,and Kynurenines[J]. J Alzheimers Dis,2018,62(2):523-547.
[7] Szablewski L. Human Gut Microbiota in Health and Alzheimer′s Disease[J]. J Alzheimers Dis,2018,62(2):549-560.
[8] Fang Y,Xia W,Cheng B,et al. Design,synthesis,and biological evaluation of compounds with a new scaffold as anti-neuroinflammatory agents for the treatment of Alzheimer′s disease[J]. Eur J Med Chem,2018,149:129-138.
[9] Li M,Lyu JH,Zhang Y,et al. The clinical efficacy of reminiscence therapy in patients with mild-to-moderate Alzheimer disease:study protocol for a randomized parallel-design controlled trial[J]. Medicine(Baltimore),2017,96(51):e9381.
[10] Lin YT,Chern Y,Shen CKJ,et al. Human mesenchymal stem cells prolong survival and ameliorate motor deficit through trophic support in Huntington′s disease mouse models[J]. PLoS One,2011,6(8):e22924.
[11] de Godoy MA,Saraiva LM,de Carvalho LRP,et al. Mesenchymal stem cells and cell-derived extracellular vesicles protect hippocampal neurons from oxidative stress and synapse damage induced by amyloid-β oligomers[J]. J Biol Chem,2018,293(6):1957-1975.
[12] Lopez-Otin C,Blasco MA,Partridge L,et al. The hallmarks of aging[J]. Cell,2013,153(6):1194-1217.
[13] Takeda T,Hosokawa M,Higuchi K. Senescence-accelerated mouse(SAM):a novel murine model of senescence[J]. Exp Gerontol,1997,32(1/2):105-109.
[14] Takeda T,Matsushita T,Kurozumi M,et al. Pathobiology of the senescence-accelerated mouse(SAM) [J]. Exp Gerontol,1997,32(1/2):117-127.
[15] Liu P,Zhao H,Luo Y. Anti-Aging Implications of Astragalus Membranaceus(Huangqi):A Well-Known Chinese Tonic[J]. Aging Dis,2017,8(6):868-886.
[16] Chen CC,Chang LC,Yao CH,et al. Increased Calcitonin Gene-Related Peptide and Macrophages Are Involved in Astragalus membranaceus-Mediated Peripheral Nerve Regeneration in Rats[J]. Am J Chin Med,2018,46(1):69-86.
[17] Zhu SQ,Qi L,Rui YF,et al. Astragaloside Ⅳ inhibits spontaneous synaptic transmission and synchronized Ca2+oscillations on hippocampal neurons[J]. Acta Pharmacol Sin,2008,29(1):57-64.
[18] Tohda C,Tamura T,Matsuyama S,et al. Promotion of axonal maturation and prevention of memory loss in mice by extracts of Astragalus mongholicus[J]. Br J Pharmacol,2006,149(5):532-541.
[19] Hu HY,Yang RS,Jin GQ,et al.Effect of Astragaloside Ⅳ on Neural Stem Cell Transplantation in Alzheimer′s Disease Rat Models[J]. Evid Based Complement Alternat Med,2016,2016:3106980.
[20] Chen JS,Pedro MS,Zeller RW. miR-124 function during ciona intestinalis neuronal development includes extensive interaction with the notch signaling pathway[J]. Development,2011,138:4943-4953.
[21] Jia YJ,Sun JP,Zhou Y,et al. Effects of Notch-1 signaling pathway on differentiation of marrow mesenchymal stem cells into neurons in vitro[J]. Neutoreport,2007,18(14):1443-1447.
[22] Xing Y,Bai RY,Yan XF,et al. Expression changes of Notch-related genes during the differentiation of human mesenchymal stem into neurons[J]. Sheng Li Xue Bao,2007,59(3):267-272.
[23] Wang F,Li ST,Huang Q,et al. Expression of Notch1 gene in the differentiation of the human embryonic neural stem cells to neurons[J]. Xi Bao Fen Zi Mian Yi Za Zhi,2004,20(6):769-772.
[24] Zhong J,Cao H,Chen Z,et al. Wnt signaling pathways participate in Astragalus injection-induced differentiation of bone marrow mesenchymal stem cells[J]. Neurosci Lett,2013,553:29-34.
[25] Shu Q,Zhuang H,Fan J,et al. Wogonin induces retinal neuron-like differentiation of bone marrow stem cells by inhibiting Notch-1 signaling[J]. Oncotarget,2017,8(17):28431-28441.
*通讯作者。E-mail:zhanghui6312@126.com
[作者简介]李鹏涛(1991-),男,河北邯郸人,河北北方学院研究生学院医学硕士研究生,从事神经损伤与修复研究。
[基金项目]河北省高等学校科学技术研究项目(ZD2014067);河北北方学院创新人才培育项目(CXRC1327)
[修回日期]2018-06-04
[收稿日期]2018-04-11;
[文章编号]1007-3205(2018)11-1338-06
[文献标志码]B
[中图分类号]R745.7
(本文编辑:刘斯静)





 dori等
dori等 dori D,Veres G,Szal
dori D,Veres G,Szal