糖尿病足是糖尿病患者主要慢性并发症之一,与长期血糖控制不佳、糖尿病周围神经病变、糖尿病周围血管病变及局部感染有关[1-2]。早期糖尿病足如不能得到积极有效的控制,最终将导致溃疡、坏疽甚至截肢。10%~15%的糖尿病患者会并发糖尿病足,需要截肢的糖尿病足患者比例高达15%[3-4]。这不仅使患者的生活质量严重下降,同时给社会及家庭带来沉重的经济负担。糖尿病足合并感染可影响糖尿病足溃疡愈合,发展为坏疽,骨髓炎甚至是截肢的重要原因。糖尿病足患者局部血运差、免疫防御机制受损等,导致感染不易清除。同时多种炎症因子的参与,导致全身炎症反应进一步影响糖尿病足的愈合[5-6]。银离子敷料在糖尿病足溃疡面可以形成局部抗菌环境,减少细菌感染机会,进而减少局部分泌物,具有杀菌抑菌及吸收伤口渗液作用[7]。水凝胶可使糖尿病足的坏死组织自溶,具有促进糖尿病足伤口愈合作用[8]。本研究联合银离子敷料和水凝胶疗法应用于糖尿病足患者,观察其疗效及对相关血清炎症因子的影响,报告如下。
1 资料与方法
1.1 一般资料 收集2016年2月—2017年2月就诊于中国人民解放军第四六三医院的糖尿病足患者72例,随机分为观察组和对照组各36例。观察组男性20例,女性16例,年龄55~75岁,平均(63.53±6.35)岁。对照组男性19例,女性17例,年龄57~75岁,平均(64.34±6.39)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
患者或家属均签署知情同意书。
1.2 纳入标准和排除标准 纳入标准:①符合2011年《糖尿病足国际临床指南》[9]中糖尿病足的诊断标准;②糖尿病足Wagner分级为Ⅱ~Ⅳ级。排除标准:①严重心肺功能不全者;②严重出凝血功能障碍者;③恶性肿瘤者;④对敷料过敏者;⑤依存性差不能配合者。
1.3 治疗 患者均给予糖尿病饮食,积极控制血糖,营养神经,改善微循环,对足部感染创面分泌物进行细菌培养及药敏试验,选择合理抗菌药物抗感染,双氧水清洗创面,负压吸引等常规治疗。对照组创面清洗后,首先给予水凝胶蚕食清创1次/d,待局部坏死组织完全清除,长出新鲜肉芽组织后,予以覆盖湿疗伤口敷料1次/d。观察组创面清洗后,首先同样使用水凝胶蚕食清创1次/d,但清创后在水凝胶上层再立即加以覆盖银离子敷料1次/d。试验终点为患者糖尿病足痊愈或治疗30 d后。
1.4 疗效评定 对比2组糖尿病足溃疡清创时间、肉芽组织生长时间、上皮组织形成时间。分别于治疗前、糖尿病足痊愈、治疗30 d后,观察2组患者糖尿病足溃疡情况,计算溃疡愈合率。溃疡愈合率=(原溃疡范围-现溃疡范围)/原溃疡范围×100%。溃疡愈合率大于40%为有效;大于90%为基本愈合;100%为完全愈合。总有效率=(完全愈合+基本愈合+有效)/总例数。
1.5 下肢动脉病变评分 由医院2名高年资超声科医师分别对2组治疗前、糖尿病足痊愈、治疗30 d后对患者行双下肢动脉彩色超声检查。测定髂总动脉、髂外动脉、股浅动脉、腘动脉、胫前动脉、腓动脉、胫后动脉和足背动脉。髂总动脉、髂外动脉、股浅动脉及腘动脉每条动脉狭窄50%~75%各记1分,大于75%记2分,完全闭塞记3分。胫前动脉、腓动脉、胫后动脉及足背动脉每条动脉狭窄大于50%各记1分,完全闭塞记2分。如同一血管弥漫性狭窄以最严重处为积分标准[10]。
1.6 血清炎症因子水平测定 留取所有患者治疗前、糖尿病足痊愈、治疗30 d后空腹静脉血,以3 500 r/min, 离心10 min,留取上清液置于-70 ℃保存,待检。采用酶联免疫吸附测定法分别测定血管内皮黏附分子1(vascular endothelial adhesion molecule-1,VCAM-1)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子水平。采用免疫透射比浊法测定C反应蛋白(C-reactive protein,CRP)水平。
1.7 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验和配对t检验;计数资料比较采用χ2检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组治疗后各项时间比较 观察组清创时间、肉芽组织形成时间和上皮组织形成时间均少于对照组,差异有统计学意义(P<0.05),见表1。
表1 2组治疗后各项时间比较
Table 1 Comparison of time after treatment between two groups![]()
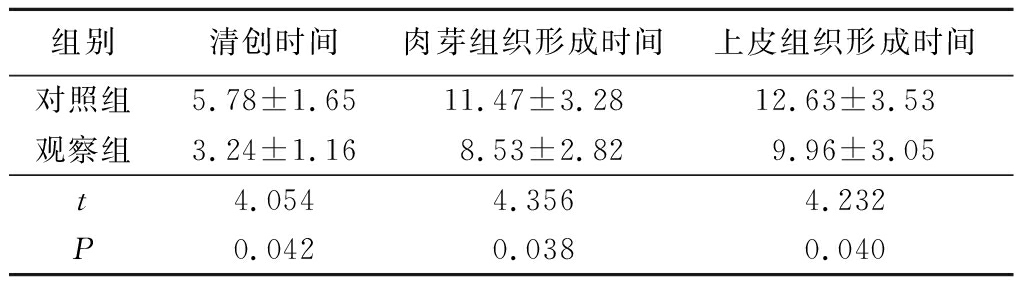
组别清创时间肉芽组织形成时间上皮组织形成时间 对照组5.78±1.6511.47±3.2812.63±3.53观察组3.24±1.168.53±2.829.96±3.05t4.0544.3564.232P0.0420.0380.040
2.2 2组临床疗效比较 观察组临床疗效及治疗总有效率优于或高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 2组临床疗效比较
Table 2 Comparison of clinical effects between two groups (n=36,例数,%)
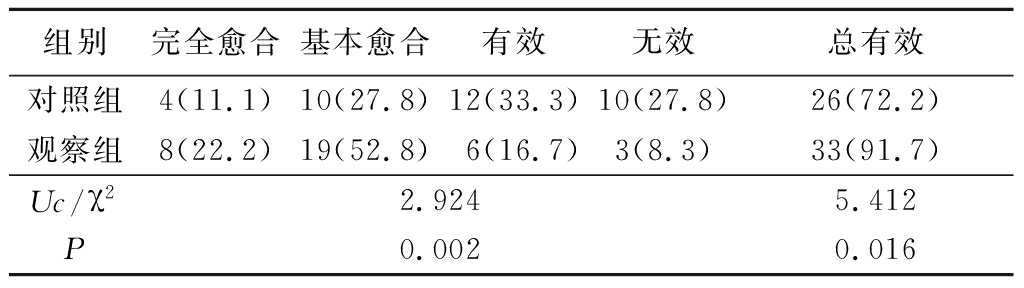
组别完全愈合基本愈合有效无效总有效对照组4(11.1)10(27.8)12(33.3)10(27.8)26(72.2)观察组8(22.2)19(52.8)6(16.7)3(8.3)33(91.7)Uc/χ22.9245.412P0.0020.016
2.3 2组治疗前后下肢动脉病变评分比较 治疗前2组下肢动脉病变评分差异无统计学意义P>0.05);治疗后2组下肢动脉病变评分均低于治疗前,差异有统计学意义(P<0.05),且观察组下肢动脉病变评分低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 2组治疗前后下肢动脉病变评分比较
Table 3 Comparison of lower extremity arterial lesion scores before and after treatment between two groups ![]() 分)
分)
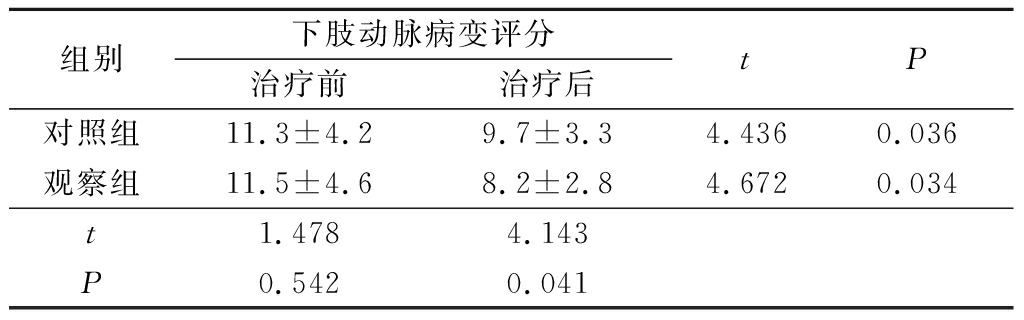
组别下肢动脉病变评分治疗前治疗后tP对照组11.3±4.29.7±3.34.4360.036观察组11.5±4.68.2±2.84.6720.034t1.4784.143P0.5420.041
2.4 2组治疗前后相关血清炎症因子比较 治疗前2组VCAM-1、TNF-α、IL-6及CRP水平差异均无统计学意义(P>0.05);治疗后2组VCAM-1、TNF-α、CRP水平均低于治疗前,差异有统计学意义(P<0.05),治疗后对照组IL-6较治疗前升高,观察组治疗后IL-6较治疗前降低,治疗后观察组VCAM-1、TNF-α、IL-6及CRP水平低于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 2组治疗前后血清炎症细胞因子水平比较
Table 4 Comparison of serum cytokine levels before and after treatment between two groups![]()
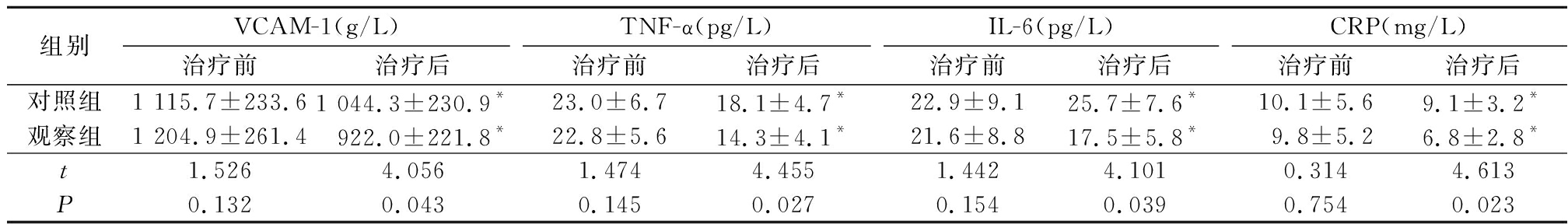
组别VCAM-1(g/L)治疗前治疗后TNF-α(pg/L)治疗前治疗后IL-6(pg/L)治疗前治疗后CRP(mg/L)治疗前治疗后对照组1 115.7±233.61 044.3±230.9*23.0±6.718.1±4.7*22.9±9.125.7±7.6*10.1±5.69.1±3.2*观察组1 204.9±261.4922.0±221.8*22.8±5.614.3±4.1*21.6±8.817.5±5.8*9.8±5.26.8±2.8*t1.5264.0561.4744.4551.4424.1010.3144.613P0.1320.0430.1450.0270.1540.0390.7540.023
*P<0.05与治疗前比较(配对t检验)
3 讨 论
随着糖尿病患者数量的激增,糖尿病足患者的数量也呈不断上升趋势。糖尿病足为糖尿病的严重慢性并发症之一,是下肢神经病变、血管病变和感染共同作用的结果,治疗困难,致残率高。在骨科需要截肢的患者当中,约有80%是由糖尿病足引起的[11]。 合并局部感染是影响糖尿病足恢复的主要危险因素。局部炎症反应是机体受到有害刺激后产生的保护反应,但过度的炎症反应可导致全身炎症反应对机体产生损害。Gilligan等[12]研究显示高浓度的炎症因子与溃疡难以愈合密切相关。通过有效控制炎症反应,减轻糖尿病足局部感染是治疗糖尿病足的有效途径。
动脉粥样硬化是糖尿病下肢动脉病变主要病理改变。而血管内膜损伤是动脉粥样硬化发病重要机制。内膜损伤可以激活多种炎症因子及细胞黏附分子,从而导致炎症反应。因此,炎症反应在动脉粥样硬化的发生发展中具有重要作用[13]。IL-6、TNF-α、CRP均为炎症反应指标。 IL-6是糖尿病足炎症急性期合成的重要促炎性反应细胞因子,IL-6的大量生成会进一步诱导免疫细胞分化,导致其他多种炎症细胞因子释放增多,促进自身抗体的形成,从而导致自身免疫性疾病[14-16]。TNF-α是糖尿病足重要的炎症递质,早期适量的TNF-α具有参与炎症反应,调节免疫应答,诱导细胞凋亡等保护作用;但过量的TNF-α可以促进其他多种炎性因子生成,介导糖尿病足局部炎症反应,甚至出现多系统受损[15-16]。CRP是一种糖尿病足急性时相蛋白,可以诱导内皮细胞等分泌多种炎性介质。CRP水平与糖尿病足感染严重程度呈正相关[17]。VCAM-1属于黏附分子中免疫球蛋白超家族。在糖尿病足局部炎症过程中,VCAM-1可以启动炎症细胞,促使炎症细胞黏附于血管内皮细胞,通过血管壁进入炎症部位,导致炎症迁延和加重[18]。
银离子敷料中的银离子具有广谱杀菌及抑菌作用,有效作用时间长,不易产生耐药性和抗药性,且安全无害,不经过体内代谢。同时银离子敷料可进一步吸收伤口渗液[19]。水凝胶主要成分为羟甲基纤维素及藻酸钙,具有伤口水合作用,可为糖尿病足溃疡面提供湿润环境,利于坏死组织自溶,促进溃疡局部肉芽组织生长,加速溃疡面愈合。但是在溃疡面分泌物较多时,水凝胶可导致伤口浸渍,影响愈合[20]。
本研究结果显示观察组清创时间、肉芽组织形成时间、上皮组织形成时间均少于对照组,临床疗效和总有效率均优于或高于对照组,表明银离子敷料联合水凝胶治疗可进一步提高糖尿病患者疗效和改善预后;治疗后2组平均下肢动脉病变评分、VCAM-1、TNF-α及CRP水平均较治疗前下降,且观察组低于对照组,表明银离子敷料联合水凝胶可改善糖尿病足患者下肢动脉病变,清除血清炎症因子,改善全身炎症反应。银离子敷料联合水凝胶治疗糖尿病足,水凝胶可以为创面提供湿润的修复环境。而在水凝胶上层再覆盖银离子敷料紧密与创面相贴,形成局部无死腔的抗菌环境,能有效杀菌抑菌,减少局部感染及炎症反应。两者共同作用,有效地促进了肉芽组织的生长和组织的修复,进一步促进糖尿病足的愈合。这可能是银离子敷料联合水凝胶进一步改善糖尿病足患者预后的机制。本研究所采用的联合治疗值得临床推广应用。
本研究尚存在不足,如样本量偏少,远期随访不足,可能对研究结果产生影响,有待于今后进一步行多中心的研究。
[1] 徐俊,王鹏华.糖尿病足感染标准化规范化诊治[J].中国实用内科杂志,2016,36(1):3-6.
[2] Allen L,Powell-Cope G,Mbah A,et al. A retrospective review of adverse events related to diabetic foot ulcers[J]. Ostomy Wound Manage,2017,63(6):30-33.
[4] Noor S,Zubair M,Ahmad J. Diabetic foot ulcer-A review on pathophysiology,classification and microbial etiology[J]. Diabetes Metab Syndr,2015,9(3):192-199.
[5] 黄莺,曹瑛,邹梦晨,等.糖尿病足合并骨髓炎创面病原菌分布及危险因素分析[J].南方医科大学学报,2015,35(12):1782-1786.
[6] Jia L,Parker CN,Parker TJ,et al. Incidence and risk factors for developing infection in patients presenting with uninfected diabetic foot ulcers[J]. PLoS One,2017,12(5):e177916.
[7] 贺万强,罗伟华,李磊,等.银离子敷料治疗糖尿病足溃疡的疗效观察[J].中国循证医学杂志,2016,16(5):510-512.
[8] 王冰洋,牛广明,杜华,等.不同敷料在糖尿病足溃疡伤口治疗中的研究与应用[J].中国组织工程研究,2016,20(34):5155-5162.
[9] 李翔.2011年国际糖尿病足工作组有关糖尿病足感染治疗的特别指南[J/CD].中华损伤与修复杂志:电子版,2011,6(4):660-661.
[10] 郭业新,赵红强,刘凤莲.糖尿病足与糖尿病下肢动脉病变及预后的相关性研究[J].临床和实验医学杂志,2014,13(11):930-932.
[11] 王爱红,许樟荣,纪立农.中国城市医院糖尿病截肢的临床特点及医疗费用分析[J].中华医学杂志,2012,92(4):224-227.
[12] Gilligan AM,Waycaster CR,Motley TA. Cost-effectiveness of becaplermin gel on wound healing of diabetic foot ulcers[J]. Wound Repair Regen,2015,23(3):353-360.
[13] Du YP,Wang FJ,Qi HX,et al. Effects of percutaneous lower-extremity arterial interventions on endothelial function and inflammation response in patients with both type 2 diabetes and lower-extremity peripheral arterial disease[J]. Int J Clin Exp Pathol,2015,8(7):8115-8121.
[14] Karakas A,Arslan E,Cakmak T,et al. Predictive value of soluble cd14,interleukin-6 and procalcitonin for lower extremity amputation in people with diabetes with foot ulcers: a pilot study[J]. Pak J Med Sci,2014,30(3):578-582.
[15] Dhamodharan U,Viswanathan V,Krishnamoorthy E,et al. Genetic association of IL-6,TNF-α and SDF-1 polymorphisms with serum cytokine levels in diabetic foot ulcer[J]. Gene,2015,565(1):62-67.
[16] 王永红,张驰,乐岭,等.糖尿病足感染病原菌分布以及血清炎症因子水平改变的研究[J].中华医院感染学杂志,2017,27(14):3219-3222.
[17] 孙晓菲,董其娟,于江红,等.血清超敏C-反应蛋白和降钙素原与D-二聚体及纤维蛋白原在糖尿病足感染患者中的变化分析[J].中华医院感染学杂志,2017,27(12):2706-2709.
[18] 张莹,王伟灵,杨沁彤,等.血清VCAM-1、FGF2等炎症因子与难愈性糖尿病足的相关性研究[J].检验医学,2014,29(5):472-476.
[19] 宋瑞捧,沈珂珂,马豪莉,等.表皮生长因子联合银离子敷料治疗糖尿病足感染的临床研究[J].中华医院感染学杂志,2014,24(16):4033-4035.
[20] 岳瑜,冉兴无.糖尿病足溃疡治疗中敷料选择与应用[J].中国实用内科杂志,2016,36(1):7-12.