慢性髓系白血病(chronic myelogenous leukemia,CML)是由多能造血干细胞异常增殖所致的骨髓增殖性肿瘤[1],尽管甲磺酸伊马替尼明显改善CML预后,但仍然有15%~20%的CML患者病情进展[2-4],而药物不耐受是常见的原因之一。丹参酮ⅡA(Tanshinone ⅡA,Tan ⅡA) 是从丹参中提取的有效成分。研究证实,Tan ⅡA能够促进多种肿瘤细胞凋亡,显示出良好的抗肿瘤前景[5]。恶性肿瘤在供氧充足时,糖酵解仍然活跃,被称为Warburg效应[6],丙酮酸激酶(human pyruvate kinase,PKM2)作为糖酵解途径限速酶,在Warburg效应中发挥着重要作用,并且在多种肿瘤细胞中表达上调[7]。已有研究显示, Tan ⅡA通过抑制食管癌细胞PKM2表达诱导凋亡。本研究拟证实Tan ⅡA通过下调PKM2表达促进CML细胞的凋亡,旨在为治疗CML提供新思路及实验基础。
1 材料与方法
1.1 细胞培养和试剂
1.1.1 细胞培养 K562细胞株由河北省血液病重点实验室长期保存;K562细胞培养在含有双抗(青霉素和链霉素)及10 %胎牛血清的RIPM 1640培养液中,放入37 ℃、5 % CO2培养箱内。每1~2 d离心更换细胞培养液,根据细胞密度分装到新的细胞培养瓶中,放回培养箱继续培养。
1.1.2 试剂和仪器 兔抗PKM2抗体(Abcam公司);鼠抗β-actin抗体(Santa Cruz公司);兔抗PCNA抗体(Proteintech公司);鼠抗Cleaved Caspase-3抗体(Proteintech公司);RIPM 1640培养基(Gibco公司);lipofectamine 2000细胞转染试剂(Invitrogen公司);胎牛血清(CLARK Bioscience公司);CCK-8细胞增殖/毒性检测试剂盒(上海贝博生物);AnnexinV-FITC/PI凋亡检测试剂盒(BD公司);核酸定量仪(德国Eppendorf公司);PCR扩增仪(德国Eppendorf公司);实时荧光定量PCR仪ABI 7500 Fast(美国ABI公司);电泳仪(Bio-rad公司);ECL化学发光仪(Vilber Lourmat 公司)。
1.1.3 引物设计与合成 上海生物工程公司合成,引物序列如下:β-actin(human)上游5′-GAGCTACGAGCTGCCTGAC -3′,下游5′-GGTAGTTTCGTGGATGCCACAG-3′;PKM2引物购自广州富能基因;pcDNA3.1-PKM2过表达质粒由北京普尔普乐公司合成。
1.1.4 药物 丹参酮ⅡA购自Sigma公司,纯度为99%;DMSO溶解,冻存浓度8 g/L;实验时用无血清培养基稀释至相应浓度。
1.2 方法
1.2.1 CCK-8法测定细胞增殖抑制率 将K562细胞浓度调整至1×105 cells/mL,取100 μL接种于96孔培养板,K562细胞加入Tan ⅡA,使其终浓度为0.125,0.25,0.5,1.0,2.0,4.0 mg/L。对照组为K562细胞悬液分别加100 μL 10%RPMI 1640培养基。每组设3个复孔。分别培养24 h后,每孔加入CCK-8试剂10 μL,继续培养2 h。酶标仪测定各孔在450 nm处的光密度(optical density,OD)值,并计算细胞的增殖抑制率[细胞增殖抑制率(%)=(实验组OD450值-空白组OD450值)/(对照组OD450值-空白组OD450值)]。
1.2.2 流式细胞术AnnexinV-FITC/PI检测细胞凋亡 用0,0.5,1.0,2.0 mg/L Tan ⅡA处理K562细胞24 h,离心收集细胞; PBS洗涤细胞;加入100 μL 的1×Binding Buffer 悬浮细胞;加入5 μL的Annexin V-FITC及5 μL的PI染色混匀后,避光,室温孵育15 min;上机前,补加200 μL的1×Binding Buffer。每组设3个复孔。流式细胞仪检测细胞凋亡率,并通计算细胞凋亡率[细胞总凋亡率(%)=(Q2象限细胞总数+Q4象限细胞总数)/总细胞数]。
1.2.3 质粒转染 使用Lipofectamine 2000对细胞转染,具体步骤参照该Lipofectamine 2000 细胞转染试剂说明书。
1.2.4 RNA提取和实时定量PCR 用Trizol法提取细胞总RNA,核酸定量仪检测RNA的纯度和浓度。按照Invitrogen公司“用于qRT-PCR的M-MLV第一链合成系统”操作说明,取1~3 μg总RNA建立20 μg逆转录体系合成cDNA。之后,用Invitrogen公司的“Platinum SYBR Green Qpcr SuperMix-UDG with ROX”试剂盒和ABI7500 Fast Real-time PCR扩增仪进行荧光扩增。Real-time PCR反应结果分析:以β-acting为内参,采用△Ct(Ct目的-Ct内参)法进行相对定量分析,以2-△△Ct作为目的RNA的相对表达量。
1.2.5 Western blot分析 收集细胞,提取总蛋白,用改良的Lowry法进行蛋白定量。取等量蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,电泳完毕,取出凝胶进行半干转膜。转膜完毕,取出PVDF膜,放置在含5 %脱脂奶粉的TTBS封闭液中,于室温封闭2 h后,将封闭后的PVDF膜用TTBS适当洗脱,然后放入用一抗稀释液稀释的一抗中,4 ℃放置过夜。次日,取出PVDF膜用TTBS洗膜5~6次,将PVDF膜置入用适当TTBS稀释的化学发光二抗中,室温反应2 h,取出PVDF膜用TTBS适当洗脱。最后用化学发光仪检测抗体特异结合条带。
1.3 统计学方法 应用SPSS 13.0软件分析数据,计量资料比较分别采用F检验和Dunnet-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度Tan ⅡA对K562细胞增殖率的影响 用0,0.125,0.25,0.5,1.0,2.0,4.0 mg/L Tan ⅡA处理K562细胞24 h后,用CCK-8方法检测细胞活力,发现细胞中加入Tan ⅡA 0.25 mg/L时,细胞活力开始明显下降(P<0.05),且下降呈剂量依赖性,见表1。
表1 不同浓度Tan ⅡA对K562细胞增殖率的影响
Table 1 Effect of different doses of TanⅡA on cell viability in K562 cells![]()
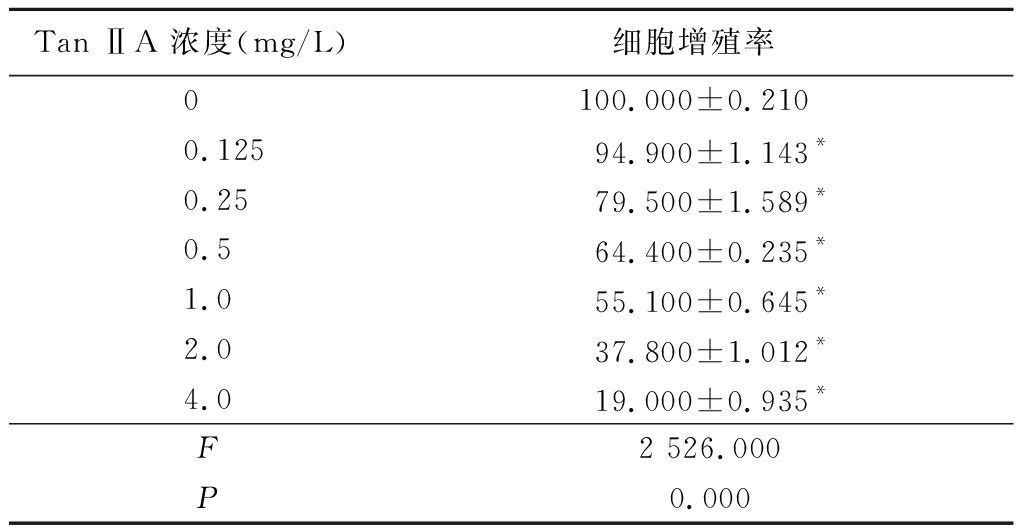
Tan ⅡA 浓度(mg/L)细胞增殖率0100.000±0.2100.12594.900±1.143*0.2579.500±1.589*0.564.400±0.235*1.055.100±0.645*2.037.800±1.012*4.019.000±0.935* F 2 526.000 P 0.000
*P<0.05与0 mg/L组比较(Dunnet-t检验)
2.2 不同浓度Tan ⅡA对K562细胞凋亡率的影响 用0.5,1.0,2.0 mg/L Tan ⅡA分别处理K562细胞时,其凋亡率与对照组差异均有统计学意义(P<0.05),且呈现剂量依赖性,见表2。
表2 不同浓度Tan ⅡA 对K562细胞凋亡率的影响
Table 2 Effect of different doses of Tan ⅡA on apoptosis rate in K562 cells![]()
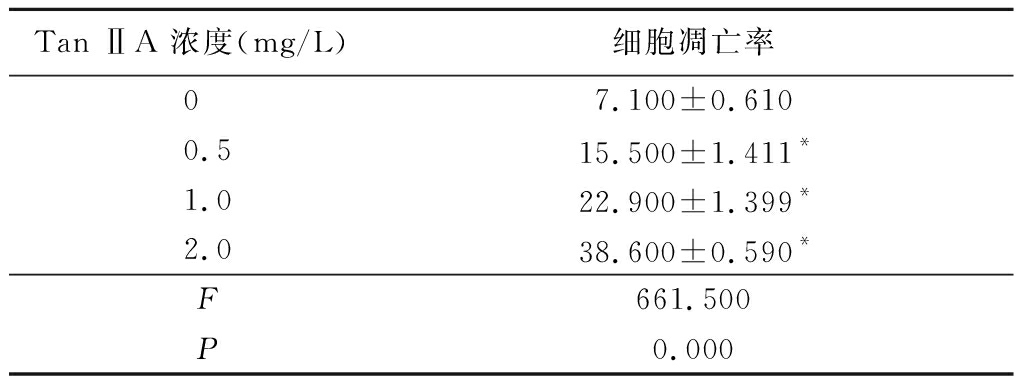
Tan ⅡA 浓度(mg/L)细胞凋亡率07.100±0.6100.515.500±1.411*1.022.900±1.399*2.038.600±0.590* F661.500 P0.000
*P<0.05与0 mg/L组比较(Dunnet-t检验)
2.3 不同浓度Tan ⅡA对K562细胞PKM2 mRNA、蛋白及Cleaved-Caspase-3蛋白、PCNA蛋白表达的影响 用Tan ⅡA 0.5,1.0 mg/L处理K562细胞时,其PKM2基因mRNA水平均较对照组下降(P<0.05);同时用Western blot方法检测0.5,1.0 mg Tan ⅡA刺激后K562细胞PKM2蛋白质表达情况,PKM2蛋白质表达下降,且呈剂量依赖性;另外还检测了凋亡相关蛋白Cleaved-Caspase-3和增殖标志蛋白PCNA蛋白的表达情况,Tan ⅡA能下调增殖标志蛋白PCNA蛋白表达,上调Cleaved-Caspase-3表达。见表3,图1。
2.4 转染不同质量pcDNA3.1-PKM2质粒对K562细胞PKM2 mRNA及蛋白表达的影响 分别在K562细胞转染4 μg及8 μg时验证其转染效率,结果显示转染4 μg及8 μg pcDNA3.1-PKM2均能显著提高K562细胞PKM2的mRNA表达(P<0.05),但Western blot结果显示,与转染4 μg相比,转染8 μg pcDNA3.1-PKM2载体PKM2蛋白表达上调更明显,故选择8 μg作为后续实验的转染量。见表4,图2。
表3 不同浓度Tan ⅡA 对K562细胞PKM2 mRNA表达的影响
Table 3 Effect of different doses of Tan ⅡA on expression of PKM2 mRNA in K562 cells![]()
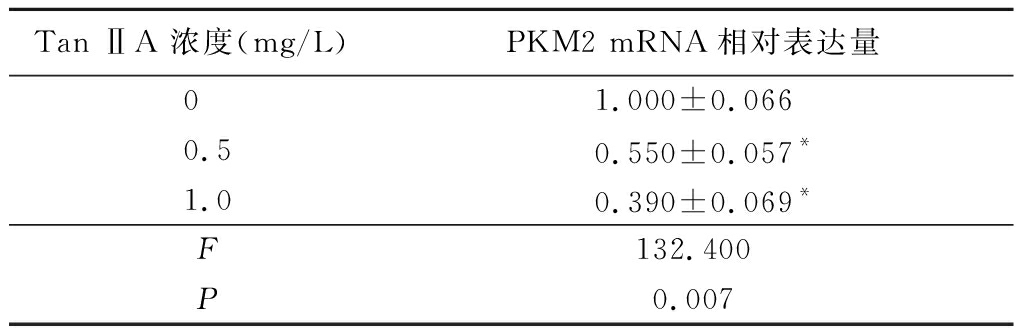
Tan ⅡA 浓度(mg/L)PKM2 mRNA相对表达量01.000±0.0660.50.550±0.057*1.00.390±0.069* F132.400 P0.007
*P<0.05与0 mg/L组比较(Dunnet-t检验)
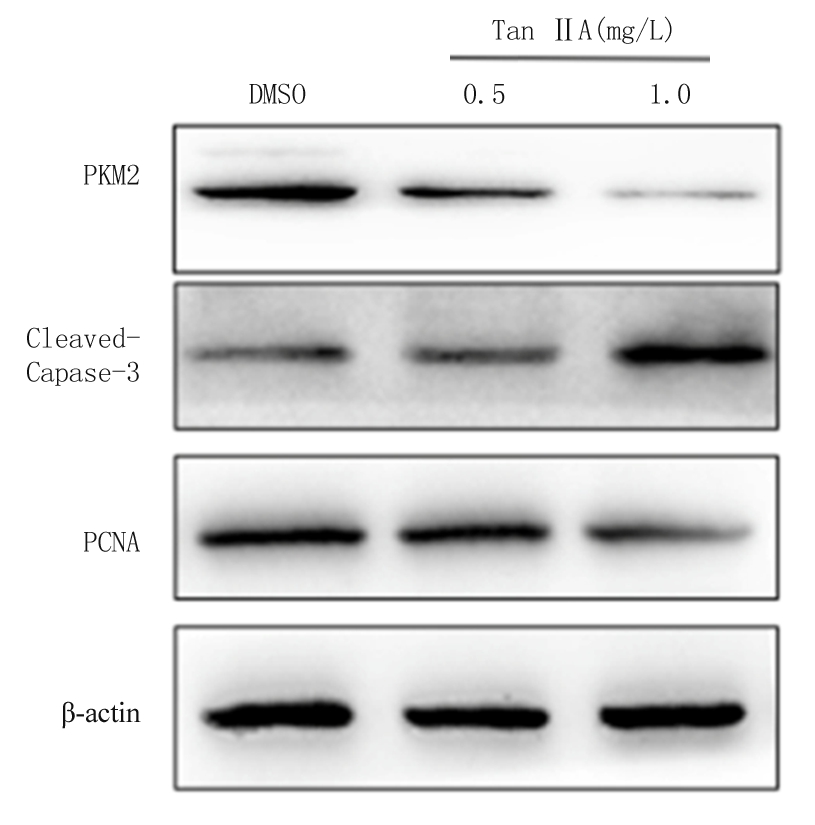
图1 不同浓度Tan ⅡA对K562细胞PKM2 蛋白表达的影响
Figure 1 Effect of different doses of TanⅡA on expression of PKM2 protein in K562 cells
表4 转染不同质量pcDNA3.1-PKM2质粒对K562细胞PKM2 mRNA表达的影响
Table 4 Effect of different doses of pcDNA3.1-PKM2 on expression of PKM2 mRNA in K562 cells![]()
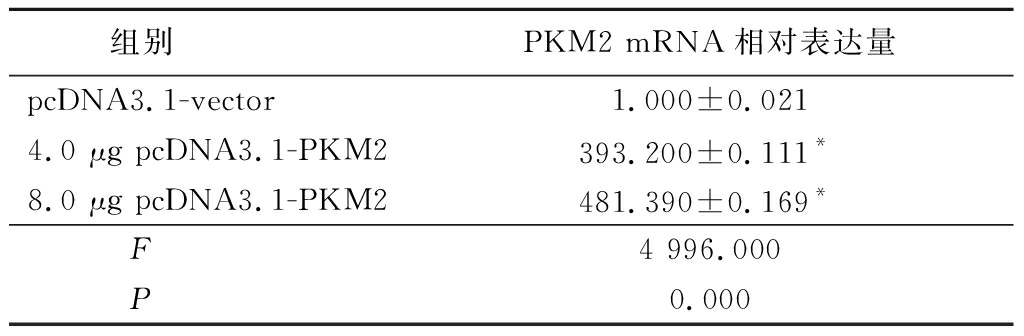
组别 PKM2 mRNA相对表达量pcDNA3.1-vector 1.000±0.0214.0 μg pcDNA3.1-PKM2393.200±0.111*8.0 μg pcDNA3.1-PKM2481.390±0.169*F 4 996.000P 0.000
*P<0.05与pcDNA3.1-PKM2组比较(Dunnet-t检验)
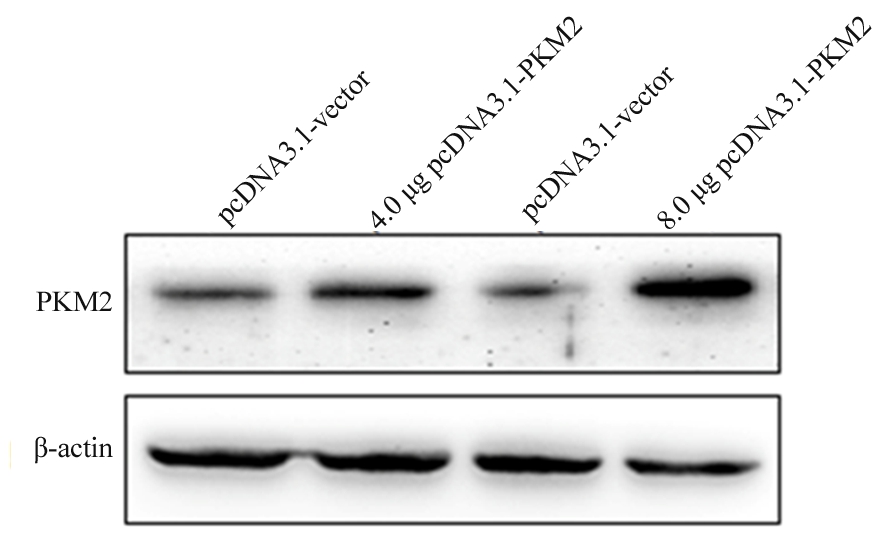
图2 转染不同质量pcDNA3.1-PKM2质粒对K562细胞PKM2蛋白质表达的影响
Figuer 2 Effect of different doses of pcDNA3.1-PKM2 on expression of PKM2 protein in K562 cells
2.5 不同处理对K562细胞凋亡率的影响 将实验分为对照组、Tan ⅡA 1.0 mg/L组、转染pcDNA3.1-PKM2组、Tan ⅡA 1.0 mg/L联合转染pcDNA3.1-PKM2组,并用AnnexinV/PI流式凋亡检测试剂盒检测凋亡情况,结果显示,与单独应用Tan ⅡA 1.0 mg/L组相比,Tan ⅡA 1.0 mg/L联合转染pcDNA3.1-PKM2组凋亡率明显下降,差异有统计学意义(P<0.05),见表5。
表5 不同处理对K562细胞凋亡率的影响
Table 5 Effect of different treatment on expression of apoptosis rate in K562 cells![]()

组别细胞凋亡率对照组6.900±0.421Tan ⅡA 1.0 mg/L组23.200±1.450转染pcDNA3.1-PKM2组4.040±0.869Tan ⅡA 1.0 mg/L联合转染pcDNA3.1-PKM2组16.200±1.450* F4.638 P0.016
*P<0.05与Tan ⅡA 1.0 mg/L组比较(Dunnet-t检验)
3 讨 论
自从20年前,CML治疗进入了革命性的“酪氨酸激酶抑制剂时代”,CML患者预后得到明显改善,使CML从一种恶性血液系统肿瘤向可治愈的慢性疾病的转化成为了可能[1]。随着人口老龄化及患者预期寿命延长,原发或继发的酪氨酸激酶抑制剂不耐受,严重影响CML患者预后,特别是老年CML患者的预后。因此,寻找安全且不良反应小的抗肿瘤药物便成为了改善此部分患者生存质量的希望。丹参是中医临床上最为常用的中药之一,具有活血调经、祛瘀止痛、养血安神等传统功效。研究显示,丹参中含有数百种化学成分,主要包括水溶性酚酸类和脂溶性的丹参酮类。丹参酮类是丹参的特征性成分之一,包括Tan ⅡA、隐丹参酮、丹参酮Ⅰ、二氢丹参酮Ⅰ等多种。相关文献报道,Tan ⅡA 可抑制多种肿瘤细胞株的生长,包括胃癌[8]、卵巢癌[9]、小细胞肺癌[10]和乳腺癌[11]等。本研究结果显示丹参主要成分Tan ⅡA能够通过抑制PKM2表达诱导K562细胞凋亡。表明Tan ⅡA可能成为治疗白血病的新手段。
基于Tan ⅡA的安全性及抗肿瘤活性,越来越多的体外实验证实Tan ⅡA具有抗白血病效应。Zhang等[12]研究发现,Tan ⅡA通过上调表达C/EBPβ诱导急性早幼粒细胞白血病细胞凋亡;Tan ⅡA可增加Ph阳性急性淋巴细胞白血病细胞对甲磺酸伊马替尼的敏感性,其机制可能与抑制AKT/mTOR通路活性及重新激活p53通路相关[13]。此外,Tan ⅡA处理KBM-5细胞(人慢性髓白血病细胞株)引起Sub-G1期阻滞、DNA损伤、线粒体膜电位降低、线粒体中细胞色素C释放、Caspase-3和Caspase-9激活。Tan ⅡA 同时激活 JNK和p38MAPK,且其诱导的凋亡可被JNK抑制剂逆转。提示Tan ⅡA 诱导了线粒体依赖的凋亡,且与激活 JNK有关[14]。本研究揭示了Tan ⅡA通过下调K562细胞PKM2表达,进一步影响K562细胞糖酵解途径,从而促进K562细胞凋亡。
PKM2是参与糖酵解和能量代谢的关键酶,利用上游糖酵解产物,为肿瘤细胞脂肪、氨基酸和核酸合成提供前提物质,并为癌细胞提供了代谢优势前体,目前已经被证实参与了多种癌症的发生发展[15]。癌细胞的代谢特征是促进癌细胞的侵袭和转移,即使在供氧充足时也能通过糖酵解产生能量[16]。在肿瘤发生过程中持续改变的糖酵解酶是PKM2,其是糖酵解链中的最后一种酶,负责糖酵解能量产生和糖酵解的限速步骤。在一组癌细胞系中敲除PKM2可降低葡萄糖摄取,增加氧气消耗,并降低乳酸产量;当重新引入PKM2时,可逆转上述变化[17]。因此,靶向PKM2可抑制癌细胞的生长,特别是那些在低氧条件下生长的癌细胞。本研究结果表明,Tan ⅡA对癌细胞中Warburg效应的关键酶PKM2表达的下调产生了一种无法支持K562细胞生长的代谢环境。因此,提出Tan ⅡA改变K562细胞代谢导致不能维持其生长的正常水平,引起细胞的凋亡;但当重新过表达PKM2后,可逆转Tan ⅡA所引起的抑制增殖促进凋亡作用。这进一步佐证Tan ⅡA改变通过下调PKM2抑制K562细胞增殖,诱导其凋亡。
综上所述,Tan ⅡA的抗白血病作用具有很好的临床应用前景。同时与传统经典化疗药物相比,具有不良反应小的优势。若能证实其在临床安全性同时具有抗肿瘤、抗肿瘤干细胞、逆转化疗耐药等活性作用,将获益于白血病患者。
[1] Hiddemann W,Haferlach T,Schoch C,et al. New insights into the biology of acute myeloid leukemia and their impact on treatment [J]. Curr Cancer Drug Targets,2013,13(7):711-723.
[2] Cortes JE,Saglio G,Kantarjian HM,et al. Final 5-Year Study Results of DASISION:The Dasatinib Versus Imatinib Study in Treatment-Naive Chronic Myeloid Leukemia Patients Trial[J]. J Clin Oncol,2016,34(20):2333-2340.
[3] Cortes J,Hochhaus A,Hughes T,et al. Front-Line and Salvage Therapies With Tyrosine Kinase Inhibitors and Other Treatments in Chronic Myeloid Leukemia[J]. J Clin Oncol,2011,29(5):524-531.
[4] Hochhaus A,Saglio G,Hughes TP,et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase:5-year update of the randomized ENESTnd trial[J]. Leukemia,2016,30(5):1044-1054.
[5] Jia Y,Huang F,Zhang S,et al. Is danshen(Salvia miltiorrhiza) dripping pill more effective than isosorbide dinitrate in treating angina pectoris? A systematic review of randomized controlled trials[J]. Int J Cardiol,2012,157(3):330-340.
[6] Chen XS,Li LY,Guan YD,et al. Anticancer strategies based on the metabolic profile of tumor cells:therapeutic targeting of the Warburg effect[J]. Acta Pharmacol,2016,37(8):1013-1019.
[7] Lunt S,Muralidhar V,Hosios A,et al. Pyruvate Kinase Isoform Expression Alters Nucleotide Synthesis to Impact Cell Proliferation[J]. Mol Cell,2015,57(1):95-107.
[8] Yu J,Wang X,Li Y,et al. Tanshinone ⅡA suppresses gastric cancer cell proliferation and migration by downregulation of FOXM1[J]. Oncol Rep,2017,37(3):1394-1400.
[9] 赵艳霞,罗丹,张彦惠,等.丹参酮ⅡA通过下调survivin促进顺铂对咽鳞状细胞癌Fadu细胞抑制作用的研究[J].临床耳鼻咽喉头颈外科杂志,2017,31(10):781-784,788.
[10] Xie J,Liu J,Liu H,et al. The antitumor effect of tanshinone ⅡA on anti-proliferation and decreasing VEGF/VEGFR2 expression on the human non-small cell lung cancer A549 cell line[J]. Acta Pharm Sin B,2015,5(6):554-563.
[11] Yan MY,Chien SY,Kuo SJ,et al. Tanshinone ⅡA inhibits BT-20 human breast cancer cell proliferation through increasing caspase 12,GADD153 and phospho-p38 protein expression[J]. Int J Mol Med,2012,29(5):855-863.
[12] Zhang HS,Zhang FJ,Li H,et al. Tanshinone ⅡA inhibits human esophageal cancer cell growth through miR-122-mediated PKM2 down-regulation[J]. Arch Biochem Biophys,2016,598:50-56.
[13] Zhang K,Li J,Meng W,et al. Tanshinone ⅡA inhibits acute promyelocytic leukemia cell proliferation and induces their apoptosis in vivo.[J]. Blood Cells Mol Dis,2016,56(1):46-52.
[14] Yun SM,Jeong SJ,Kim JH,et al. Activation of c-Jun N-Terminal Kinase Mediates Tanshinone ⅡA-Induced Apoptosis in KBM-5 Chronic Myeloid Leukemia Cells[J]. Biol Pharm Bull,2013,36(2):208.
[15] Yang W,Lu Z. Pyruvate kinase M2 at a glance[J]. J Cell Sci,2015,128(9):1655-1660.
[16] Sciacovelli M,Gaude E,Hilvo M,et al. The metabolic alterations of cancer cells[J]. Methods Enzymol,2014,542(4):1-23.
[17] Li Z,Yang P,Li Z. The multifaceted regulation and functions of PKM2 in tumor progression[J]. Biochim Biophys Acta,2014,1846(2):285-296.