局灶性皮质发育不良(focal cortical dysplasia,FCD)是儿童难治性癫痫的常见病因[1-2],FCD所致癫痫属于药物难治性癫痫,此类患儿药物治疗效果较差,内科保守治疗不能有效控制癫痫发作。因此,早期术前评估和外科干预可使此类患儿早日解除癫痫发作的痛苦,获得较为满意的疗效。本研究回顾分析我院收治的86 例手术治疗FCD所致儿童难治性癫痫患者的临床数据,探讨其临床特点、病理分型和手术疗效。
1 资料与方法
1.1 一般资料 选择2014年1月—2016年1月我院收治的儿童难治性癫痫患者86例。其中男性 48 例,女性 38 例;年龄2~14岁,平均(8.50±1.63)岁;病程3~10年,平均(6.51±1.05)年;患者首次癫痫发作年龄3~9岁,平均(6.05±1.37)岁;癫痫发作频率平均(5.32±2.11)次/月;右利手78例,左利手8例。纳入标准:①药物治疗效果不佳;②手术年龄≤14岁;③接受致痫灶切除手术治疗,除外胼胝体切开术和其他神经调控手术;④术后切除标本病理类型为FCD;⑤术后随访时间≥2年,随访资料齐备完整。所有患者按照随访结果分为预后良好组57例和预后不良组29例。
1.2 术前评估
1.2.1 视频脑电图监测 应用美国Nicolet视频脑电监测系统对患儿进行视频脑电图监测,采用国际脑电图学会规定的10-20系统电极放置法粘贴头皮电极,常规采用32/64导放大器,记录患儿发作间期和发作期头皮脑电图,根据病情决定是否进行剥夺睡眠及过度换气诱发试验。监测时间为1~7 d,至少捕捉并记录3次以上患儿惯常发作脑电图。由本科室专业的神经电生理医生对记录的脑电图数据进行分析和处理。
1.2.2 影像学检查 全部患儿应用3.0 T磁共振成像(magnetic resonance imaging,MRI)进行常规头颅扫描,包括T1加权像、T2加权像及FLAIR序列,对怀疑FCD的局部脑皮层进行2 mm无间隔薄层扫描及弥散张量成像扫描;颞叶癫痫需要加作海马冠状位扫描及磁共振波谱分析。部分患者选择性进行发作间期正电子发射型计算机断层显像检查及脑磁图检查。
1.2.3 立体定向脑电图检查 立体定向脑电图技术在药物难治性癫痫术前评估中具有重要的作用[3]。部分患儿经非侵袭性术前检查仍然不能确定颅内致痫灶的发作起始或者存在相互矛盾的定侧定位信息时,则进一步根据临床发作症状学,假设的癫痫传导网络,进行立体定向深部电极植入,术后再次进行长程视频脑电图监测,患儿至少记录3次以上惯常的临床发作,综合分析患儿发作期脑电图的起始及扩散途径,精确定位癫痫灶。
1.3 个体化手术策略 根据术前评估致痫灶的不同部位,对每例患儿采取个体化的手术治疗方案。术中应用皮层脑电图再次检测致痫灶确定手术切除范围,在FCD切除后再次描记皮层脑电图,若仍可检测到皮层癫痫样放电,需要扩大切除范围;若邻近功能区,可给予皮层热灼术,直到癫痫样放电消失。对诊断为半球病变继发癫痫的患儿在经过详细电生理评估和肢体功能代偿评估后,选择大脑半球离断术。
1.4 术后病理 手术后切除的标本送病理科行常规石蜡切片检查和免疫组织化学染色。按照2011年国际抗癫痫联盟(International League Against Epilepsy,ILAE)对FCD的分型标准[4],将 FCD 分为单纯型(FCD Ⅰ、Ⅱ型)和结合型(FCD Ⅲ型)。FCD Ⅰ型分为3型:Ⅰa 纵向迁移或神经元成熟异常,如出现微柱状结构;Ⅰb横向迁移或神经元成熟异常,如 Ⅱ、Ⅳ层神经元分布异常或丢失;Ⅰc 纵向+横向皮质分层异常。FCD Ⅱ型分为2型:Ⅱa 皮质分层异常+异形神经元;Ⅱb 皮质分层异常+气球样细胞。FCD Ⅲ 型分为4型:Ⅲa 海马硬化+颞叶皮质分层异常;Ⅲb 胶质瘤或神经胶质混合瘤+邻近皮质分层异常;Ⅲc 血管畸形+邻近皮质分层异常;Ⅲd 早年后天获得性病变(外伤、缺血、炎症等)+邻近皮质分层异常。由2位神经病理学医师对病理学结果进行分型。
1.5 术后随访 随访2~4年,术后继续服用抗癫痫药物,根据视频脑电图结果及患儿癫痫控制情况决定何时药物减量直至停药。按照ILAE的Engel标准[5]对术后疗效进行判断:EngelⅠ级,癫痫发作完全消失;EngelⅡ级,癫痫发作很少或几乎消失(每年≤3次);Engel Ⅲ级,癫痫发作>3次/年,但发作减少>75%;Engel Ⅳ级:癫痫发作未减少或加重。Engel Ⅰ~Ⅱ级为预后良好,Engel Ⅲ~Ⅳ级为预后不良。按照随访结果将所有患者分为预后良好组和预后不良组。术后总有效率以预后良好例数占所有患者比例表示,而单纯型和结合型FCD术后有效率分别以各型中预后良好例数占所有患者比例表示。
1.6 统计学方法 应用SPSS 16.0统计软件处理数据。计数资料比较采用χ2检验;计量资料比较采用两独立样本的t检验;影响因素确定采用Logisitic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 病理学结果 86例患者病理结果如下:单纯型FCD 37例(其中FCD Ⅰ型19例,FCDⅡ型18例);结合型FCD(FCDⅢ型) 49例。所有类型的具体临床信息,见表1。
2.2 术后疗效 术后随访2~4年,86例癫痫患者中达到 Engel Ⅰ级57例(66.3%),EngelⅡ级16例(18.6%),EngelⅢ级10例(11.6%),Engel Ⅳ级3例(3.5%)。术后总有效率为66.3%(57/86),其中单纯型FCD术后有效率为21.0%(18/86);结合型FCD为45.3%(39/86)。
表1 86例患者临床资料
Table 1 Clinical data of 86 patients
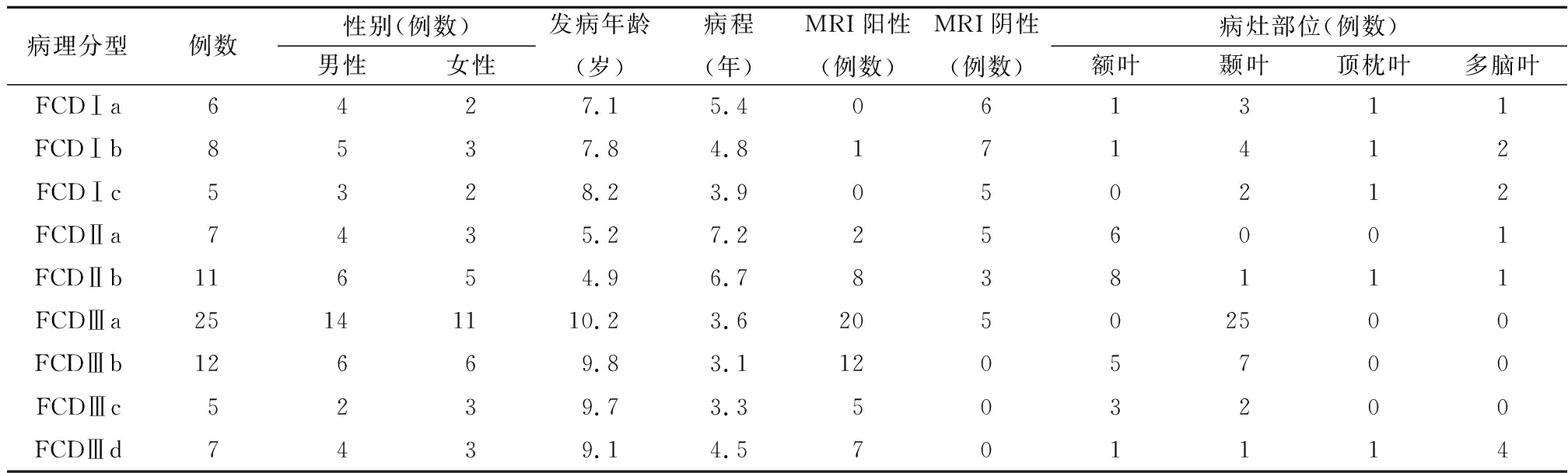
病理分型例数性别(例数)男性女性发病年龄(岁)病程(年)MRI阳性(例数)MRI阴性(例数)病灶部位(例数)额叶颞叶顶枕叶多脑叶FCDⅠa6427.15.4061311FCDⅠb8537.84.8171412FCDⅠc5328.23.9050212FCDⅡa7435.27.2256001FCDⅡb11654.96.7838111FCDⅢa25141110.23.620502500FCDⅢb12669.83.11205700FCDⅢc5239.73.3503200FCDⅢd7439.14.5701114
2.3 预后良好组与预后不良组一般资料与病理类型比较 与预后不良组比较,预后良好组中结合型FCD、致痫灶位于颞叶、致痫灶未邻近功能区、头颅MRI阳性、视频脑电图显示局灶性放电、完整切除致痫灶的患者较多,差异有统计学意义(P<0.05);而2组在性别、年龄和高热惊厥史差异均无统计学意义(P>0.05)。见表2。
表2 预后良好组与预后不良组一般资料与病理类型比较
Table 2 Comparison of general data and pathological types in patients between the good prognosis group and the poor prognosis group (例数,%)
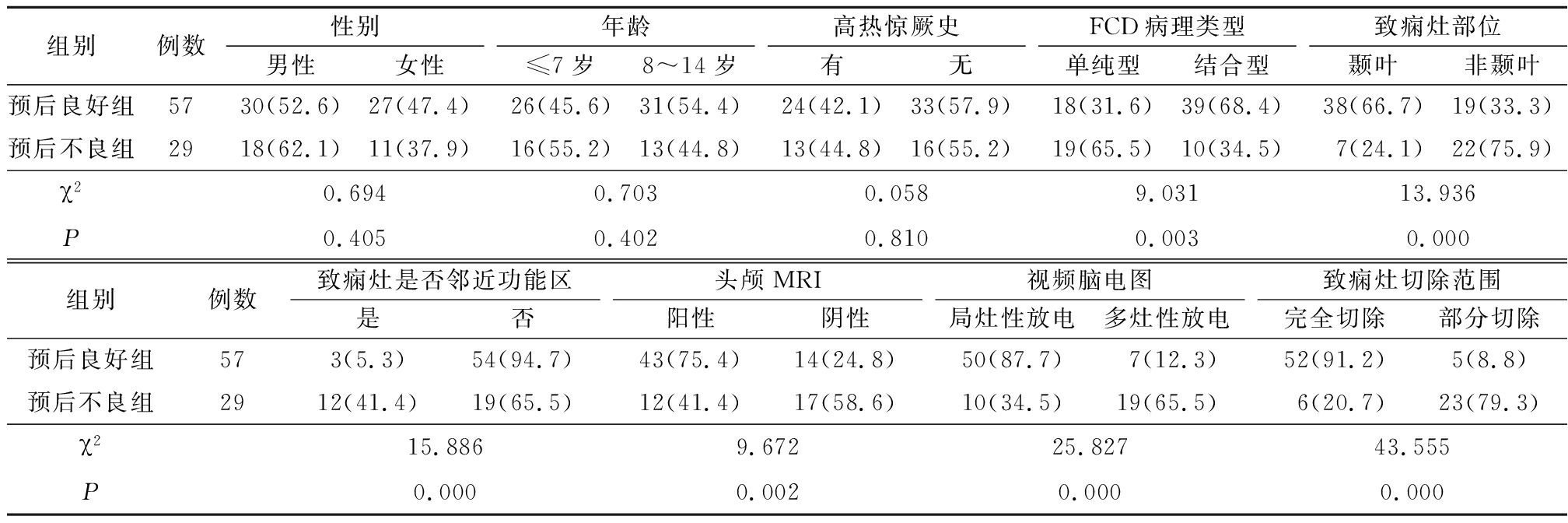
组别例数性别男性女性年龄≤7岁8~14岁高热惊厥史有无FCD病理类型单纯型结合型致痫灶部位颞叶非颞叶预后良好组5730(52.6)27(47.4)26(45.6)31(54.4)24(42.1)33(57.9)18(31.6)39(68.4)38(66.7)19(33.3)预后不良组2918(62.1)11(37.9)16(55.2)13(44.8)13(44.8)16(55.2)19(65.5)10(34.5)7(24.1)22(75.9)χ20.6940.7030.0589.03113.936P0.4050.4020.8100.0030.000组别例数致痫灶是否邻近功能区是否头颅MRI阳性阴性视频脑电图局灶性放电多灶性放电致痫灶切除范围完全切除部分切除预后良好组573(5.3)54(94.7)43(75.4)14(24.8)50(87.7)7(12.3)52(91.2)5(8.8)预后不良组2912(41.4)19(65.5)12(41.4)17(58.6)10(34.5)19(65.5)6(20.7)23(79.3)χ215.8869.67225.82743.555P0.0000.0020.0000.000
2.4 Logistic回归分析 以癫痫术后疗效为为因变量,以致痫灶切除范围(完全切除=0,部分切除=1)、致痫灶是否临近功能区(是=0,否=1)、头颅MRI(阳性=0,阴性=1)、病理类型(单纯型=0,结合型=1)、视频脑电图(局灶性放电=0,多灶性放电=1)、致痫灶部位(颞叶=0,非颞叶=1)为自变量,进行Logistic回归分析,结果显示致痫灶切除范围是影响FCD所致儿童难治性癫痫手术疗效的独立预后因素,见表3。
表3 Logistic 回归分析结果
Table 3 Results of multivariate logistic regression analysis
变量回归系数标准误Wald χ2POR95%CI致痫灶切除范围0.2781.6224.1650.0163.0661.021~7.298
3 讨 论
FCD是导致儿童难治性癫痫的重要原因,FCD不同病理类型具有自身不同的临床特征。从本研究纳入的86例患儿临床资料来看,首先,结合型FCD(FCDⅢ 型)的数量高于单纯型FCD(FCDⅠ和Ⅱ型),结合型FCD主要指海马硬化、神经胶质瘤、血管畸形、后天获得性损害相邻的FCD。分析此类型多见的原因可能是结合型FCD合并的病变往往比较明显,而且头颅MRI和CT上可以看到明显的病变,容易引起患儿及家属足够的重视有关。其次,本研究头颅MRI阳性检出率,结合型FCD(43/49)高于单纯型FCD(12/37),单纯型FCD中 FCDⅡ型(10/18)高于FCDⅠ型(1/19),FCDⅡ型中Ⅱb型(8/11)又高于Ⅱa型(2/7)。高分辨率MRI是临床用于诊断FCD的一种无创、有效手段,FCDⅠ型和Ⅱa型常常表现为灰白质分界模糊,局部皮层增厚,脑回白质萎缩,在影像上诊断比较困难;而FCDⅡb型在MRI FLAIR/T2WI序列常表现为皮质下片状白质高信号,这种高信号特征性表现为从脑皮层向侧脑室方向延伸,并逐渐变细,呈漏斗状、三角形或放射状,故在MRI上容易识别。这与文献报道较一致[6]。另外,从发病部位上看,FCD Ⅰ型多发生于颞叶,而 FCDⅡ型更多见于颞叶以外,以额叶比较多见。这与文献报道大致一致[7]。FCDⅢa型常见于颞叶,与合并海马硬化有关。FCDⅢd型常见于多个脑叶,范围较广泛。
FCD致儿童难治性癫痫的术后疗效受多种因素的影响。其中,FCD的不同病理分型是否与术后疗效相关一直以来存在争议[8-9]。本研究结果显示,结合型FCD手术有效率(45.3%)略高于单纯型FCD(20.9%),但是预后不良组与预后良好组中病理分型和术后疗效差异无统计学意义。分析原因:一是本研究中FCD致儿童难治性癫痫病例数有限,尚需要大宗病例进行研究;二是FCD的发生机制目前仍然不十分清楚,神经元移行障碍的程度与脑皮层致痫性关系仍旧扑朔迷离,病理分型与术后疗效的关系更是有待深入研究。另外,致痫灶的位置也与术后疗效有关。邻近功能区的 FCD 致痫灶临床上处理比较棘手,而且影响术后的长期疗效,癫痫控制不佳[10]。本研究预后不良组29例患者中有12例是致痫灶邻近功能区或部分重叠,占到41.4%,其中3例毗邻Broca区,5例致痫灶涉及到中央区,4例在角回附近。此类患者术前均需要采用立体定向脑电图技术进行精确定位致痫灶,并行皮质电刺激功能区定位,为了最大限度保护脑功能区,有时尚需配合术中唤醒麻醉完成手术。但实际手术中很难完整切除病变,手术效果不能令人满意;致痫灶与功能区重叠时,只能行皮层热灼术,达不到完成切除致痫灶的目的,皮层脑电图仍有少量癫痫样放电,术后疗效受到一定影响。
在诸多影响术后疗效的因素中,致痫灶切除不全是术后癫痫仍有发作的决定因素[11]。本研究结果显示,预后良好组中完整切除致痫灶的比例占91.2%(52/57),而预后不良组完整切除致痫灶的比例占20.7%(6/29)。完整切除致痫灶是保证手术效果的前提条件,致痫灶包括视频脑电图检测到的发作起始区以及头颅MRI显示的致痫病变,有时MRI显示的病变并不一定与致痫灶相一致或者仅仅是一部分致痫灶,这需要术前详细评估,以免造成不必要的误诊,而遗留真正的致痫灶或者致痫灶仅仅部分切除。要明确病理灶与致痫灶不是同一个概念[12]。另外,预后不良组有些患儿已经进行了充分的致痫灶切除,但术后仍不能完全控制癫痫发作,需要再次评估,行二次手术或选择其他治疗方法。分析原因有几方面:①手术切除范围没有做到真正意义上的全部切除,单纯性FCD Ⅰ型的病变范围常累及多个脑叶,通常需要更大的切除范围才能获得较好的术后疗效[13];②结合型FCD中FCD Ⅲb型术后恶性肿瘤复发,形成新的致痫灶;③继发性致痫灶兴奋性逐渐增高,部分患者在术后1年无发作,1年或多年后再次出现抽搐发作,这种迟发型复发现象具体机制仍不十分清楚,考虑与继发性致痫灶或隐匿性致痫灶兴奋性逐渐增高有关[14-15]。此类患者多见于单纯性FCD和结合型FCD中的FCD Ⅲd型。
总之,FCD导致儿童灾难性癫痫经过严格的术前评估可以通过外科手术取得较好的效果。由于儿童时期脑生长发育正处在关键期,频繁或持续的癫痫发作会对儿童的认知和心理造成严重的影响[16]。早期手术可以阻止这种恶性循环,加上患儿大脑良好的可塑性,术后患儿在生活质量和认知方面均会有显著的提高。
[1] 遇涛,张国君,倪端宇,等.癫痫灶切除手术治疗儿童和青少年难治性癫痫的回顾性分析[J].中华神经外科杂志,2016,32(10):978-983.
[2] Pestana Knight EM,Gonzalez-Martinez J,Gupta A. Pre-operative evaluation in pediatric patients with cortical dysplasia [J]. Childs Nerv Syst,2015,31(12):2225-2233.
[3] 李文玲,郭韬,董长征,等.立体脑电图在药物难治性癫痫术前评估中的应用(附九例报告)[J].中华神经外科杂志,2014,30(1):3-8.
[4] 孙恒,郝玉军.局灶性脑皮质发育不良与难治性癫痫的研究进展[J].中华神经外科杂志,2015,31(11):1186-1188.
[5] 王峰,冯德宁,刘阳,等.以癫痫为主要表现的颞叶海绵状血管瘤手术治疗效果[J].中华医学杂志,2018,98(9):658-661.
[6] Colombo N,Tassi L,Deleo F,et al. Focal cortical dysplasia type IIa and IIb: MRI aspects in 118 cases proven by histopathology [J]. Neuroradiology,2012,54(10):1065-1077.
[7] Isler C,Kucukyuruk B,Ozkara C,et al. Comparison of clinical features and surgical outcome in focal cortical dysplasia type 1 and type 2 [J]. Epilepsy Res,2017,136:130-136.
[8] 武江,何利兵,李文玲.不同病理亚型FCD颞叶癫痫患者手术效果及预后比较[J].山东医药,2014,54(2):51-52.
[9] Jin B,Wang J,Zhou J,et al. A longitudinal study of surgical outcome of pharmacoresistant epilepsy caused by focal cortical dysplasia[J]. J Neurol,2016,263(12):2403-2410.
[10] 王斌,陶胜忠,刘展,等.癫痫灶切除术中皮层电刺激在脑皮层功能区定位中的应用[J].山东医药,2017,57(11):55-57.
[11] Surges R,Elger CE. Reoperation after failed resective epilepsy surgery[J]. Seizure,2013,22(7):493-501.
[12] Jehi LE,Palmini A,Aryal U,et al. Cerebral cavernous malformations in the setting of focal epilepsies: pathological findings,clinical characteristics,and surgical treatment principles[J]. Acta Neuropathol,2014,128(1):55-65.
[13] 郑重,李俊驹,张建国,等.局灶性皮质发育不良所致难治性癫痫的手术预后影响因素分析[J].中华神经外科杂志,2018,34(3):268-272.
[14] Grote A,Witt JA,Surges R,et al. A second chance-reoperation in patients with failed surgery for intractable epilepsy: long-term outcome,neuropsychology and complications[J]. J Neurol Neurosurg Psychiatry,2016,87(4):379-385.
[15] 李岩,付静,刘潜,等.难治性癫痫二次手术41例患者脑切除标本临床病理学分析[J].临床与实验病理学杂志,2016,32(2):161-165.
[16] 许蓓,周洋,贾晓彧,等.癫痫儿童生活质量的影响因素及家庭干预的疗效分析[J].河北医科大学学报,2018,39(4):420-424.