目前,经皮肾镜碎石清石术(percutaneous nephrolithotomy,PCNL)是大体积肾结石及输尿管上段结石最常用的手术方式[1]。术后容易出现全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),其中一部分可能转变为脓毒血症,导致多脏器功能衰竭,病死率高[2]。有研究报道中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)可预测不同疾病状态下的疾病诊断及预后,其与很多疾病的发生发展相关。但NLR与PCNL术后感染性并发症的相关性研究却鲜有报道。本研究回顾性分析323例经皮肾镜取石患者的临床资料,评估术前NLR在预测术后SIRS中的作用。
1 资料与方法
1.1 一般资料 选择2014年10月—2018年1月中国人民解放军二五二医院泌尿外科收治的经皮肾镜肾结石术后患者323例。术后发生SIRS(SIRS组)48例,男性25例,女性23例,年龄24~72岁,平均(47.0±22.4)岁,体重指数25.5±2.8;经积极抢救治疗后均痊愈出院;无肾盂肾盏撕裂穿孔,未发生结肠损伤、胸膜损伤等严重并发症,无死亡病例。未发生SIRS(SIRS组)275例,男性163例,女性112例,年龄23~74岁,平均(48.5±24.2)岁,体重指数24.7±3.2。2组性别、年龄、体重指数差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入标准和排除标准 纳入标准:①肾结石患者,术前均行CT检查;②入选病例均行经皮肾镜碎石术;③术前均行血液常规检查。排除标准:①合并肿瘤,血液病,口服免疫抑制剂,合并畸形如马蹄肾、多囊肾、肾盂输尿管连接部狭窄患者;②术前静息心率>90次/min,合并心力衰竭、肾衰竭患者;③术前曾留置支架管、肾造瘘管,术前肾衰竭、发热,术前有感染性疾病;④经皮肾镜术中同时进行其他手术操作患者。
1.3 手术方法 插管全身麻醉,取截石位,常规消毒铺单,膀胱镜下置入输尿管导管,接0.9%生理盐水用于人工肾积水备用。置管完毕后患者更换体位为俯卧位,在超声引导下用18 G肾穿刺针行肾盂穿刺(术中如果穿刺出脓性尿液,则留置肾造瘘管二期手术,并且立即给予经验用药,细菌培养结果回报后再更换为敏感抗生素)。沿针芯留置斑马导丝,退出穿刺针外鞘,使用一次性扩张器扩张至F18,输尿管镜确认进入目标肾盏内,用金属迭进式筋膜扩张器扩张至F24,留置外鞘,经皮肾镜使用EMS 4代系统超声联合弹道进行碎石清石。碎石过程结束,留置F16肾造瘘管,如果无明显出血,结石无残留,造瘘管术后5~7 d拔除。术后复查CT了解结石有无残留,如有残留结石<1 cm,留置输尿管支架管体外碎石,如残留较大结石行二期经皮肾镜术。
1.4 观察指标 观察2组性别,年龄,体重指数,糖尿病史,结石负荷,血常规检查(包括白细胞计数,中性粒细胞计数,淋巴细胞计数,血小板计数,血红蛋白),血清白蛋白,血清总脂,影像学参数(包括KUB、IVU、泌尿系超声、CT)。手术前1周获取血液学参数,计算NLR。结石负荷的计算:最大长径×最大横径×π×0.25[3],多发结石的结石负荷为分别计算每个结石负荷的总和。
1.5 SIRS诊断标准[2] ①术后白细胞计数<4×109/L或>12×109/L;②发热>38 ℃或<36 ℃;③心率>90次/min;④呼吸>20次/min。符合2项以上确定SIRS诊断。
1.6 统计学方法 应用SPSS 17.0软件处理数据。计量资料比较采用两独立样本的t检验;计数资料比较采用χ2检验;危险因素确定采用Logistic回归分析;采用ROC曲线分析术前NLR最佳截断点的敏感度和特异度。P<0.05为差异有统计学意义。
2 结 果
2.1 2组术前术中各项因素比较 SIRS组糖尿病史、感染结石史、围手术期输血史发生率均高于非SIRS组,SIRS组结石负荷、NLR高于非SIRS组,差异有统计学意义(P<0.05);2组多通道手术史、术前尿培养性阳性率、血红蛋白含量、白蛋白含量和手术时间差异均无统计学意义(P>0.05),见表1。
表1 2组术前术中各项因素比较
Table 1 Comparison of preoperative and postoperative factors between two groups
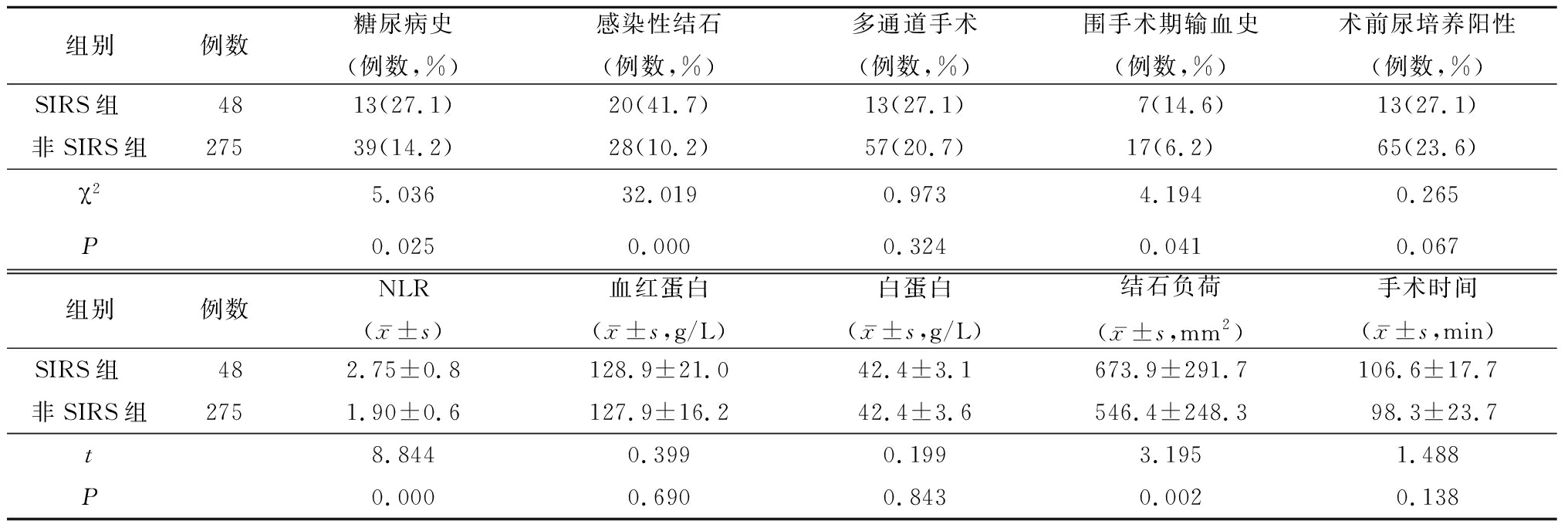
组别例数糖尿病史(例数,%)感染性结石(例数,%)多通道手术(例数,%)围手术期输血史(例数,%)术前尿培养阳性(例数,%)SIRS组 4813(27.1)20(41.7)13(27.1)7(14.6)13(27.1)非SIRS组27539(14.2)28(10.2)57(20.7)17(6.2)65(23.6)χ25.03632.0190.9734.1940.265P0.0250.0000.3240.0410.067组别例数NLR(x-±s)血红蛋白(x-±s,g/L)白蛋白(x-±s,g/L)结石负荷(x-±s,mm2)手术时间(x-±s,min)SIRS组 482.75±0.8128.9±21.042.4±3.1673.9±291.7106.6±17.7非SIRS组2751.90±0.6127.9±16.242.4±3.6546.4±248.398.3±23.7t8.8440.3990.1993.1951.488P0.0000.6900.8430.0020.138
2.2 Logistic回归分析 以术后发生SIRS为因变量(否=0,是=1),以糖尿病史(否=0,是=1)、感染性结石(否=0,是=1)、术前NLR(<2.31=0,≥2.31=1)、结石负荷(<800 mm2=0,≥800 mm2=1)、围手术期输血史(否=0,是=1)为自变量进行Logistic回归分析,结果显示术前NLR(OR=8.886,P=0.000)、感染性结石(OR=6.742,P=0.000)为经皮肾镜术后SIRS发生的独立危险因素,见表2。
表2 术前术中各项参数与PCNL术后SIRS的多因素分析
Table 2 Multivariate Logistic regression analysis of SIRS after percutaneous nephrolithotomy

变量回归系数标准误Wald χ2POR95%CI下限上限感染性结石1.9080.41121.5150.0006.7423.01015.101NLR 2.1840.40329.3700.0008.8864.03319.580
2.3 ROC曲线下面积分析 分析显示术前NLR最佳截断点为2.31,其敏感度为72.9%,特异度为75.6%,曲线下面积为80.8%,见图1。
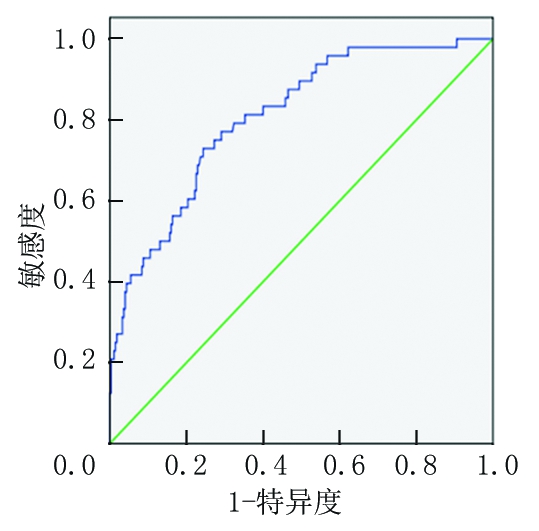
图1 NLR的ROC曲线图
Figure 1 ROC curve of NLR
3 讨 论
随着医学科技的发展,经皮肾镜取石术已经成为治疗复杂上尿路结石的首选方法,其具有创伤小、恢复快、适应证较广的特点[4-5],但是术后具有结石残留、出血、感染等多种并发症。经皮肾镜手术后很容易发生SIRS、菌血症及尿源性脓毒血症[6]。文献报道经皮肾镜术后各种感染性并发症的发生率为35%,菌血症为23%,内毒素血症为34%, 发热为25%,败血症感染性休克为0.3%~2.5%[7]。临床上因经皮肾镜术后感染性败血症导致死亡的病例时有发生[8]。因此,分析上尿路结石经皮肾镜碎石术并发感染的术前危险因素,对于预防术后感染的发生、指导诊疗方案及术中操作、提高经治医师的警惕性具有重要意义。感染性并发症的发生除了与术中操作、手术时间、灌注压力等因素相关外,术前患者的综合因素至关重要。本研究从患者术前术中因素入手,旨在查找术后感染的术前易感因素,以期在术前就对易感人群进行早期监控及处理,从而减少术后感染性并发症的发生。
本研究结果显示术前NLR是经皮肾镜术后发生感染性并发症的独立危险因素。也就是说,术前NLR水平可以用于预测术后SIRS的发生。当术前NLR水平>2.31时,术后容易导致SIRS的发生,其预测SIRS的敏感度为72.9%,特异度为75.6%。表明炎症在肾结石的初始形成及发展过程中有重要的作用[9], NLR可用于预测多种疾病的发生如高血压、肥胖、糖尿病、高脂血症、动脉粥样硬化、心血管疾病、脑中风等。NLR与多种恶性肿瘤患者的预后有关,包括胃癌、前列腺癌、膀胱癌、结肠癌、肾癌、肺癌等[10-12]。NLR的升高增加了Fournier′s坏疽患者的病死率,增加了重症监护病房的需求及更长的住院时间[13]。Gürol等[14]研究表明NLR截断点为5.0时,预测菌血症及败血症的准确性最佳。Forget等[15]报道术前高NLR与腹部大手术术后并发症的发生相关。Yanartas等[16]研究表明术前NLR的升高,与患者慢性血栓栓塞性肺动脉高压的术后病死率升高有关。研究表明NLR升高与血浆促炎细胞因子如IL-1、IL-6、IL-7、IL-8、IL-12水平等相关[17]。这些炎性细胞因子在组织微环境内积聚,导致过激的炎症及肿瘤行为。此外,NLR被认为是先天免疫反应表达上调的一个很好指标。当前,预测经皮肾镜术后感染的术前临床参数主要为白细胞计数、C反应蛋白,降钙素原等。然而C反应蛋白、降钙素原在临床上并非术前常规检查,而术前白细胞计数对经皮肾镜术后SIRS的预测价值有限。术前NLR水平的测定可用于预测经皮肾镜术后感染的发生率,从而对此类人群进行早期干预,预防发生严重感染性并发症,降低病死率 。
本研究结果显示感染性结石是术后SIRS发生的另一个独立危险因素。结石可导致尿路梗阻,为致病菌生长提供了有利条件,而结石本身又可潜藏细菌,是尿脓毒血症的主要病因。尿路感染与结石、梗阻发生相关,感染、结石、梗阻三者相互促进,形成恶性循环,增加了术后SIRS及尿脓毒血症发生的概率。感染性结石可造成尿路梗阻,同时作为异物能促进感染的发生,感染可以加速结石的增长和肾实质的损害[18]。结石晶体包裹的细菌在碎石过程中大量释放,细菌及毒素通过损伤的黏膜进入血液循环,导致脓毒血症[19]。谢旭敏等[20]报道鹿角形结石与经皮肾镜术后脓毒血症的发生有关。邹晓峰等[21]报道鹿角形结石是经皮肾镜术后并发症发生的影响因素之一。
本研究首次评估了NLR对结石病在术后感染中的预测作用,结果显示术前NLR水平是术后感染性并发症良好预测指标,其具有简便易于测量的特点,易于在日常实践中使用,无需额外费用。然而,本研究属于单中心回顾性研究,尚需要多中心前瞻性研究进一步探讨此指标的有效性。
[1] Omar M,Noble M,Sivalingam S,et al. Systemic inflammatory response syndrome after percutaneous nephrolithotomy:a randomized single-blind clinical trial evaluating the impact of irrigation pressure[J]. J Urol,2016,196(1):109-114.
[2] Koras O,Bozkurt IH,Yonguc T,et al. Risk factors for postoperative infectious complications following percutaneous nephrolithotomy:a prospective clinical study[J]. Urolithiasis,2015,43(1):55-60.
[3] Kumsar S,Aydemir H,Halis F,et al. Value of preoperative stone scoring systems in predicting the results of percutaneous nephrolithotomy[J]. Cent European J Urol,2015,68(3):353-357.
[4] 金勇超,周览,王金善,等.微通道与小通道经皮肾镜碎石术治疗肾结石疗效及安全性比较[J].河北医科大学学报,2015,36(3):283-285.
[5] 徐学军,王磊,尹海军,等.多点穿刺标准通道经皮肾镜治疗鹿角形结石的体会[J].河北医科大学学报,2015,36(3):280-282.
[6] Erdil T,Bostanci Y,Ozden E,et al. Risk factors for systemic inflammatory response syndrome following percutaneous nephrolithotomy[J]. Urolithiasis,2013,41(5):395-401.
[7] Sen V,Bozkurt IH,Aydogdu O,et al. Significance of preoperative neutrophil-lymphocyte count ratio on predicting postoperative sepsis after percutaneous nephrolithotomy[J]. Kaohsiung J Med Sci,2016,32(10):507-513.
[8] Bansal SS,Pawar PW,Sawant AS,et al. Predictive factors for fever and sepsis following percutaneous nephrolithotomy:a review of 580 patients[J]. Urol Ann,2017,9(3):230-233.
[9] Mulay SR,Kulkarni OP,Rupanagudi KV,et al. Calcium oxalate crystals induce renal inflammation by NLRP3-mediated IL-1beta secretion[J]. J Clin Invest,2013,123(1):236-246.
[10] van Soest RJ,Templeton AJ,Vera-Badillo FE,et al. Neutrophil-to-lymphocyte ratio as a prognostic biomarker for men with metastatic castration-resistant prostate cancer receiving first-line chemotherapy:data from two randomized phase Ⅲ trials[J]. Ann Oncol,2015,26(4):743-749.
[11] Ozyalvacli ME,Ozyalvacli G,Kocaaslan R,et al. Neutrophil-lymphocyte ratio as a predictor of recurrence and progression in patients with high-grade pT1 bladder cancer[J]. Can Urol Assoc J,2015,9(3/4):E126-131.
[12] Kang MH,Go SI,Song HN,et al. The prognostic impact of the neutrophil-to-lymphocyte ratio in patients with small-cell lung cancer[J]. Br J Cancer,2014,111(3):452-460.
[13] Bozkurt O,Sen V,Demir O,et al. Evaluation of the utility of different scoring systems(FGSI,LRINEC and NLR) in the management of Fournier′s gangrene[J]. Int Urol Nephrol,2015,47(2):243-248.
[14] Gürol G,Ciftcii H,Terizi HA,et al. Are there standardized cutoff values for neutrophil-lymphocyte ratios in bacteremia or sepsis?[J]. J Microbiol Biotechnol,2015,25(4):521-525.
[15] Forget P,Dinant V,de Kock M. Is the Neutrophil-to-Lymphocyte Ratio more correlated than C-reactive protein with postoperative complications after major abdominal surgery?[J]. Peer J,2015,3:e713.
[16] Yanartas M,Kalkan ME,Arslan A,et al. Neutrophil/lymphocyte ratio can predict postoperative mortality in patients with chronic thromboembolic pulmonary hypertension[J]. Ann Thorac Cardiovasc Surg,2015,21(3):229-235.
[17] Motomura T,Shirabe K,Mano Y,et al. Neutrophil-lymphocyte ratio reflects hepatocellular carcinoma recurrence after liver transplantation via inflammatory microenvironment[J]. J Hepatol,2013,58(1):58-64.
[18] Pastore AL,Palleschi G,Silvestri L,et al. Combined laparoscopic pyelolithotomy and endoscopic pyelolithotripsy for staghorn calculi:long-term follow-up results from a case series[J]. Ther Adv Urol,2016,8(1):3-8.
[19] Flannigan R,Choy WH,Chew B,et al. Renal struvite stones--pathogenesis,microbiology,and management strategies[J]. Nat Rev Urol,2014,11(6):333-341.
[20] 谢旭敏,潘铁军.经皮肾镜取石术后尿源性脓毒血症的危险因素分析[J].中华泌尿外科杂志,2015,36(1):50-53.
[21] 邹晓峰,杨军,张国玺,等.Clavien-Dindo系统在经皮肾镜取石术并发症评估中的价值及危险因素分析[J].中华泌尿外科杂志,2014,35(10):739-744.