牙脱位是恒牙创伤类型之一,以上颌中切牙最常见[1],对美观及功能均有较大影响,治疗首选脱位牙再植术。临床上全脱位牙往往不能获得即刻再植,随着脱位牙体外保存时间的延长,牙周组织污染、坏死,再植后无法形成牙周膜愈合。同时,由于局部炎症反应、破骨细胞活化等病理变化可引起牙根吸收,最终可能导致再植牙脱落[2-3]。文献报道恒牙再植后牙根吸收率在57%~80%[4],延迟再植的牙齿牙根吸收发生率高达90%。因此,如何促进其牙周膜愈合,控制再植牙牙根吸收是牙外伤领域亟待解决的问题之一。随着口腔基础研究的不断深入及材料学的发展,对脱位牙再植中各种细胞因子的应用研究越来越广泛。骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)作为一种多功能生长因子是近年来医学研究的热点之一。BMP-2是转化生长因子β家族成员之一,能够刺激牙周膜成纤维细胞的增殖,直接促使其分化成为具有成骨细胞表型的细胞,进而诱导牙槽骨和牙骨质的形成[5-6]。体外细胞培养实验也证实BMP-2对牙周膜成纤维细胞增殖、分化有积极作用,但从组织学方面观察其用于牙脱位再植的研究尚未见报道。
1 材料与方法
1.1 实验动物及分组 选取清洁级8周龄雄性Wistar大鼠18只(体重250~300 g),购自皖南医学院实验动物中心。实验前先随机选取2只处死,制作切片作正常对照观察。剩余16只按照完全随机分为对照组和实验组各8只。所有大鼠实验室常规饲养。
1.2 实验步骤
1.2.1 拔牙 用10%水合氯醛(3 mL/kg)腹腔注射麻醉,将大鼠仰卧固定。选取右上中切牙作为受试牙,先用牙挺挺松,拔牙钳顺着牙根弯曲的方向将其拔出,拔牙过程中尽量减少对牙槽嵴及牙根表面的破坏。将脱位牙放置在经高温高压消毒的金属托盘内自然干燥1 h,干燥后用拔髓针通过根尖孔拔除牙髓,用25# K flex-file进行根管预备,生理盐水冲洗,纸尖吸干根管,Vitapex糊剂倒根充,玻璃离子根尖封闭(操作在5 min内完成),对照组根尖封闭后立即再植。实验组将50 μg BMP冻干粉与0.25 mL大鼠尾部静脉血混合成糊剂涂抹于牙根表面、牙槽窝内,然后将牙植入原牙槽窝。
1.2.2 再植后固定 牙再植后,均用流动树脂夹板固定方法进行固定,均匀磨除右上中切牙切缘约2 mm以降低咬合。术后7 d内动物进半流食,青霉素肌内注射20 000 U/次,1次/d,共7 d。7 d后用10%水合氯醛以3 mL/kg腹腔注射局部麻醉下去除树脂夹板。
1.2.3 切片制作 8周后以过量水合氯醛深度麻醉处死2组大鼠,切取包括右上中切牙在内的骨块,用生理盐水冲洗,10%福尔马林固定,pH6.9的4%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)脱钙4周,石蜡包埋,接近于牙根的根中l/3处沿与牙长轴垂直的方向每隔50 μm切取5μm的组织片,伊红-苏木精(HE)染色。
1.2.4 组织学观察 在盖玻片上画“米”字形八等份线条,将此盖玻片覆盖在已做封闭处理的组织片上,光学显微镜观察。盖玻片上“米”字形线条与牙根平面有8个交点(图1),此即为每张切片的观察记录点。牙再植的愈合可分为3种类型[7]:①牙骨质愈合,包括牙周膜愈合和牙骨质直接愈合,牙周膜外观正常,无炎性细胞浸润,牙骨质完整或先前的吸收凹被新生牙骨质修复,牙骨质直接愈合是牙周膜被增生的牙槽骨所替代,而牙根表面牙骨质、牙本质无吸收;②替代性吸收,牙本质与牙骨质被吸收,吸收区被增生的牙槽骨所替代;③炎症性吸收,牙本质与牙骨质被吸收,炎性结缔组织侵入到吸收区,炎细胞浸润。每颗牙至少观察8张切片,分别计算出每颗牙各种愈合类型观察点数、总观察点数,从而得出每种愈合类型的平均百分数后对各组进行比较。
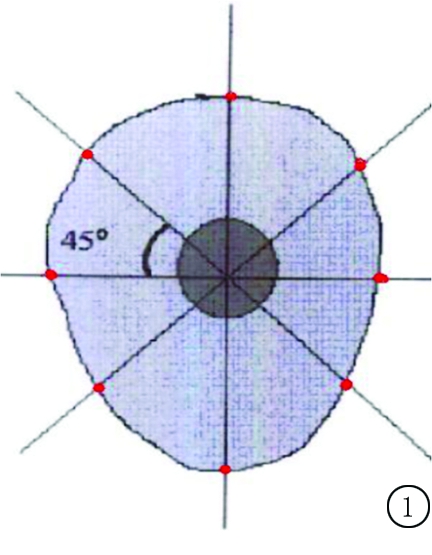
图1 记录点图示
Figure 1 Recordi point icon
1.3 统计学方法 应用SPSS 19.0统计软件处理数据,计量资料比较采用两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
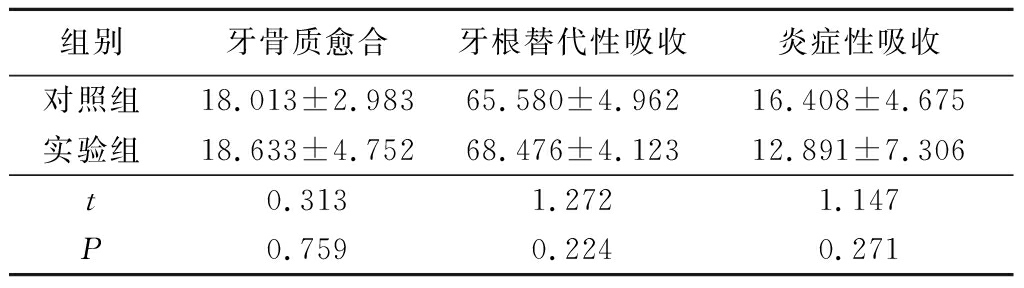
2.1 显微镜下形态学观察 大鼠上前牙牙周组织包括牙骨质、牙周膜和牙槽骨。正常大鼠牙根表面牙骨质延续,牙周膜位于牙骨质和牙槽骨之间(图2)。脱位牙干燥1 h再植,由于干燥环境不利于牙周膜细胞生存,牙根表面残余有活性牙周膜细胞显著减少,再植后牙根表面出现牙骨质、牙本质大面积吸收区(图3),部分牙周纤维结缔组织消失,取而代之的是炎细胞浸润的炎性组织和新生骨组织,牙根表面偶见少量修复性牙骨质形成。脱位牙干燥1 h,牙根表面和牙槽窝内壁用BMP-2糊剂涂抹后再植,牙根表面牙骨质牙本质存在浅凹状吸收,吸收区与新生的牙槽骨形成的骨性粘连(图4),可见散在少量炎症性吸收,有的吸收表面存在修复性牙骨质,也可见到部分区域牙周膜纤维再附着。
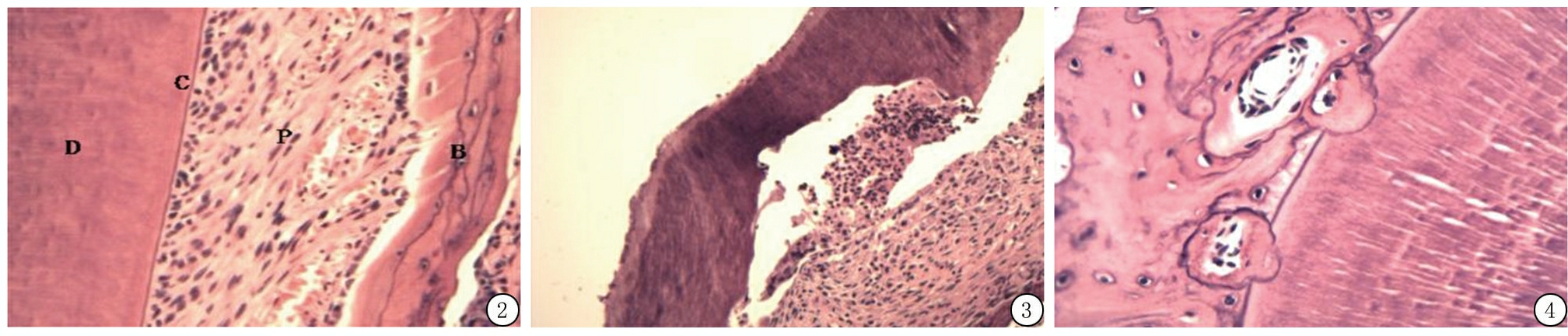
图2 大鼠正常牙周组织结构(HE ×100) Figure 2 Normal periodontal structure of rats(HE ×100)
D.牙齿;C.牙骨质;P.牙周膜;B.牙槽骨
图3 对照组形态学观察(HE ×100) Figure 3 Morphological observation in control group(HE ×100)
图4 实验组形态学观察(HE ×100) Figure 4 Morphological observation in experimental group of group B(HE ×100)
2.2 2组牙骨质愈合、牙根替代性吸收、炎症性吸收比较 2组间牙骨质愈合、牙根替代性吸收、炎症性吸收%差异均无统计学意义(P>0.05),见表1。
表1 2组牙骨质愈合、牙根替代性吸收、炎症性吸收比较
Table 1 Comparison of cementum healing,alternative root absorption,inflammatory absorption between two groups![]()
组别牙骨质愈合牙根替代性吸收炎症性吸收对照组18.013±2.98365.580±4.96216.408±4.675实验组18.633±4.75268.476±4.12312.891±7.306t0.3131.2721.147P0.7590.2240.271
3 讨 论
牙完全脱位是一种牙髓、牙周多种组织受影响的复杂性损伤。牙完全脱位后,根尖部血管断裂,根尖孔闭合较好的成年人通常会导致牙髓坏死[8]。同时牙周膜撕裂和挫伤受损导致牙根炎症性吸收和替代性吸收,这一过程通常会持续数年,最终导致牙齿脱落。本研究通过动物实验,模拟临床牙完全脱位的再植,观察BMP-2对脱位牙与牙周组织愈合的关系,旨在为临床寻找促进脱位牙再植成功的方法。
大鼠是常用的实验动物,易饲养,抵抗力强,其牙体及牙周组织结构与人类相似。大鼠共计16颗牙齿,其中切牙4颗,磨牙12颗。临床上牙脱位以上颌中切牙最常见,故本研究用大鼠右上颌中切牙作为受试牙,比较接近临床。在正常的生理状况下牙周膜细胞渗透压为320 mmoL,pH值7.2。再植成功的关键取决于牙周膜细胞的活性,而完全脱位牙的牙周膜细胞的活性与保存方法有较大的关系,湿性保存较为有利。有研究称牙拔除后干燥60 min,牙根表面大部分牙周膜细胞已坏死,残余的活性牙周膜细胞明显减少,仅为20.63%[9]。此时将牙再植后,大部分牙周膜细胞活性丧失,向成牙骨质细胞转化能力减弱,而牙槽窝内壁细胞尤其是易于趋化到硬组织的成骨细胞、破骨细胞及破牙骨质细胞会抢先迁移到牙根表面,造成牙根表面牙本质、牙骨质吸收,吸收表面新骨形成与吸收直接连接形成骨性粘连,偶有吸收的牙骨质表面有新牙骨质修复再生,以往研究表明表面吸收通常发生在组织损伤较轻时;炎症性吸收往往发生在牙骨质严重损伤时,牙髓来源的毒素经暴露的牙本质小管进入牙周,导致局部炎症性吸收,如果局部损伤严重或由于脱位牙体外保存不当,牙周膜来源细胞修复无法实现,邻近的骨性来源的细胞首先自牙槽窝壁游走并定植于受损的牙根形成骨性替代吸收[10]。
BMP是一种存在于骨基质中的糖蛋白多肽,在生物体内的一项重要生物学作用是诱导未分化的间充质细胞分化成为软骨和骨,它是唯一能够单独诱导骨组织形成的局部生长因子,BMP各成员的诱导成骨能力不同,其中以BMP-2的成骨能力最强,因此目前被广泛研究[11]。有实验表明,局部应用外源性rhBMP-2可以显著地促进牙周韧带、牙骨质和牙槽骨的重建[12-14]。Saito等[15]在比特犬牙周病模型上进行牙周重建手术,12周后与对照组比较,加入rhBMP-2组的牙槽骨的高度恢复较明显。平整后的牙根面表面有类似Sharpey纤维的纤维结缔组织形成,并被新生牙骨质包埋。表明BMP-2能促进牙周组织的修复。有研究证明BMP-2在牙周组织的发育和再生中均起着非常重要的作用[16]。BMP-2不仅能诱导牙槽骨的再生,而且可以促进牙骨质和牙周纤维的再生。
本研究的受试牙为大鼠前牙,采用随机分组方法设对照组(延迟再植组)及实验组(局部应用BMP-2延迟再植),符合实验要求。在临床上,对于根尖已经发育完全的恒牙,因根尖孔封闭较好牙髓血管再生可能性不大,一般建议对其行根管治疗,以避免坏死的牙髓感染牙根而引起牙根吸收[17]。但大鼠的前牙根尖孔粗大。本研究为模拟临床和避免坏死牙髓对实验结果的影响,摘除了实验组及对照组的牙髓并用Vitapex和玻璃离子进行倒根充。Vitapex主要成分为氢氧化钙和碘仿。氢氧化钙可起到对根管和牙本质小管的消毒作用,抑制根面炎性吸收的发生,提高再植成功率。碘仿同时起到消毒、防腐、杀菌的作用,且能吸收创面渗出物保持创面干燥。另外,本研究在术后给大鼠肌内注射抗生素,提高了实验动物的抗感染能力,术后大鼠饮食良好,行动无异常。实验过程中对大鼠牙行倒根充,树脂夹板固定,降低咬合,术后应用抗生素、半流食喂养等一系列措施,最大程度避免了外界因素的干扰。BMP-2的生物学作用较为明确,能够促进牙周组织再生,故本研究尝试将BMP-2用于牙周组织再生,观察其能否有效促进牙骨质愈合,延长再植牙口内时间。通过组织学观察,BMP-2的加入一定程度上反映了对炎症反应的调控及对再植牙牙周愈合的影响,但并未明显提高再植牙牙周膜愈合率。分析认为这可能主要与BMP-2的代谢较快有关[18]。因此,可以考虑结合其他生物材料或辅助干细胞技术等以促进延迟再植牙牙周膜愈合。如何在今后寻找更合适的载体并发挥最大的生物学作用还需进一步研究和探讨。
[1] 钱虹.儿童牙外伤的风险因素及其预防策略[J].口腔疾病防治,2017,25(8):477-481.
[2] Marão HF,Mao JJ,Casatti CA,et al. Effects of ovariectomy on periodontal tissues following tooth replantation[J]. Arch Oral Biol,2016,65:9-16.
[3] Ahn HJ,Nam OH,Lee HS,et al. Expression of inflammatorycy-tokines and MMPs on replanted teeth at different extra-alveolar time:an ex vivo and invivo study[J]. Int J Paediatr Dent,2016,26(4):301-309.
[4] Zaleckiene V,Peciuliene V,BrukieneV,et al. Traumatic dental injuries:etiology,prevalence and possible outcomes[J]. Stomatologija,2014,16(1):7-14.
[5] Yi T,Jun CM,Kim SJ,et al. Evaluation of in vivo osteo-genic potential of bone morphogenetic protein 2-overex-pressing hunan periodontal ligament stem cells combined with biphasic calcium phosphate block scaffolds in a critical-size bone defect model[J]. Tissue Eng Part A,2016,22(5/6):501-512.
[6] Hakki SS,Bozkurt B,Hakki EE,et al. Bone morphogenetic protein-2,-6,and-7 differently regulate osteogenic differentiation of human perio-dontal ligament stem cells[J]. J Biomater,2014,102(1):119-130.
[7] Guzm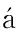 in-Martínez N,Silva-Herzog FD,Méndez GV,et al. The effect of Emdogain and 24%EDTA root conditioning on periodontal healing of replanted dog's teeth[J].Dent Traumatol,2009,25(1):43-50.
in-Martínez N,Silva-Herzog FD,Méndez GV,et al. The effect of Emdogain and 24%EDTA root conditioning on periodontal healing of replanted dog's teeth[J].Dent Traumatol,2009,25(1):43-50.
[8] Lin S,Pilosof N,Karawani M,et al. Occurrence and timing of complications following traumatic dental injuries:a retrospective study in a dental trauma department[J]. J Clin Exp Dent,2016,8(4):e429-436.
[9] Barbizam JV,Massarwa R,da Silva LA,et al. Histopathological evaluation of the effects of variable extraoral dry times and enamel matrix proteins(enamel matrix derivatives) application on replanted dogs' teeth[J]. Dent Traumatol,2015,31(1):29-34.
[10] Esteves JC,Marão HF,Silva PI,et al. Delayed tooth replantation following root canal filling with calcium hydroxide and MTA:His-tomorphometric study in rats[J]. Arch Oral Biol,2015,60(9):1254-1262.
[11] Huang H,Wismeijer D,Hunziker EB,et al. The acute inflammatory response to absorbed collagen sponge is not enhanced by BMP-2[J]. Int J Mol Sci,2017,18(3):E498.
[12] Poon B,Kha T,Tran S,et al. Bone morphogenetic protein-2 and bone therapy:successes and pitfalls[J]. J Pharm Pharmacol,2016,68(2):139-147.
[13] Jian CX,Fan QS,Hu YH,et al. Effects of rhBMP-2 gene transfection to periodontal ligament cells on osteogenesis[J]. Biosci Rep,2017,37(3):BSR20160585.
[14] Jang YS,Choi CH,Cho YB,et al. Recombinant human BMP-2 enhances osteogenesis of demineralized bone matrix in experimental mastoid obliteration[J]. Acta Otolaryngol,2014,134(8):785-790.
[15] Saito A,Saito E,Handa R,et al. Influence of residual bone on recombinant human bone morphogenetic protein-2-induced periodontal regeneration in experimental periodontitis in dogs[J]. J Pedodonto,2009,80(6):961-968.
[16] 宋扬,秦青,高菊荣,等.BMP-2、bFGF和Dex联合应用对犬牙周膜细胞增殖及矿化结节形成能力的影响[J].中华老年口腔医学杂志,2014,12(2):80-84.
[17] Vidovic D,Bursac D,Skrinjaric T,et al. Prevalence and prevention of dental injuries in young taekwondo athletes in Croatia[J]. Eur J Paediatr Dent,2015,16(2):107-110.
[18] Li Y,Li R,Hu J,et al. Recombinant human bone morphogenetic protein-2 suspended in fibrin glue enhances bone formation during distraction osteogenesis in rabbits[J]. Arch Med Sci,2016,12(3):494-501.