肺气肿是指肺部终末细支气管远端气腔的持续性扩张,伴有肺泡壁的破坏,无明显肺纤维化,最常见的原因是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)和α1抗胰蛋白酶缺乏[1-2],为高度异质性疾病。多排螺旋 CT(multislice helical CT,MSCT )能够进行亚毫米薄层扫描及容积数据采集,已经用于诊断肺气肿及其分布,肺气肿定量CT分析软件能够准确测量全肺、肺叶容积及肺气肿的容积,客观评估肺气肿严重程度[3]。肺气肿严重程度与肺功能关系的研究已有报道[4],但关于CT肺气肿形态学分型与肺功能关系的研究鲜见报道[5]。本研究分析不同类型肺气肿与肺功能参数的相关性,旨在探讨不同类型肺气肿对肺功能的影响。
1 资料与方法
1.1 一般资料 选择2016年8月—2018年8月河北医科大学第一医院呼吸内科收治的COPD肺气肿患者42例,男性35例,女性7例,年龄 52~85岁,平均(67.33±8.81)岁。纳入标准:①CT图像显示肺气肿征象;②吸入支气管扩张剂后 FEV1/FVC<70%;③无其他原因引起的肺实质破坏;④CT图像质量优良。排除标准(符合下列任一项):①既往胸部手术史;②并发肺间质纤维化、肺不张、肺炎、胸廓畸形、支气管扩张、胸腔积液、肺内肿块直径≥2 cm的病灶;③不能配合检查指令者。
本研究经医院伦理委员会批准;患者均签署知情同意书。
1.2 肺功能检查 应用德国JAEGER公司Master-Screen-Diff肺功能仪对所有患者进行肺功能检查(pulmonary function test,PFT)。测量指标包括用力肺活量(forced vital capacity,FVC), 第1秒用力呼气容积(forced expiratory volume in1second,FEV1),FEV1与用力肺活量比(FEV1/FVC), FEV1实测值与预测值百分比 (percentage of the forced expiratory volume in 1 second predictedvalue, FEV1%),残气量与肺总量比(residual volume/total lung capacity, RV/TLC),一氧化碳弥散量 (percentage of the diffusing capacity for carbon monoxide per liter of lung volume predicted value,DLco%)。PFT与CT检查时间间隔在1周内。
1.3 CT扫描方案 应用GE lightspeed VCT 64排CT扫描仪,扫描前训练患者呼吸。受检者取仰卧位,双手抱头,头先进位,不使用对比剂,于深吸气末屏气自肺底至肺尖方向全肺CT扫描。扫描参数:管电压120 kV,管电流30~120 mA,FOV 380 mm,层厚5 mm,重建间隔5 mm,准直器宽度64 mm×0.625 mm,扫描速度0.8 s/周。肺窗及纵隔窗重建,标准算法及骨算法重建。
1.4 图像分析 将CT原始图像数据传至计算机肺气肿分析软件,即三维容积测量系统(SYNAPSETM version 4.4;Fujifilm Medical System,Tokyo Japan)工作站,对薄层标准算法的横断图像进行分析。该软件自动将图像中肺组织与其他组织(胸壁、气管、肺门大血管、纵隔、心脏等软组织)提取分离出来。肺组织的测量阈值为 -1 024~-200 Hu,肺气肿的阈值定为-950 Hu[6],软件自动勾画出两肺、各肺叶及密度衰减区, 自动计算出全肺、左右肺及每个肺叶低于-950 Hu体素占全肺及肺叶体素的比例(percentages of low attenuation volume,LAV%)(图1)。
根据肺气肿在高分辨率MSCT上的形态学特征,将肺气肿分为:小叶中心型肺气肿(centrilobular emphysema,CLE)组28例和全小叶型肺气肿(panlobular emphysema,PLE)组14例[7]。
1.5 统计学方法 应用SPSS 19.0统计软件分析数据。正态分布计量资料比较采用t检验,非正态分布计量资料[以M(Q25,Q75)表示]比较采用秩和检验;相关性采用Spearman相关分析。P<0.05为差异有统计学意义。
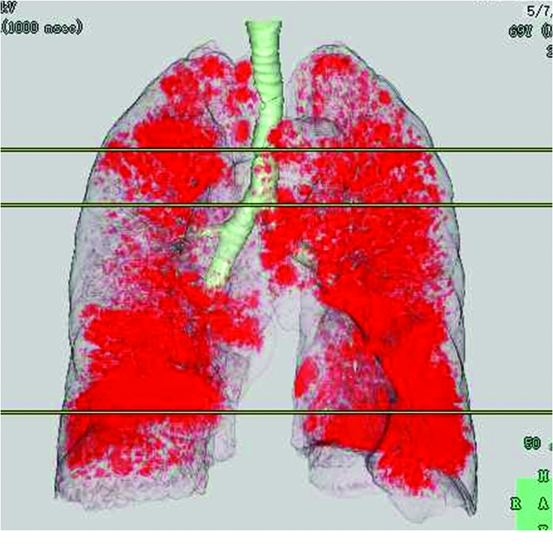
图1 全小叶型肺气肿,软件自动获得的LAV%(红色部分代表CT值小于-950 Hu区域)
Figure 1 Panlobular emphysema,LAV% was obtained automatically with use of the software(volume of the lungs having a CT value of less than -950 Hu is shown in red
2 结 果
2.1 CLE组与PLE组LAV%和PFT指标比较 CLE组两肺、右肺、右肺上叶、右肺中叶、右肺下叶、左肺、左肺上叶、左肺下叶LAV%均低于PLE组,CLE组DLco%显著高于PLE组(P<0.05);2组FEV1%、FEV1/FVC及RV/TLC差异均无统计学意义(P>0.05)。见表1,2。
表1 CLE组与PLE组LAV%比较
Table 1 Comparison of LAV% between CLE group and PLE group [M(Q25,Q75),%]
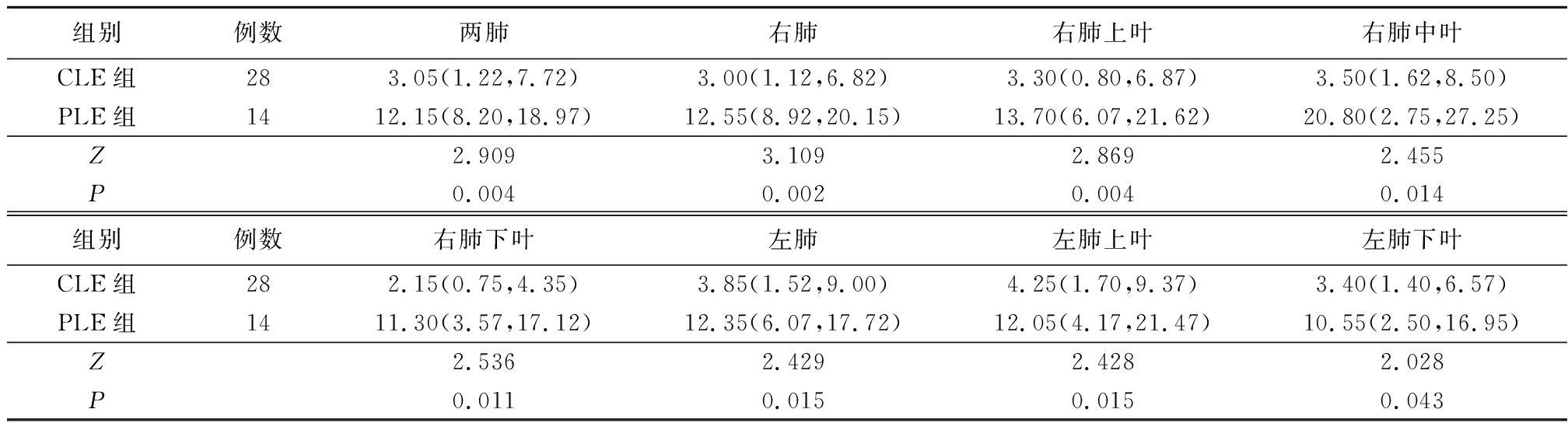
组别例数两肺右肺右肺上叶右肺中叶CLE组283.05(1.22,7.72)3.00(1.12,6.82)3.30(0.80,6.87)3.50(1.62,8.50)PLE组1412.15(8.20,18.97)12.55(8.92,20.15)13.70(6.07,21.62)20.80(2.75,27.25)Z2.9093.1092.8692.455P0.0040.0020.0040.014组别例数右肺下叶左肺左肺上叶左肺下叶CLE组282.15(0.75,4.35)3.85(1.52,9.00)4.25(1.70,9.37)3.40(1.40,6.57)PLE组1411.30(3.57,17.12)12.35(6.07,17.72)12.05(4.17,21.47)10.55(2.50,16.95)Z2.5362.4292.4282.028P0.0110.0150.0150.043
表2 CLE组及PLE组肺功能比较
Table 2 Comparison of PFT between CLE group and PLE group [M(Q25,Q75)]
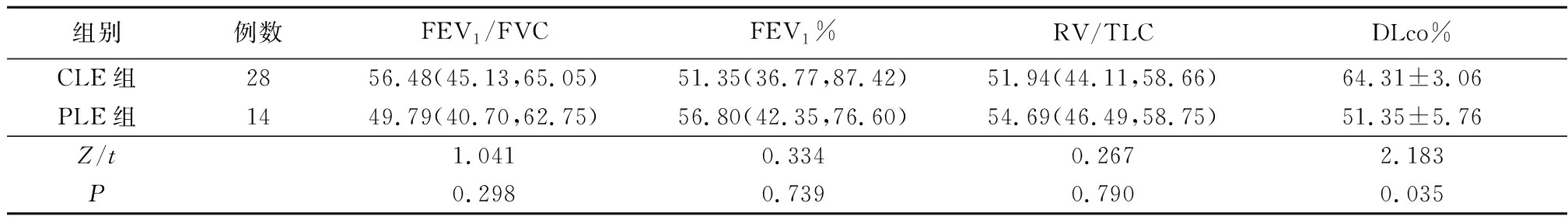
组别例数FEV1/FVCFEV1%RV/TLCDLco%CLE组2856.48(45.13,65.05)51.35(36.77,87.42)51.94(44.11,58.66)64.31±3.06PLE组1449.79(40.70,62.75)56.80(42.35,76.60)54.69(46.49,58.75)51.35±5.76Z/t1.0410.3340.2672.183 P0.2980.7390.7900.035
2.2 各肺叶LAV%与PFT指标相关性分析 两肺、右肺、右肺上叶、右肺中叶、右肺下叶、左肺、左肺上叶、左肺下叶LAV%与FEV1/FVC呈负相关(P<0.05),两肺、右肺、右肺上叶、右肺下叶、左肺、左肺上叶、左肺下叶LAV%与DLco%呈负相关(P<0.05);两肺、右肺、右肺上叶、右肺中叶、右肺下叶、左肺、左肺上叶、左肺下叶LAV%与FEV1%和RV/TLC无相关性(P>0.05)。见表3。
表3 LAV%与PFT指标相关性
Table 3 Correlation coefficient between LAV% and PFT
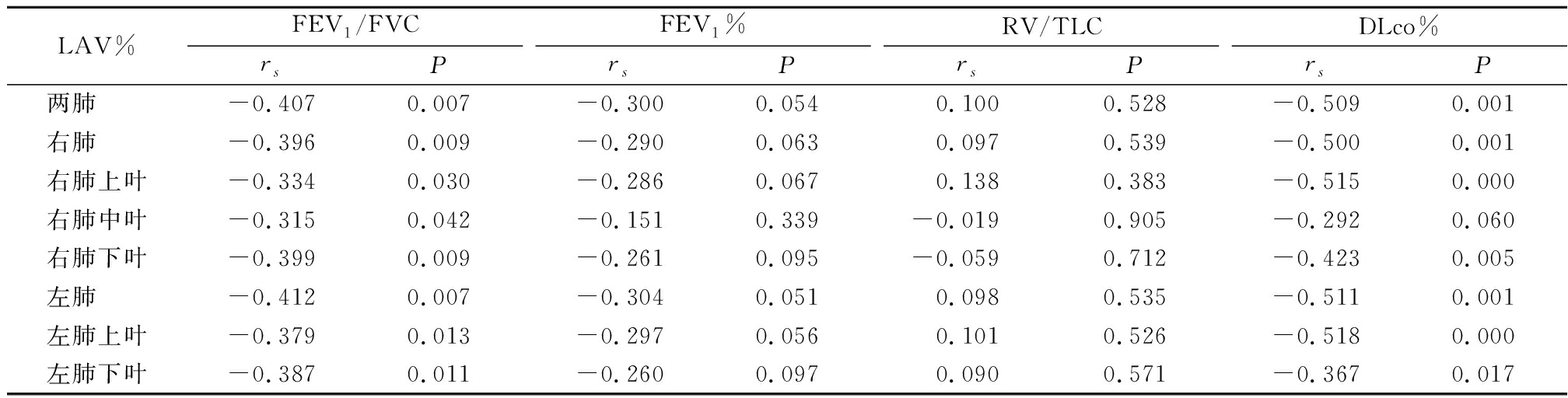
LAV%FEV1/FVCrsPFEV1%rsPRV/TLCrsPDLco%rsP两肺 -0.407 0.007-0.3000.0540.1000.528-0.509 0.001右肺 -0.396 0.009-0.2900.0630.0970.539-0.500 0.001右肺上叶-0.334 0.030-0.2860.0670.1380.383-0.515 0.000右肺中叶-0.315 0.042-0.1510.339-0.0190.905-0.2920.060右肺下叶-0.399 0.009-0.2610.095-0.0590.712-0.423 0.005左肺 -0.412 0.007-0.3040.0510.0980.535-0.511 0.001左肺上叶-0.379 0.013-0.2970.0560.1010.526-0.518 0.000左肺下叶-0.387 0.011-0.2600.0970.0900.571-0.367 0.017
3 讨 论
3.1 MSCT定量评估肺气肿的优势及临床意义 COPD是一个可预防、可治疗的疾病,其特征是持续性气流受限,气流受限主要原因是小气道塑形及肺气肿。PFT是测量肺功能的最常用的客观指标,对诊断和治疗COPD均有重要意义。但PFT主要反映患者持续性气流受限的程度,对评价COPD存在一些不足:①对COPD肺气肿诊断不敏感,当肺组织破坏超过30%时PFT才会出现改变[8];②以FEV1/FVC<70%作为诊断COPD的标准可能导致诊断不足或诊断过度;③在有明确诊断的COPD 患者中,即使气流受阻处于同一水平,其临床、影像学表现及肺功能亦存在很大差异。因此,单一PFT数据不能全面反映COPD的功能状态。近年来,肺气肿CT定量评估及其与肺功能的相关性成为研究热点,各种MSCT技术能够早期发现小范围肺气肿病灶,能够对肺气肿的范围及严重程度进行精确的定量分析[9]。MSCT是非侵入性方法诊断和评估肺气肿病理改变的首选方法,与组织病理学有高度的一致性[1]。尤其是采用的肺气肿阈值标准为-950 Hu [6,10-11],所得到的LAV%与病理所见及肺功能相关性较好。LAV%能得出肺气肿比例的准确数据,明确责任肺叶组织的损伤程度,为临床评估肺储备功能及外科肺减容手术提供客观依据,且肺气肿MSCT 定量评估对于确定肺气肿的范围及分布比主观视觉评价更为精确,偏差较小[12],减少了因主观判断病变范围带来的误差,使外科医师可以明确目标,对功能减低或无功能的肺组织进行精准切除。
3.2 全肺及肺叶LAV%与PFT的相关性 Crossley等[10]Meta分析显示, LAV%与FEV1/FVC呈负相关,但相关系数有很宽的范围,为-0.1~-0.8。本研究结果显示全肺及各叶LAV%均与FEV1/FVC呈负相关。提示肺气肿越严重,肺功能越差,气道阻力也越大,这与COPD的病理改变相一致。LAV%与FEV1/FVC相关系数差异较大的原因可能是:FEV1是通过测定整个呼吸道的气流量间接反映肺功能状况,而CT评价肺气肿是通过测量由于终末细支气管远端的小气道弹性下降,肺体积增大、过度充气与膨胀,同时伴有肺泡壁的破坏,引起局部肺CT值降低。由于两者反映的解剖部位不同,故两者的相关性会表现出很大的异质性。此外,不同的肺气肿测量软件、CT扫描层厚、不同的图像重建方式、肺气肿CT阈值的选定及扫描时患者深吸气的程度等因素均会影响CT测量肺气肿的准确性[13]。多数研究显示,肺的弥散功能DLco%与全肺LAV%有较强相关性[11,14-15],阈值为-950 Hu的LAV%是唯一的独立相关因子[16]。本研究结果显示全肺及各叶LAV%均与DLco%呈负相关,与上述文献基本一致。这是因为DLco%是对肺泡-毛细血管膜破坏的一个测量指标,由于肺气肿时肺组织通气血流比值失调及肺泡壁破坏、肺弥散面积减少等,影响肺换气功能所致[17]。Ostridge等[16]研究显示DLco%与上叶肺气肿的相关程度更强,而Li 等[18]研究则显示DLco%与下叶肺气肿的相关性更强。本研究结果与前者相一致。出现不同结果的原因可能是由于评估肺气肿分布的方法不同[19]。此外,样本量的大小及样本中肺气肿程度的不同对结果也会产生影响。
3.3 CLE组与PLE组LAV%及肺功能参数比较 CLE的病理改变主要是次级肺小叶中心的肺泡间隔的破坏消失,而PLE是次级肺小叶全部的肺泡间隔均匀破坏消失,由于这种均匀破坏使得在CT上通过人眼很难主观判断PLE,而定量CT通过LAV%定量测量肺气肿,明显优于人眼的主观判断[20]。
不同类型的肺气肿在肺内的空间分布是不均匀的,肺气肿的空间分布影响肺功能及临床严重程度,下叶肺气肿分布为主的患者肺功能相对较差,临床严重程度亦更重,而上叶分布为主的肺气肿5年进展率、气体潴留及呼吸困难更为严重[11,21]。CLE以上叶分布为主,而α1抗胰蛋白酶缺乏相关的PLE以下叶分布为主[5]。高利红等[22]研究显示PLE在MSCT冠状位MinP图像上,一般以两上肺病情更严重。本研究42例肺气肿患者中,CLE患者28例,PLE患者14例;CLE及PLE均以上叶分布为主。PLE患者的 LAV%程度显著重于CLE,其原因可能是CLE是COPD肺气肿的早期改变,而PLE是肺气肿的较晚期表现[7,22]。本研究CLE组DLco%明显高于PLE组,2组肺气肿间气道阻力参数FEV1/FVC和FVC差异无统计学意义。提示PLE患者肺泡壁破坏及肺弥散面积减少显著重于CLE。
本研究的限度:首先,肺气肿的诊断是根据CT阈值进行判断的,无病理证实的病例;其次,样本量较少,在COPD肺气肿分型中未包括间隔旁肺气肿;再次,没有对肺气肿患者的小气道进行定量分析,在肺功能分析中,没能排除小气道对气道阻力的影响。
[1] Vestbo J,Hurd SS,Agustí AG,et al. Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J]. Am J Respir Crit Care Med,2013,187(4):347-365.
[2] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J/CD].中国医学前沿杂志:电子版,2014,6(2):67-79,80.
[3] 方元,管宇,夏艺,等.低剂量条件下全模型迭代重建技术的肺容积定量研究[J].实用放射学杂志,2017,33(10):1600-1604.
[4] 朱珍,殷少军,魏丽,等.脂联素水平与慢性阻塞性肺疾病严重程度及CT特征的关系[J].中华老年多器官疾病杂志,2017,16(6):401-405.
[5] Lynch DA,Austin JH,Hogg JC,et al. CT-Definable Subtypes of Chronic Obstructive Pulmonary Disease:A Statement of the Fleischner Society[J]. Radiology,2015,277(1):192-205.
[6] 阎超群,张攀,史达,等.基于高分辨率CT对慢性阻塞性肺疾病的定量测量与临床肺功能对照研究[J].实用医学杂志,2016,32(8):1258-1261.
[7] Sverzellati N,Lynch DA,Pistolesi M,et al. Physiologic and quantitative computed tomography differences between centrilobular and panlobular emphysema in COPD[J]. Chronic Obstr Pulm Dis,2014,1(1):125-132.
[8] Choromanska A,Macura KJ. Role of computed tomography in quantitative assessment of emphysema[J]. Pol J Radiol,2012,77(1):28-36.
[9] 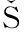 ileikiene V,Urbonas M,Mataciünas M,et al. Relationships between pulmonary function test parameters and quantitative computed tomography measurements of emphysema in subjects with chronic obstructive pulmonary disease[J]. Acta Med Litu,2017,24(4):209-218.
ileikiene V,Urbonas M,Mataciünas M,et al. Relationships between pulmonary function test parameters and quantitative computed tomography measurements of emphysema in subjects with chronic obstructive pulmonary disease[J]. Acta Med Litu,2017,24(4):209-218.
[10] Crossley D,Renton M,Khan M,et al. CT densitometry in emphysema:a systematic review of its clinical utility[J]. Int J Chron Obstruct Pulmon Dis,2018,13:547-563.
[11] 喻晴,沈其晓,韩丽莹,等.慢性阻塞性肺疾病患者肺气肿空间分布对肺功能及临床严重程度的影响[J].中国医学影像技术,2018,34(5):692-696.
[12] 方元,管宇,夏艺,等.肺气肿CT定量评估在主观评价正常人群中的应用价值[J].实用放射学杂志,2017,33(12):1939-1942.
[13] 程挺,李勇,程齐俭,等.4种评估肺气肿的CT指标的比较及层厚和重建方式的影响[J].上海交通大学学报:医学版,2015,35(11):1613-1618.
[14] 张攀,于化鹏,樊慧珍,等.高分辨率CT肺气肿定量与慢性阻塞性肺疾病严重程度的相关性[J].实用医学杂志,2016,32(13):2187-2190.
[15] Mohamed Hoesein FA,de Jong PA,Lammers JW,et al. Contribution of CT quantified emphysema,air trapping and airway wall thickness on pulmonary function in male smokers with and without COPD[J]. COPD,2014,11(5):503-509.
[16] Ostridge K,Williams NP,Kim V,et al. Relationship of CT-quantified emphysema,small airways disease and bronchial wall dimensions with physiological,inflammatory and infective measures in COPD[J]. Respir Res,2018,19(1):31.
[17] Grydeland TB,Thorsen E,Dirksen A,et al. Quantitative CT measures of emphysema and airway wall thickness are related to D(L)CO[J]. Respir Med,2011,105(3):343-351.
[18] Li JS,Zhang HL,Bai YP,et al. Diagnostic value of computed tomography in chronic obstructive pulmonary disease:a systematic review and meta-analysis[J]. COPD,2012,9(5):563-570.
[19] Bastos HN,Neves I,Redondo M,et al. Influence of emphysema distribution on pulmonary function parameters in COPD patients[J]. J Bras Pneumol,2015,41(6):489-495.
[20] Bhatt SP. Panlobular Emphysema:Enhancing visibility with quantitative computed tomography [J]. Chronic Obstr Pulm Dis,2016,3(3):683-687.
[21] Boueiz A,Chang Y,Cho MH,et al. Lobar emphysema distribution Is associated with 5-year radiologic disease progression[J]. Chest,2018,153(1):65-76.
[22] 高利红,郑耀麟,朱正元,等.MSCT MinP成像在肺气肿诊断中的应用价值[J].临床放射学杂志,2014,33(12):1947-1950.