近年来随着影像技术的不断发展,MRI新序列不断增多,扫描时间不断缩短,在全身各部位的应用愈加广泛。其中的弥散加权成像(diffusion weighted imaging,DWI)序列,是至今唯一可在活体检测水分子弥散运动的检查方法,并可得到量化参数——全病变表观弥散系数(apparent diffusion coefficient,ADC)值,故一直以来均是研究的热点,目前已广泛应用于临床。由于大部分研究测量的是病变最大截面感兴趣区(region of interest,ROI)的ADC值,不能反映病变的异质性,而全病变ADC直方图是对病变范围内全部体素的总和,可以反映全部病变中ADC值的分布特征与病变的异质性。有关肺部病变ADC直方图的研究较少,本研究旨在初步探讨全病变ADC直方图在肺部良恶性病变鉴别诊断中的价值。
1 资料与方法
1.1 一般资料 收集2016年12月—2017年12月在我院就诊的肺部病变患者39例,男性24例,女性15例,年龄16~69岁,平均(39.5±17.4)岁。其中肺癌22例(包括腺癌13例,小细胞癌3例,鳞癌5例,肉瘤样癌1例),肺部良性病变17例(包括肺炎13例,结核4例)。 纳入标准:肺部病变表现为较大肿块或实变(直径>3 cm)。所有患者均于治疗前在我院行肺部MRI检查。其中肺癌患者在我院手术或经肺部穿刺活检确诊;肺炎需经临床诊断(典型症状、体征,白细胞改变及影像表现等)确诊;肺结核需含有较大结节或实变病灶(直径>3 cm),包括菌阳肺结核与菌阴肺结核。
1.2 仪器 磁共振扫描应用SEIMENS Avanto 1.5T超导MRI成像系统,体部相控阵表面线圈。对患者行屏气训练,常规序列均采用深吸气后屏气扫描。扫描参数:TR 2 200 ms,TE 90 ms,FOV 33 cm,矩阵256×256,层厚4 mm,层间隔1.5 mm。DWI序列采用单次激发自旋回波-平面回波成像序列(spin echo-echo planar imaging,SE-EPI),在自由呼吸状态下采集图像,b值分别取0,50,150,400,600和800 s/mm2,TR 4 000 ms,TE48.9 ms,FOV 33 cm,矩阵128×128,层厚4 mm,层间隔1.5 mm。
1.3 DWI扫描 扫描方法分2种:屏气扫描和自由呼吸扫描。屏气扫描检查时间较短,但信噪比较低,且该扫描方式空间分辨率较低;自由呼吸扫描可以由心脏触发和(或)呼吸触发,心脏触发有助于避免搏动伪影,但扫描时间较长,而呼吸触发的扫描较常用,其DWI图像质量要高于屏气扫描所得图像[1]。本研究DWI扫描采用自由呼吸扫描[2],导航回波法的呼吸触发。
1.4 图像分析与测量 将所有患者的DWI图像以DICOM格式从西门子工作站导出至个人电脑,用FireVoxel软件(纽约大学,USA)进行图像分析。用单指数模型重建ADC值图。在所有包含病变的层面手工勾画ROI,范围尽可能包含全部病变,包括坏死、囊变、出血区,得到全病变ADC直方图,记录其特征参数,包括ADC峰度、偏度、熵、平均数、中位数、标准差、体积和ADC第5,10,15,30,50,70,90百分位数(ADC5th、ADC10th、ADC15th、ADC30th、ADC50th、ADC70th、ADC90th)。并绘制各参数的受试者工作特征(receiver operator characteristic,ROC)曲线,比较其曲线下面积(area under curve,AUC),得出诊断效能最高的指标,并计算最佳诊断阈值。
1.5 统计学方法 应用SPSS 16.0统计软件处理数据。非正态分布计量资料[以M(QR)表示]比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结 果
2.1 肺癌与肺部良性病变ADC直方图参数比较 肺癌组ADC直方图参数偏度、峰度、平均数、标准差均低于肺部良性病变组(P<0.05);2组熵和体积差异均无统计学意义(P>0.05)。见表1。
表1 肺癌与肺部良性病变ADC直方图特征参数比较
Table 1 Comparison of ADC histogram characteristic parameters of lung cancer and lung benign lesions [M(QR)]
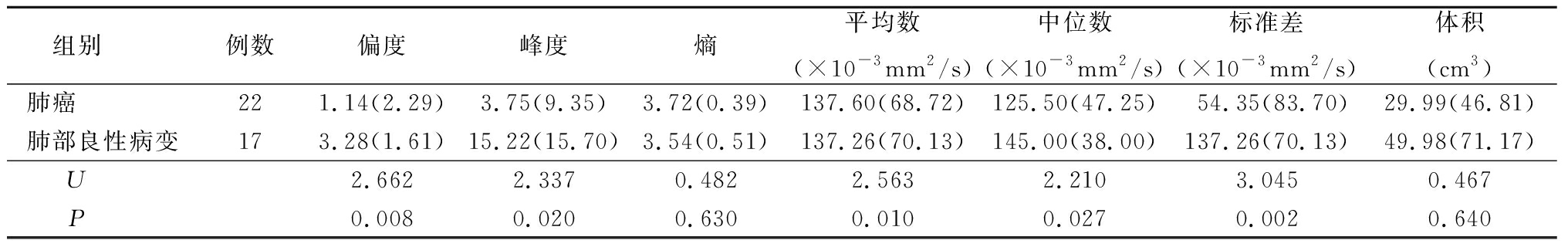
组别 例数偏度峰度熵平均数(×10-3mm2/s)中位数(×10-3mm2/s)标准差(×10-3mm2/s)体积(cm3)肺癌 221.14(2.29)3.75(9.35)3.72(0.39)137.60(68.72)125.50(47.25)54.35(83.70)29.99(46.81)肺部良性病变173.28(1.61)15.22(15.70)3.54(0.51)137.26(70.13)145.00(38.00)137.26(70.13)49.98(71.17)U 2.6622.3370.4822.5632.2103.0450.467P 0.0080.0200.6300.0100.0270.0020.640
2.2 肺癌与肺部良心病变ADC值百分数比较 肺癌组ADC50th、ADC70th、ADC90th均低于肺部良性病变组(P<0.05);2组ADC5th、ADC10th、ADC15th、ADC30th差异均无统计学意义(P>0.05)。见表2。
表2 肺癌与肺部良性病变ADC值百分数比较
Table 2 Comparison of ADC values between lung cancer and lung benign lesions [M(OR),×10-3mm2/s]
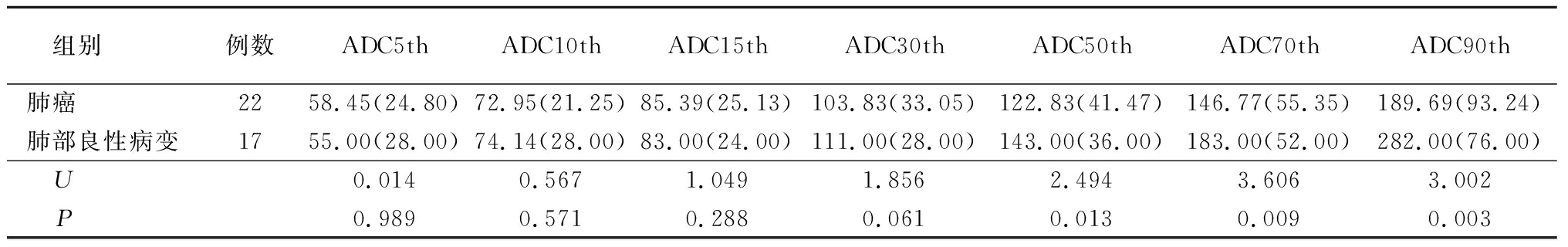
组别 例数ADC5thADC10thADC15thADC30thADC50thADC70thADC90th肺癌 2258.45(24.80)72.95(21.25)85.39(25.13)103.83(33.05)122.83(41.47)146.77(55.35)189.69(93.24)肺部良性病变1755.00(28.00)74.14(28.00)83.00(24.00)111.00(28.00)143.00(36.00)183.00(52.00)282.00(76.00)U 0.0140.5671.0491.8562.4943.6063.002P 0.9890.5710.2880.0610.0130.0090.003
2.3 ADC直方图参数最佳诊断效能 本研究ADC直方图各参数ROC曲线的AUC均位于0.7~0.8之间,说明有中度诊断效能。 ADC标准差的诊断效能最高,当ADC标准差为0.810(×10-3mm2/s)时,AUC为0.789,特异度为94.1%,敏感度为68.2%;其次为ADC90th, 当ADC90th为1.940(×10-3mm2/s)时,AUC为0.785,特异度为94.1%,敏感度为54.5%。见表3。
表3 部分有诊断意义ADC直方图参数的诊断效能
Table 3 The diagnostic efficiency of some ADC value histogram parameters that have diagnostic value
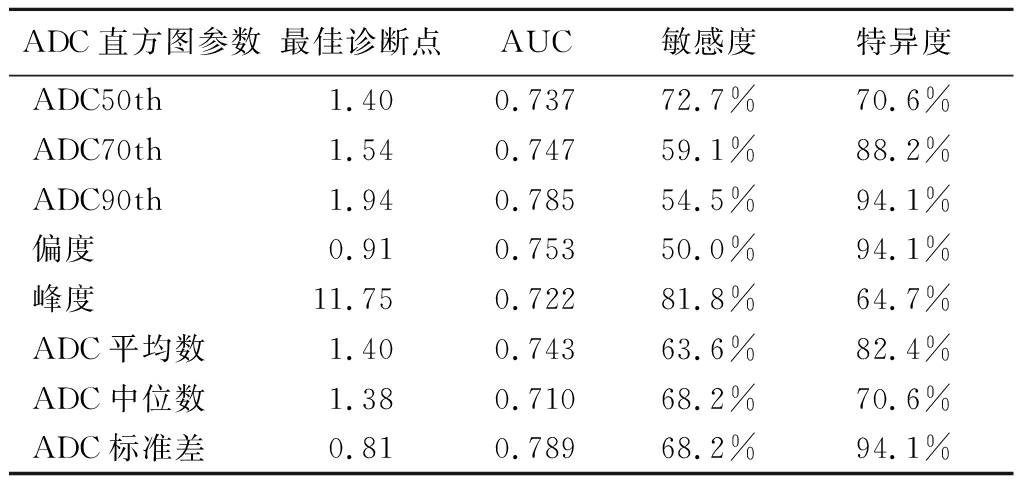
ADC直方图参数最佳诊断点AUC敏感度特异度ADC50th1.400.73772.7%70.6%ADC70th1.540.74759.1%88.2%ADC90th1.940.78554.5%94.1%偏度0.910.75350.0%94.1%峰度11.750.72281.8%64.7%ADC平均数1.400.74363.6%82.4%ADC中位数1.380.71068.2%70.6%ADC标准差0.810.78968.2%94.1%
3 讨 论
近年来,MRI检查中的DWI序列在全身各部位肿瘤的应用研究不断增多。以肺部来说,DWI在肺部良恶性病变鉴别[3]、肺癌分类与分级[4-5]、肺癌化疗早期效果评价[6-7]等方面均有较大的应用价值。Shen等[8]Meta分析显示,肺部恶性病变ADC值明显低于肺部良性病变(P<0.05),小细胞癌与非小细胞癌间ADC值也有显著差异(P<0.05),而不同类型肺癌间ADC值差异不显著。大部分研究测量ADC值时采用的是测量病变最大截面ROI平均值的方法,但不可避免地会遗漏病变边缘或坏死、囊变、出血、坏死等区域,从而不能全面反映病变组织的异质性,存在测量偏差[9]。而全病变ADC直方图则是将病变全部体素ADC值进行总和,并以直方图的形式表示出来,可较全面地反映病变的异质性,为临床提供更多有意义的ADC值相关参数。
之前对乳腺癌[10]、宫颈癌[11]、子宫内膜癌[12]、前列腺癌[13]、脑胶质瘤[14]等进行ADC直方图研究中,低ADC百分数(尤其是ADC10th,ADC5th)被认为可鉴别肿瘤的良恶性。而且Yuan等[3]在对孤立性肺部病变的研究中,得出ADC10th和纯扩散系数,尤其是后者,在鉴别孤立性肺部病变良恶性中准确度更高。这些学者认为低ADC百分数与肿瘤内细胞密度高的部分有相关性,并且随着肿瘤级别的升高而减低。因为高级别肿瘤细胞密度较高,细胞外间隙较小,故水分子弥散度减小。
与之相反,Tsuchiya等[4]研究则认为ADC95th是区分高级别与低级别肺部肿瘤的最佳指标。本研究得出的结论与其类似,即在肺部良恶性疾病的鉴别中,高ADC百分数(尤其是ADC90th)较低ADC百分数有更高的诊断效能。一个可能的解释是:肺癌较肺部良性病变含有较多的黏液、微出血与组织紊乱成分,这些成分均导致水分子弥散受限,进而ADC值减小,而高ADC百分数可更好地反映这些成分的影响。
除了ADC百分数,本研究显示肺癌与肺部良性病变在ADC直方图的形态上也有区别。峰度反映直方图的形态是平缓还是陡峭,峰度越大,直方图形态越陡峭,正态分布的峰度为3,峰度越高病变的内部结构越致密。偏度是对直方图分布不均的测量,正态分布的偏度为0,当偏度为负值时直方图向右偏称为“负偏度”,当偏度为正值时直方图向左偏称为“正偏度”。肺癌的偏度、峰度均低于肺部良性病变,说明肺癌的ADC直方图略左偏,较平缓;而肺部良性病变的直方图较其左偏更明显,且较陡峭。在本研究中,ADC标准差的诊断效能与ADC90th相当,作者认为其反映了ADC值的离散程度,也即病变组织的异质性。本研究中,肺癌的ADC标准差小于肺部良性病变,说明肺癌组织细胞排列紧密,异质性较小。Lu等[15]研究显示,胸部恶性病变ADC标准差大于良性病变(P<0.05),原发性肺癌ADC标准差大于肺部转移瘤(P<0.05),而胸部良恶性病变间ADC平均值差异无统计学意义(P>0.05)。本研究结论与其类似。
本研究存在以下不足:①肺部良性病变主要纳入肺炎与结核病例,其中又以肺炎为主,而肺部良性肿瘤如错构瘤等未能纳入,存在选择偏倚;②本研究ADC值计算采用单指数模型,未能将组织灌注与水分子弥散运动区分开,而采用双指数模型对肿瘤进行ADC直方图分析能得到肯定结论[3,16-17];③病例数不足,本研究共收集39例,得出的多项ADC直方图相关参数诊断效能相近,且结论与之前部分研究结果不一致,尚需要大样本临床试验进一步探讨。
总之,全病变ADC直方图可用于鉴别肺部良恶性病变,其中ADC标准差诊断效能最高。
[1] Kartalis N,Loizou L,Edsborg N,et al. Optimising diffusion-weighted MR imaging for demonstrating pancreatic cancer:a comparison of respiratory-triggered,free-breathing and breath-hold techniques[J]. Eur Radiol,2012,22(10):2186-2192.
[2] Bernardin L,Douglas NH,Collins DJ,et al. Diffusion-weighted magnetic resonance imaging for assessment of lung lesions:repeatability of the apparent diffusion coefficient measurement [J]. Eur Radiol,2014,24(2):502-511.
[3] Yuan M,Zhong Y,Zhang YD,et al. Volume analysis of intravoxel incoherent motion imaging for assessment of solitary pulmonary lesions[J]. Acta Radiol,2017,58(12):1448-1456.
[4] Tsuchiya N,Doai M,Usuda K,et al. Non-small cell lung cancer:whole-lesion histogram analysis of the apparent diffusion coefficient for assessment of tumor grade,lymphovascular invasion and pleural invasion [J]. PLoS One,2017,12(2):e0172433.
[5] Liu H,Liu Y,Yu T,et al. Evaluation of apparent diffusion coefficient associated with pathological grade of lung carcinoma,before therapy [J]. J Magn Reson Imaging,2015,42(3):595-601.
[6] 蒋洁智,李鹍,封俊,等.ADC直方图评估肺癌化疗早期疗效的应用初探[J].影像诊断与介入放射学,2016,25(1):13- 16.
[7] Yu J,Li W,Zhang Z,et al. Prediction of early response to chemotherapy in lung cancer by using diffusion-weighted MR imaging[J]. Scientific World Journal,2014,2014:135841.
[8] Shen G,Jia Z,Deng H. Apparent diffusion coefficient value of diffusion-weighted imaging for distinguishing focal pulmonary lesions and characterization the subtype of lung cancers:a meta-analysis[J]. Eur Radiol,2016,26(2):556-566.
[9] Ma G,Zhu LN,Su GY,et al. Histogram analysis of apparent diffusion coefficient maps for differentiating malignant from benign parotid gland tumors[J]. Eur Arch Otorhinolaryngo,2018,275(8):2151-2157.
[10] Bougias H,Ghiatas A,Priovolos D,et al. Whole-lesion histogram analysis metrics of the apparent diffusion coefficient as a marker of breast lesions characterization at 1.5 T[J]. Radiography(Lond),2017,23(2):e41-46.
[11] 陆媛媛,黄群英,孙明华,等.ADC直方图区分宫颈癌常见病理类型的价值[J].中国医学计算机成像杂志,2015,21(3):255-259.
[12] Woo S,Cho JY,Kim SY,et al. Histogram analysis of apparent diffusion coefficient map of diffusion-weighted MRI in endometrial cancer:a preliminary correlation study with histological grade[J]. Acta Radiol,2014,55(10):1270-1277.
[13] Liu W,Liu XH,Tang W,et al. Histogram analysis of stretched-exponential and monoexponential diffusion-weighted imaging models for distinguishing low and intermediate/high gleason scores in prostate carcinoma[J]. J Magn Reson Imaging,2018,48(2):491-498.
[14] 袁涛,舒彩坤,全冠民,等.多b值ADC直方图评价高级别胶质瘤治疗后进展的初步研究[J].中国医学影像学杂志,2017,25(2):93-97.
[15] Lu NH,Hung CM,Liu KY,et al. Diagnosed chest lesion on diffusion-weighted magnetic resonance images using apparent diffusion coefficients[J]. J Xray Sci Technol,2016,24(1):133-143.
[16] 张配配,王良,闵祥德,等.DWI单指数和双指数模型在前列腺癌Gleason分级中的应用:基于三维立体直方图分析[J].磁共振成像,2017,8(9):668-674.
[17] 王丰,周延,王玉湘,等.MR扩散加权成像单指数模型及体素内不相干运动模型参数直方图对上皮性卵巢癌分型的价值[J].中华放射学杂志,2016,50(10):768-773.