骨科下肢手术常需要用到充气式止血带以减少术野出血,但应用止血带会引起组织和器官产生缺血再灌注损伤,特别是心血管系统的损伤。而糖尿病患者更容易因手术创伤导致过度应激,炎症因子大量释放,加重心肌损伤。右美托咪定为高选择性α2受体激动剂,可抑制手术创伤引起的应激反应,降低止血带诱发的缺血再灌注损伤。有研究表明右美托咪定可降低术中血糖,改善胰岛素抵抗[1]。但针对糖尿病患者胰岛素抵抗及心肌损伤影响的研究较少。本研究旨在观察右美托咪定对糖尿病患者行下肢止血带手术炎症反应、胰岛素抵抗及心肌损伤的影响,报告如下。
1 资料与方法
1.1 一般资料 选择2016年1—12月于河北医科大学第一医院择期全身麻醉下接受骨科下肢手术(手术时间>2 h)的2型糖尿病患者60例,患者术前均控制空腹血糖<7.8 mmol/L,餐后2 h血糖<11.1 mmol/L,无严重并发症,心、肝、肾功能无明显异常,美国纽约心脏学会(New York Heart Association, NYHA)心功能分级Ⅰ级或Ⅱ级,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅱ级或Ⅲ级。按随机数字表法分为右美托咪定组(观察组)和对照组各30例。观察组男性16例,女性14例,年龄55~72岁,平均(62.6±5.1)岁;NYHA心功能分级Ⅰ级20例,Ⅱ级10例;ASA分级Ⅱ级19例,Ⅲ级11例。对照组男性18例,女性12例,年龄56~75岁,平均(63.9±5.0)岁;NYHA心功能分级Ⅰ级22例,Ⅱ级8例;ASA分级Ⅱ级20例,Ⅲ级10例。2组性别、年龄、NYHA心功能分级、ASA分级差异均无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理研究委员会批准;患者或家属均签署知情同意书。
1.2 麻醉方法 患者入手术室后建立静脉通路,常规监测血压、心率和脉搏血氧饱和度。麻醉诱导:静脉注射咪唑安定0.03 mg/kg,舒芬太尼0.4 μg/kg,依托咪酯0.3 mg/kg,罗库溴铵0.6 mg/kg诱导,气管插管后行机械通气,氧流量2 L/min,潮气量10~12 mL/kg,呼吸频率12~18次/min,吸呼比1∶2,监测呼气末二氧化碳分压(end tidal carbon dioxide tension,PETCO2)维持在35~45 mmHg。行右颈内静脉穿刺放置中心静脉导管用于术中补液及抽取血标本。麻醉维持:丙泊酚4~6 mg·kg-1·h-1,瑞芬太尼0.2~0.5 μg·kg-1·min-1持续输注,吸入1%~2%浓度七氟醚,间断静脉注射苯磺酸顺式阿曲库铵0.05~0.1 mg/kg,维持脑电双频指数(bispectral index,BIS)在45~60之间。维持心率、血压在基础值上下30%。麻醉诱导后观察组给予初始剂量1 μg/kg右美托咪定(给药时间15 min),之后以0.5 μg·kg-1·h-1速率维持至术毕;对照组以同样的方法给予等容量生理盐水。
1.3 观察指标 止血带使用前先抬高患者下肢5 min,自下肢远端驱血带驱血,至股骨上1/3处上自动充气式止血带,单次阻断时间80~110 min,压力250~300 mmHg。分别于上止血带前(T0)、松止血带后15 min(T1)、松止血带后1 h(T2)和松止血带后12 h(T3)各时间点抽取颈内静脉血5 mL,以3 500 r/min离心10 min后留取上清液,-20 ℃保存,采用酶联免疫吸附法测定血清中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)浓度;电化学发光法测血清胰岛素水平,葡萄糖氧化酶法测血糖水平,计算胰岛素敏感指数(ISI)=1/(血糖×胰岛素),测定值按校正值-实测值×(术前Hct/采样时的Hct)进行校正;化学发光法测定血清肌钙蛋白I(cardiac troponin I,cTnI)浓度,免疫抑制法测定磷酸肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)浓度。检测时均按照试剂盒要求进行操作。
1.4 统计学方法 应用SPSS 15.0统计软件分析数据。计量资料比较分别采用t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组血清炎症因子水平比较 2组TNF-α水平呈先升高再降低的趋势,T2达峰值,观察组低于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05);2组IL-6水平呈逐渐升高趋势,观察组低于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表1。
表1 2组炎症因子水平比较
Table 1 Comparison of inflammatory factors between two groups![]()
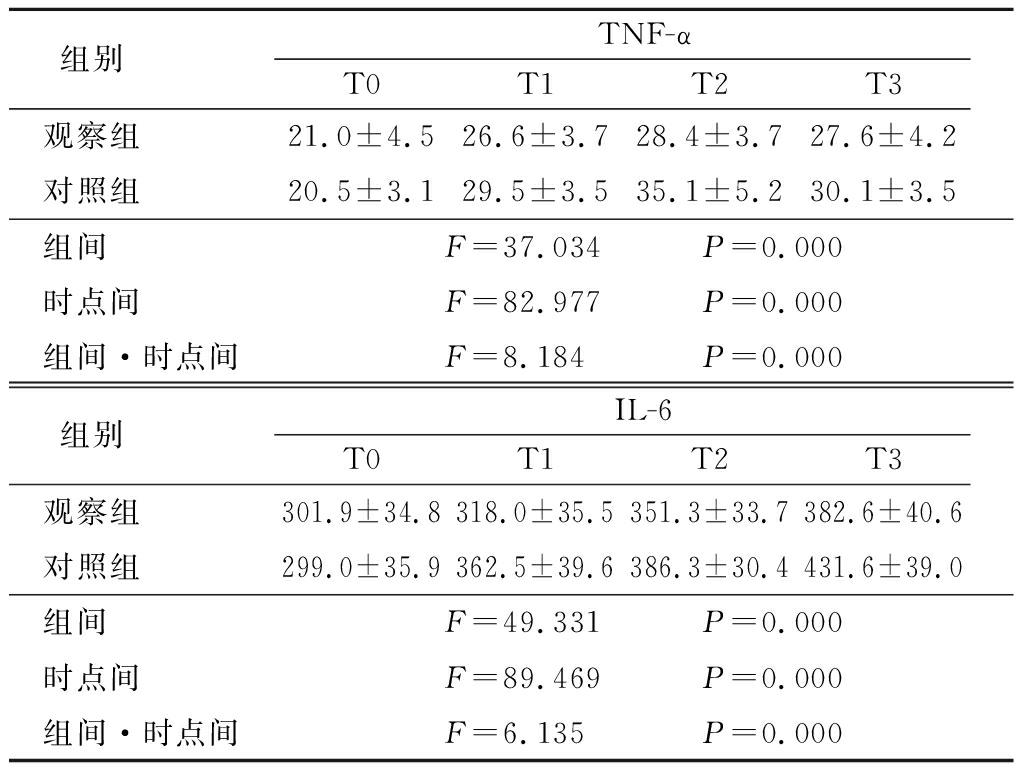
组别 TNF-αT0T1T2T3观察组 21.0±4.526.6±3.728.4±3.727.6±4.2对照组 20.5±3.129.5±3.535.1±5.230.1±3.5组间 F=37.034 P=0.000时点间 F=82.977 P=0.000组间·时点间F=8.184 P=0.000组别 IL-6T0T1T2T3观察组 301.9±34.8318.0±35.5351.3±33.7382.6±40.6对照组 299.0±35.9362.5±39.6386.3±30.4431.6±39.0组间 F=49.331 P=0.000时点间 F=89.469 P=0.000组间·时点间F=6.135 P=0.000
2.2 2组血糖、胰岛素水平比较 2组血糖、胰岛素水平均呈先升高再降低的趋势,T2时达峰值,观察组低于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05);2组ISI均呈降低趋势,观察组高于对照组,其组间、时点间差异有统计学意义(P<0.05),组间·时点间交互作用差异无统计学意义(P>0.05)。见表2。
表2 2组血糖、胰岛素水平比较
Table 2 Comparison of blood glucose and insulin levels between two groups![]()
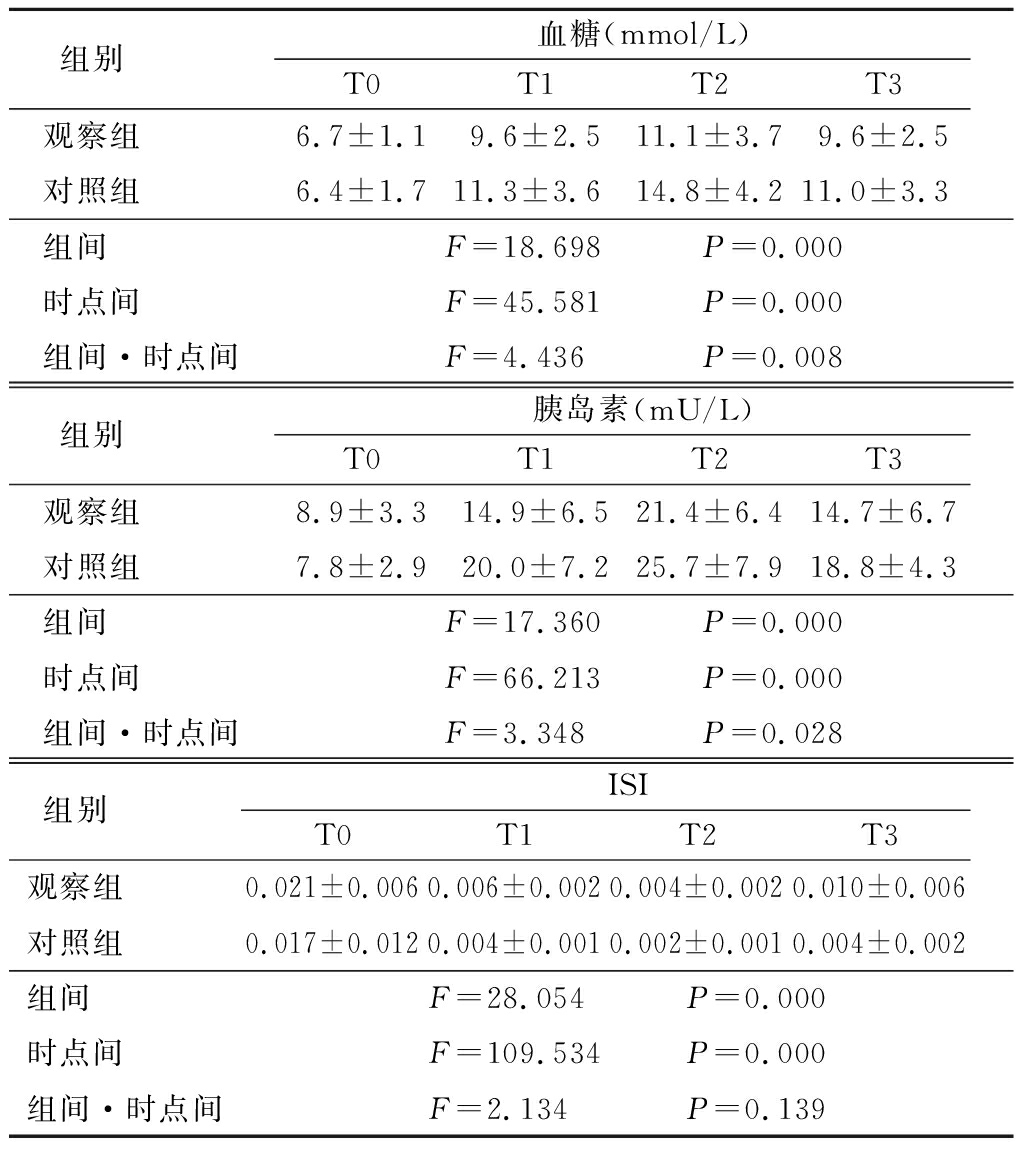
组别 血糖(mmol/L)T0T1T2T3观察组 6.7±1.19.6±2.511.1±3.79.6±2.5对照组 6.4±1.711.3±3.614.8±4.211.0±3.3组间 F=18.698 P=0.000时点间 F=45.581 P=0.000组间·时点间F=4.436 P=0.008组别 胰岛素(mU/L)T0T1T2T3观察组 8.9±3.314.9±6.521.4±6.414.7±6.7对照组 7.8±2.920.0±7.225.7±7.918.8±4.3组间 F=17.360 P=0.000时点间 F=66.213 P=0.000组间·时点间F=3.348 P=0.028组别 ISIT0T1T2T3观察组 0.021±0.0060.006±0.0020.004±0.0020.010±0.006对照组 0.017±0.0120.004±0.0010.002±0.0010.004±0.002组间 F=28.054 P=0.000时点间 F=109.534 P=0.000组间·时点间F=2.134 P=0.139
2.3 2组心肌损伤标志物比较 2组cTnI、CK-MB浓度均呈升高趋势,观察组低于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表3。
表3 2组心肌损伤标志物比较
Table 3 Comparison of cardiac injury markers between two groups![]()
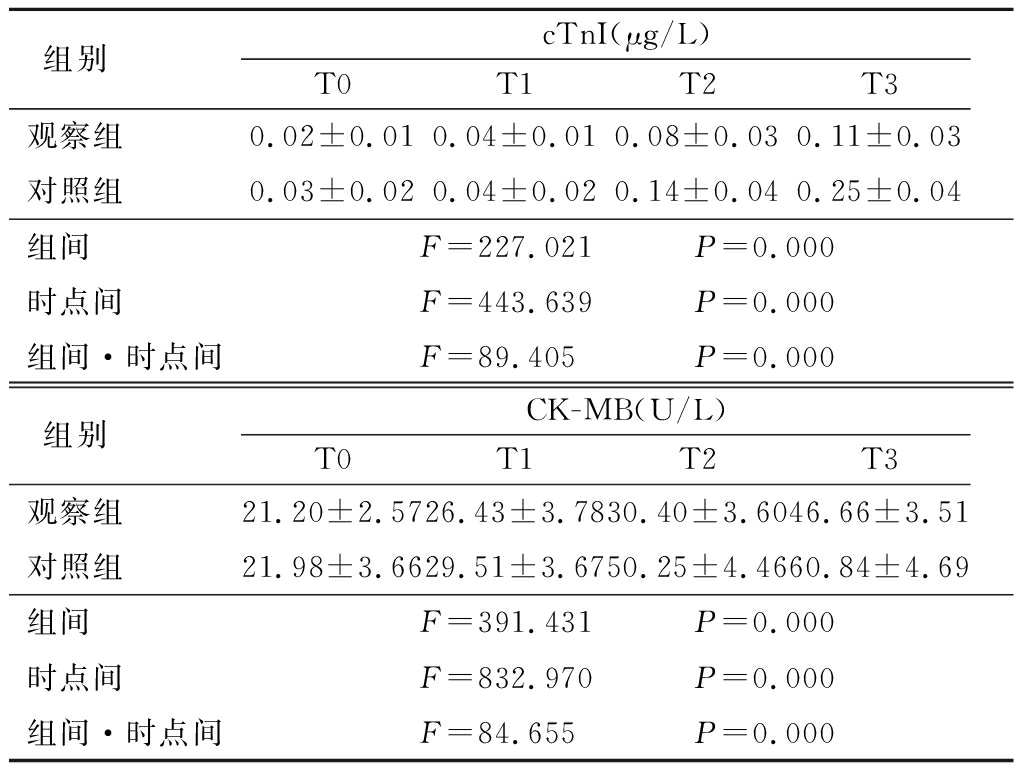
组别 cTnI(μg/L)T0T1T2T3观察组 0.02±0.010.04±0.010.08±0.030.11±0.03对照组 0.03±0.020.04±0.020.14±0.040.25±0.04组间 F=227.021 P=0.000时点间 F=443.639 P=0.000组间·时点间F=89.405 P=0.000组别 CK-MB(U/L)T0T1T2T3观察组 21.20±2.5726.43±3.7830.40±3.6046.66±3.51对照组 21.98±3.6629.51±3.6750.25±4.4660.84±4.69组间 F=391.431 P=0.000时点间 F=832.970 P=0.000组间·时点间F=84.655 P=0.000
3 讨 论
临床骨科下肢手术常需要应用止血带以达到减少术中失血和保持术野清晰的目的,然而长时间使用止血带常引起缺血再灌注损伤,不但会造成肢体原发部位的损伤,还可引起心、肺、肝、肾等继发性远隔器官的损伤,尤其是心血管系统的损伤[2-3]。
炎症反应是造成肢体缺血再灌注损伤的重要因素之一,机体发生损伤时大量炎症因子释放入血引起炎性级联反应,进而引起缺血再灌注损伤[4-5]。TNF-α是缺血再灌注损伤中最早出现最敏感的细胞因子,可引起血管内皮细胞损伤,导致血管壁通透性增加。IL-6能够刺激参与免疫反应的细胞增殖、分化并提高其功能,研究表明充血性心力衰竭患者循环及组织中IL-6升高,持续过度的IL-6产生会破坏细胞因子网络而促进心肌损伤[6-7]。这些作用均可导致机体炎症级联反应,引起缺血再灌注损伤,进而引起组织细胞和远隔脏器的损伤。研究表明炎症反应及其相关的炎症因子与胰岛素抵抗有直接关系,TNF-α可刺激心脏微血管内皮细胞的软脂酸向胞外转移,导致心肌细胞对葡萄糖摄取紊乱,促进胰岛素抵抗[8];还可介导心肌缺血再灌注损伤中蛋白磷酸酶的表达,进而抑制线粒体功能,导致心肌细胞能量代谢障碍,胰岛素抵抗心肌缺血损伤加重[9]。IL-6能诱导胰岛素受体底物的下降,导致胰岛素抵抗[10]。胰岛素抵抗是2型糖尿病的病理生理学基础。大量临床和实验研究证明,糖尿病心肌病变的直接原因是胰岛素抵抗和持续高血糖引起细胞代谢异常[11-12]。糖尿病患者胰岛素敏感性下降,葡萄糖的摄取和利用减少,机体转向不依赖胰岛素介导的脂肪供能,使机体细胞处于酮体堆积、乳酸升高、负氮平衡状态下,严重时致器官功能损害甚至衰竭。糖尿病心肌对缺血再灌注损伤耐受性降低,更容易因缺血再灌注损伤导致心肌损伤[13]。因此,如何减轻糖尿病患者术中止血带引起的缺血再灌注损伤具有重要的临床意义。近年来有研究表明,手术前给予患者药物预处理,可提前启动机体内源性保护机制,有利于减轻肢体缺血再灌注损伤,进而达到避免远隔器官损伤的目的[14]。
右美托咪定作为高选择性α2受体激动剂,可以抑制去甲肾上腺素的释放,抑制机体交感活性,减轻手术创伤引起的应激反应,作为一种新型的全身麻醉辅助药,对降低麻醉药和阿片类药的使用量,稳定血流动力学,心肌保护有一定的作用[15-16]。本研究结果显示,观察组炎症因子TNF-α、IL-6浓度均明显低于对照组,其组间、时点间、组间时点间交互作用差异均有统计学意义(P<0.05)。表明右美托咪定具有明显的抗炎作用,可抑制围术期炎性反应,明显降低血清中TNF-α和IL-6水平,其机制可能是机体发生缺血再灌注损伤时,右美托咪定可下调单核细胞Toll样受体4的表达,减少炎性介质和细胞因子的释放,从而减轻对机体的损伤[17]。而炎症因子的减少使胰岛素抵抗进一步减弱,可减轻2型糖尿病患者的胰岛素抵抗,对糖尿病患者可能更有益。本研究中使用右美托咪定后,糖尿病患者的血糖和胰岛素水平均降低,ISI升高,心肌损伤标志物cTnI、CKMB浓度明显降低。这可能与右美托咪定可明显抑制机体神经内分泌的过度兴奋,减轻手术中应激性高血糖反应有关,同时由于右美托咪定可减少炎性反应,减轻TNF-α等炎性介质相关的胰岛素抵抗[18],从而减轻糖尿病患者缺血再灌注所致的心肌损伤。
综上所述,右美托咪定可明显减轻糖尿病患者行下肢止血带手术的炎症反应,增加胰岛素敏感性,降低术中血糖,改善胰岛素抵抗,减轻缺血再灌注所致的心肌损伤。
[1] 蒋洪宇,于晋.右美托咪啶对心脏瓣膜置换术患者应激反应和胰岛素抵抗的影响[J].实用医学杂志,2016,32(20):3461.
[2] Lukiswanto BS,Yuniarti WM,Motulo YY. Effects of hyperbaric therapy on liver morphofunctional of rabbits (Oryctolagus cuniculus) after hind limb ischemia-reperfusion injury[J]. Vet World,2017,10(11):1337-1342.
[3] 阮孝国,刘贺,孟凡民,等.右美托咪定对骨科下肢手术患者止血带诱发肢体缺血-再灌注损伤的影响[J].临床麻醉学杂志,2015,31(7):668-670.
[4] Mo Y,Chen S,Yang L,et al. The effect of transcutaneous electrical acupoint stimulation on inflammatory response in patients undergoing limb ischemia-reperfusion [J]. Mediators Inflamm,2017,2017:8369737.
[5] 姚达,钱有辉,万延辉,等.联合应用右美托咪定与远隔缺血预处理对胸腔镜肺部手术的肺保护作用及机制研究[J].河北医科大学学报,2017,38(8):897-900,917.
[6] Shi Z,Fu F,Yu L,et al. Vasonatrin peptide attenuates attenuates myocardial ischemia-reperfusion injury in diabetic rats and underlying mechanisms[J]. Am J Physiol Heart Circ Physiol,2015,308(4):H281-290.
[7] Dong Z,Gong K,Huang D,et al. Myocardial infarction accelerates glomerular injury and microalbuminuria in diabetic rats via local hemo-dynamics and immunity[J]. Int J Cardiol,2015,179:397-408.
[8] Li W,Yang X,Zheng T,et al. TNF-α stimulates endothelial palmitic acid transcytosis and promotes insulin resistanc[J]. Sci Rep,2017,7:44659.
[9] 邢媛.心肌缺血/再灌注损伤中蛋白磷酸酶PHLPP1的表达调控及作用机制研究[D].西安:第四军医大学,2016.
[10] Kuznetsova A,Yu Y,Hollister-Lock J,et al. Trimeprazine increases IRS2 in human islets and promotes pancreatic β cell growth and function in mice [J]. JCI Insight,2016,1(3):e80749.
[11] Jia G,DeMarco VG,Sowers JR. Insulin resistance and hyperinsulinaemia in diabetic cardiomyopathy[J]. Nat Rev Endocrinol,2016,12(3):144-153.
[12] Jia G,Whaley-Connell A,Sowers JR. Diabetic cardiomyopathy:a hyperglycaemia-and insulin-resistance-induced heart disease [J]. Diabetologia,2018,61(1):21-28.
[13] 周娇洁,唐霓,魏继承.糖尿病心肌对缺血/再灌注损伤敏感化及其线粒体机制的研究进展[J].医学综述,2016,22(22):4460-4463.
[14] Gogus N,Akan B,Bayrakci S,et al. The effects of a small-dose ketamine-propofol combinationon tourniquet-induced ischemia-reperfusion injury during arthroscopic knee surgery[J]. J Clin Anesth,2014,26(1):46-51.
[15] 吴玉旺,立王永,喻文立.右美托咪定在心脏手术麻醉中的应用现状及进展[J].麻醉安全与质控,2017,1(5):266-268.
[16] Riquelme JA,Westermeier F,Hall AR,et al. Dexmedetomidine protects the heart against ischemia-reperfusion injury by an endothelial eNOS/NO dependent mechanism [J]. Pharmacol Res,2016,103:318-327.
[17] 韩彬,赵俊莺,何爱萍,等.右美托咪啶对脂多糖致伤大鼠肾小管上皮细胞Toll样受体4表达的影响[J].河北医科大学学报,2015,36(1):42-44.
[18] 蒋洪宇,于晋,张玲.右美托咪定对心内直视手术患者炎性反应和胰岛素抵抗的影响[J].临床麻醉学杂志,2016,33(7):642-644.