有研究显示术后谵妄发生率为11%~51%,老年患者的发病率更高。术后谵妄与患者的致病率和病死率相关,延长患者的住院时间,不利于功能恢复,并且导致患者认知功能的远期损害[1-2]。术后谵妄的发病机制不明确,目前有很多针对病因和治疗而开展的基础和临床的研究[3-6]。右美托咪定为高选择性α2肾上腺素能受体激动剂,抑制交感神经的兴奋性。Su等[5]研究证实ICU内持续静脉输注低剂量右美托咪定可以显著降低老年非心脏手术术后谵妄的发生率。磷酸肌酸是参与细胞能量代谢的重要物质之一,具有脏器保护作用,与右美托咪定合用是否能更有效减轻术后谵妄的发生率尚无定论。因此,本研究旨在探讨预输注右美托咪定和磷酸肌酸钠对老年食管癌根治术患者术后谵妄的影响。
1 资料与方法
1.1 一般资料 选择2017年12月—2018年5月择期行食管癌根治术患者80例,年龄>65岁,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ或Ⅱ级,无精神系统疾病,未服用相应药物,无严重听力及视力障碍,可配合完成认知功能测试,无严重肝肾功能障碍,无高血压及神经系统病变。采用随机数字表法将患者分为对照组(C组)、右美托咪定组(D组)、磷酸肌酸钠组(P组)和右美托咪定复合磷酸肌酸钠组(DP组),每组20例。DP组有1例患者因术后出血行二次手术而退出试验。4组一般情况比较差异无统计学意义(P>0.05),具有可比性,见表1。
本研究经河北医科大学第四医院伦理委员会批准通过;所有患者知情同意并签署知情同意书。
1.2 方法 术前1 d由具有心理专业知识的人员到病房对患者进行简易精神状态量表(Mini-Mental State Examination,MMSE)评估。所有患者均不使用药物,入手术室后建立外周静脉通路,常规监测心率(heart rate,HR)、脉搏氧饱和度、心电图和脑电双频指数(bispectral index,BIS),局部麻醉下行桡动脉穿刺和右颈内静脉穿刺置管术,监测患者的有创动脉收缩压(systolic blood pressure,SBP)和中心静脉压,并抽取颈内静脉血4mL测定血清S-100β蛋白浓度。待所有的操作完成10 min后,按照试验方案进行给药:C组静脉输注生理盐水20 mL;D组将0.4 μg/kg右美托咪定用生理盐水稀释至20 mL;P组将4.0 g磷酸肌酸钠用生理盐水稀释至20 mL;DP组将0.4 μg/kg右美托咪定和4.0 g磷酸肌酸钠分别用生理盐水稀释至20 mL。各组输注时间均为10 min。记录输注前后患者的HR、SBP。常规麻醉诱导:静脉注射依托咪酯0.3 mg/kg,舒芬太尼0.4 μg/kg,顺阿曲库铵0.2 mg/kg,经口明视下经单腔气管导管置入9 Fr支气管封堵器,经纤维支气管镜定位后行机械通气。麻醉维持:持续吸入2%~3%七氟醚,静脉输注瑞芬太尼0.1~0.2 μg ·kg-1·min-1,间断静脉注射顺阿曲库铵,维持BIS值40~60。术中心率波动范围超过基础值±20%者,静脉注射艾司洛尔降低或阿托品升高心率;术中血压波动范围超过基础值±20%者,静脉注射乌拉地尔降低或麻黄碱升高血压。术毕4组使用同一配方:芬太尼4 μg/kg、地佐辛0.4 mg/kg用生理盐水稀释至100mL进行术后静脉自控镇痛,用视觉模拟评分法(Visual Analogue Scale,VAS)评估患者术后24,48 h疼痛情况。术后24 h,再次抽取颈内静脉血样4mL,离心后采用酶联免疫吸附测定法测定血清S-100β蛋白浓度。
表1 4组一般情况比较
Table 1 Comparison of general conditions in different groups![]()
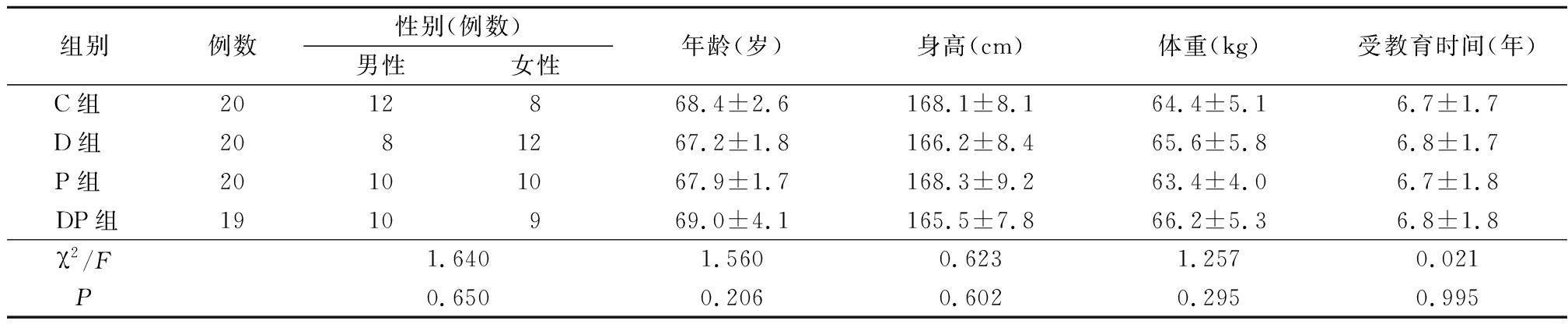
组别例数性别(例数)男性女性年龄(岁)身高(cm)体重(kg)受教育时间(年)C组 2012868.4±2.6168.1±8.164.4±5.16.7±1.7D组 2081267.2±1.8166.2±8.465.6±5.86.8±1.7P组 20101067.9±1.7168.3±9.263.4±4.06.7±1.8DP组1910969.0±4.1165.5±7.866.2±5.36.8±1.8χ2/F1.6401.5600.6231.2570.021P0.6500.2060.6020.2950.995
1.3 观察指标 记录患者术前1 d(T0)、术后24 h(T3)MMSE评分;测定T0、T3时间点血清S-100β蛋白浓度;记录输注试验药物前(T1)、输注试验药物后(T2)的HR、SBP;计算患者术后24 h(T3)、48 h(T4)的VAS评分。
1.4 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较分别采用配对t检验、F检验和SNK-q检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 4组静脉输注试验药物前后HR、SBP比较 T1时点,4组HR、SBP差异均无统计学意义(P>0.05)。T2时点,D组HR、SBP均低于T1时点(P<0.05),C组、P组、DP组2个时点间HR、SBP差异均无统计学意义(P>0.05);T2时点,D组HR、SBP均低于C组、P组、DP组(P<0.05),余组间差异无统计学意义(P>0.05)。见表2。
2.2 4组MMSE评分比较 T0时点,4组MMSE评分差异无统计学意义。T3时点,C组、D组和DP组MMSE评分低于T0时点(P<0.05),DP组2个时点间MMSE评分差异无统计学意义(P>0.05);T3时点,D组、P组和DP组MMSE评分均高于C组,DP组MMSE评分高于P组(P<0.05),余组间MMSE评分差异无统计学意义(P>0.05)。见表3。
表2 4组静脉输注试验药物前后HR、SBP比较
Table 2 Comparison of HR and SBP before and after infusion of drugs in 4 groups![]()
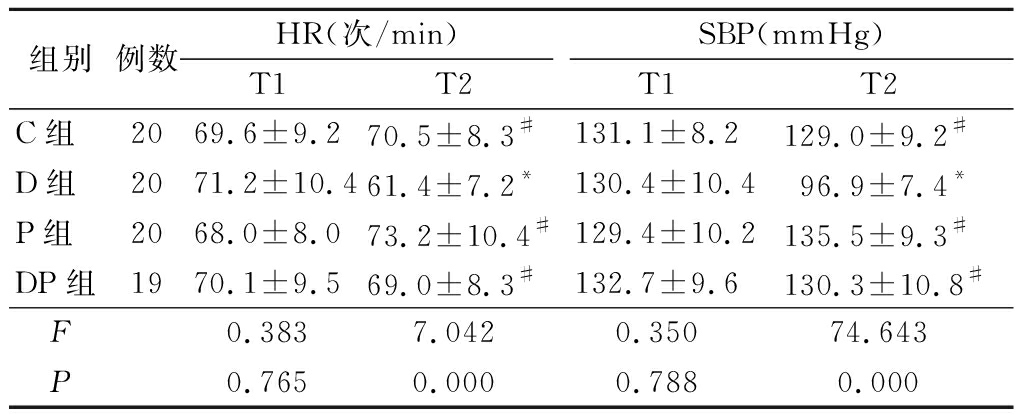
组别例数HR(次/min)T1T2SBP(mmHg)T1T2C组2069.6±9.270.5±8.3#131.1±8.2129.0±9.2#D组2071.2±10.461.4±7.2*130.4±10.496.9±7.4*P组2068.0±8.073.2±10.4#129.4±10.2135.5±9.3#DP组1970.1±9.569.0±8.3#132.7±9.6130.3±10.8#F0.3837.0420.35074.643P0.7650.0000.7880.000
*P<0.05与T1比较(配对t检验) #P<0.05与D组比较(SNK-q检验)
表3 4组MMSE评分比较
Table 3 Comparison of MMSE scores in 4 groups ![]() 分)
分)
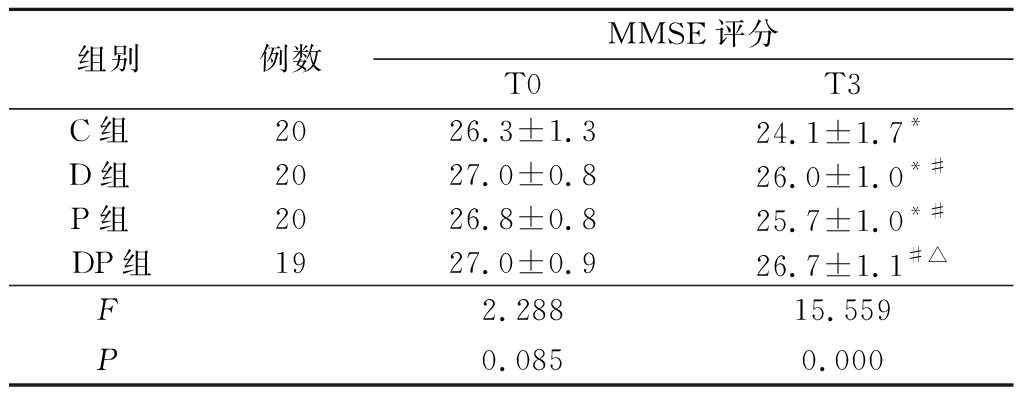
组别例数MMSE评分T0T3C组 2026.3±1.324.1±1.7*D组 2027.0±0.8 26.0±1.0*#P组 2026.8±0.825.7±1.0*#DP组1927.0±0.926.7±1.1#△F2.28815.559P0.0850.000
*P<0.05与T1比较(配对t检验) #P<0.05与C组比较 △P<0.05与P组比较(SNK-q检验)
2.3 4组血清S-100β蛋白表达水平比较 T0时点,4组血清S-100β蛋白浓度差异无统计学意义(P>0.05)。T3时点,4组血清S-100β蛋白浓度均高于T0时点,D组、P组和DP组血清S-100β蛋白水平均低于C组,DP组血清S-100β蛋白水平低于D组和P组,差异有统计学意义(P<0.05)。见表4。
表4 4组血清S-100β蛋白表达水平比较
Table 4 Comparison of S-100β protein expression levels in 4 groups![]()
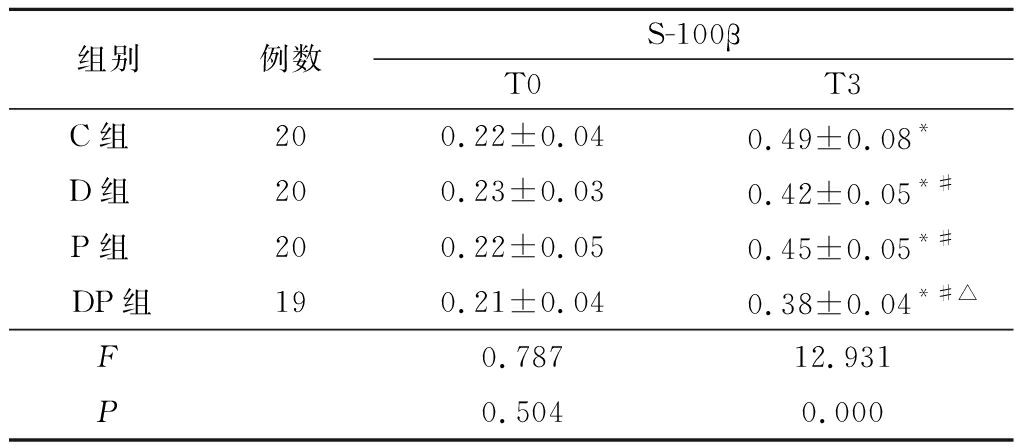
组别例数S-100βT0T3C组 200.22±0.040.49±0.08*D组 200.23±0.030.42±0.05*#P组 200.22±0.050.45±0.05*#DP组190.21±0.040.38±0.04*#△F0.78712.931P0.5040.000
*P<0.05与T1比较(配对t检验) #P<0.05与C组比较 △P<0.05与D组和P组比较(SNK-q检验)
2.4 4组VAS评分比较 2个时点间4组VAS评分差异无统计学意义(P>0.05)。T3、T4时点,D组、DP组VAS评分低于C组(P<0.05),余组间差异无统计学意义(P>0.05)。见表5。
表5 4组VAS评分比较
Table 5 Comparison of VAS scores in 4 groups ![]() 分)
分)
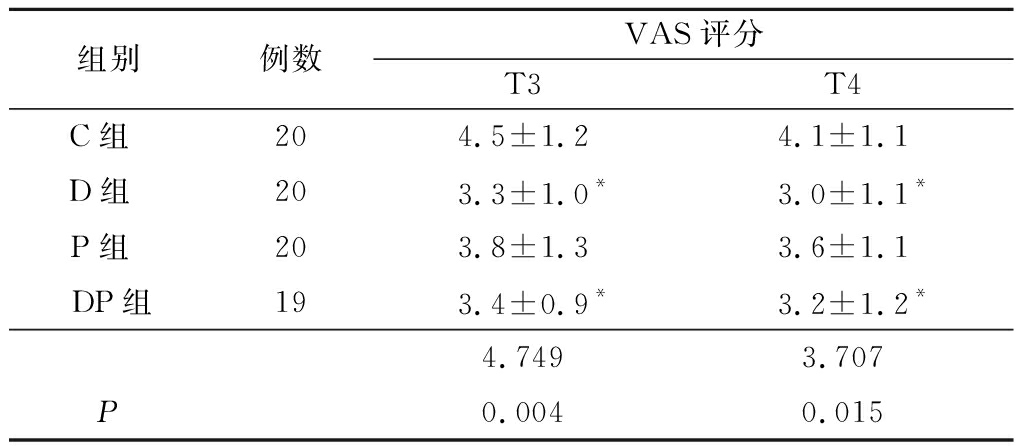
组别例数VAS评分T3T4C组 204.5±1.24.1±1.1D组 203.3±1.0* 3.0±1.1*P组 203.8±1.3 3.6±1.1DP组193.4±0.9* 3.2±1.2*4.7493.707P0.0040.015
*P<0.05与C组比较(SNK-q检验)
3 讨 论
目前术后谵妄的发病机制仍不清楚,老龄是确定的独立危险因素。本研究选取年龄>65岁的患者,以便更好地评价右美托咪定和磷酸肌酸钠是否能够有助于减轻术后认知功能的改变。研究表明,血清中S-100β蛋白表达水平与中枢神经系统损伤程度及预后密切相关[7-8]。此外,S-100β蛋白不但特异性高,同时具有耐热性,检测结果不受药物酚和溶血等其他因素的影响。MMSE是目前最具影响的认知缺损筛选工具之一,这种方法侧重于大脑功能认知方面,可以排除情绪及神智异常等因素的干扰,具有较高的有效性和可信性[9]。因此,本研究采用S-100β和MMSE作为观察指标,以评定认知功能情况。
右美托咪定静脉输注后,与血清蛋白结合率平均约为94%,不影响血清促肾上腺皮质激素和皮质醇水平。基础研究表明,右美托咪定能减轻脑缺血损伤[10-12]。最新研究显示右美托咪定可减轻扁桃体切除术儿童苏醒期谵妄的发生,可能与右美托咪定高选择性激动α2肾上腺素受体,减少术中全身麻醉药用量,发挥潜在的脑保护作用有关[13]。本研究结果显示,T3时点,D组、P组和DP组MMSE评分均高于C组,血清S-100β蛋白水平均低于C组。说明右美托咪定可减轻老年患者术后脑功能障碍。
脑组织供能方式单一,故是人体中对缺血缺氧最敏感的部分,脑细胞的三磷酸腺苷贮存量少,若发生缺血缺氧,三磷酸腺苷合成量不足,脑细胞能量代谢障碍,更容易发生术后认知障碍[14]。能量缺乏是老年人认知功能障碍的发病因素,外源性磷酸肌酸是参与细胞能量代谢的重要来源之一,预先输注磷酸肌酸可一定程度上补偿脑部缺氧或葡萄糖减少所致的ATP缺乏,提高组织对缺氧、缺血损伤的抵抗力[15],改善非体外循环心脏跳动下的冠状动脉搭桥术患者术后认知功能。本研究结果显示,术前预先输注磷酸肌酸钠可使食管癌患者术后血清S-100β蛋白水平下调,术后MMSE评分升高。说明磷酸肌酸钠同样可减轻老年患者术后认知损害。
右美托咪定与阿片类药物有协同作用,增加剂量可能增加围麻醉期,尤其是麻醉诱导期的不良反应,如血压降低、心率减慢等[16]。关注术后患者的转归是目前临床麻醉到围术期医学改变的重点,围麻醉期复合用药可以增强脏器保护的作用。本研究结果表明,与单纯应用右美托咪定或者磷酸肌酸钠比较,术前预输注右美托咪定复合磷酸肌酸钠对减轻老年食管癌患者术后谵妄的效果更加显著。推断围麻醉期复合用药的理念可能更加有利于脑保护。
综上所述,术前单独预输注右美托咪定、磷酸肌酸钠可减轻老年食管癌患者术后脑障碍的程度,两种药复合应用效果更加显著,推断围麻醉期复合用药的理念可能更加有利于脑保护。
[1] Magny E,Le Petitcorps H,Pociumban M,et al. Predisposing and precipitating factors for delirium in community-dwelling older adults admitted to hospital with this condition:a prospective case series[J]. PLoS One,2018,13(2):e0193034.
[2] Abelha FJ,Luis C,Veiga D,et al. Outcome and quality of life in patients with postoperative delirium during an ICU stay following major surgery[J]. Crit Care,2013,17(5):R257.
[3] 郑军,韩文.不同麻醉方式对老年胃癌患者术后褪黑素浓度的影响及其与苏醒期谵妄的关系研究[J].河北医科大学学报,2017,38(3):321-325.
[4] 刘华琴,周超,宋子贤,等.人格因素对老年患者胃肠外科术后认知功能障碍发生的影响[J].中华麻醉学杂志,2016,36(3):281-284.
[5] Su X,Meng ZT,Wu XH,et al. Dexmedetomidine for prevention of delirium in elderly patients after non-cardiac surgery:a randomised,double-blind,placebo-controlled trial[J]. Lancet,2016,388(10054):1893-1902.
[6] Barr J,Fraser GL,Puntillo K,et al. Clinical practice guidelines for the management of pain,agitation,and delirium in adult patients in the intensive care unit[J]. Crit Care Med,2013,41(1):263-306.
[7] Peltz CB,Gardner RC,Kenney K,et al. Neurobehavioral characteristics of older veterans with remote traumatic brain injury[J]. J Head Trauma Rehabil,2017,32(1):E8-15.
[8] Mercier E,Boutin A,Lauzier F,et al. Predictive value of S-100β protein for prognosis in patients with moderate and severe traumatic brain injury:systematic review and meta-analysis[J]. BMJ,2013,346:f1757.
[9] Aldecoa C,Bettelli G,Bilotta F,et al. European society of anaesthesiology evidence-based and consensus-based guidelines on postoperative delirium[J]. Eur J Anaesthesiol,2017,34(4):192-214.
[10] Perez-Zoghbi JF,Zhu W,Grafe MR,et al. Dexmedetomidine-mediated neuroprotection against sevoflurane-induced neurotoxicity extends to several brain regions in neonatal rats[J]. Br J Anaesth,2017,119(3):506-516.
[11] Sun Z,Zhao T,Lv S,et al. Dexmedetomidine attenuates spinal cord ischemia-reperfusion injury through both anti-inflammation and anti-apopotis mechanisms in rabbits[J]. J Transl med,2018,16(1):209.
[12] Kucuk A,Yaylak F,Cavunt-Bayraktar A,et al. The protective effects of dexmedetomidine on hepatic ischemia reperfusion injury[J]. Bratisl Lek Listy,2014,115(11):680-684.
[13] Tsiotou AG,Malisiova A,Kouptsova E,et al. Dexmedetomidine for the reduction of emergence delirium in children undergoing tonsillectomy with propofol anesthesia:a double-blind,randomized study[J]. Paediatr Anaesth,2018,28(7):632-638.
[14] Adriano E,Garbati P,Salis A,et al. Creatine salts provide neuroprotection even after partial impairment of the creatine transporter[J]. Neuroscience,2017,340:299-307.
[15] 张玲,江涛,程高,等.磷酸肌酸钠对非体外循环冠状动脉旁路移植术患者术后认知功能的影响[J].中华麻醉学杂志,2016,36(10):1175-1178.
[16] 王桂平.盐酸右美托咪定在日间手术的应用现状及研究进展[J].河北医科大学学报, 2016,37(2):246-248.