术后认知功能障碍(postoperative cognitive dysfunction,POCD)是老年髋部骨折患者术后较为常见的一种神经系统并发症,其病因和发病机制尚不明确,除了高龄是目前唯一确定的危险因素外[1],术后疼痛也被认为是导致老年患者POCD的高危因素[2],而中枢炎性反应机制在POCD的发生和发展中起着重要作用[3]。髋部骨折所带来的疼痛始终伴随于包括术前及术后的整个病程,本研究对老年髋部骨折患者在入院早期进行超声引导下髂筋膜间隙阻滞持续镇痛,并与常规静脉注射药物镇痛相比较,观察其对机体炎性反应和术后早期认知功能的影响,报告如下。
1 资料与方法
1.1 一般资料 选择2016年3月—2017年3月在我院择期行单侧髋部骨折手术的患者80例,按随机数字表法分为A组(常规处理组)和B组(髂筋膜间隙阻滞组)各40例。2组性别、年龄、受教育程度、体重指数(body mass index,BMI)、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级和术前住院时间差异均无统计学意义(P>0.05),具有可比性,见表1。
本研究经医院伦理委员会批准通过;患者均签署知情同意书。
表1 2 组一般资料比较![]()
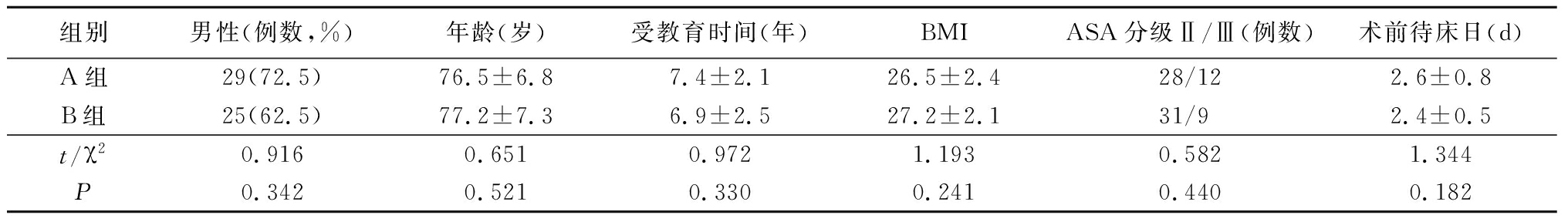
组别男性(例数,%)年龄(岁)受教育时间(年)BMIASA分级Ⅱ/Ⅲ(例数)术前待床日(d)A组29(72.5)76.5±6.87.4±2.126.5±2.428/122.6±0.8B组25(62.5)77.2±7.36.9±2.527.2±2.131/9 2.4±0.5t/χ20.9160.6510.9721.1930.5821.344P0.3420.5210.3300.2410.4400.182
1.2 纳入标准和排除标准 纳入标准:①诊断为单侧股骨颈骨折或股骨粗隆骨折且符合手术治疗指征;②ASA 分级Ⅰ~Ⅲ级;③年龄≥65岁,体重45~100 kg,男女不限;④视觉模拟评分法(Visual Analogue Scale,VAS)评分≥5分。排除标准: ①有神经系统或精神系统疾病史;②有慢性疼痛史;③有酗酒史或长期服用精神类药物者;④严重的视觉或听力疾病;⑤有严重心、肝、肾等功能障碍;⑥简易精神状态评价量表(Mini-Mental State Examination,MMSE)评分<17分;⑦不能配合完成认知功能测试者;⑧治疗方案变更为保守治疗者;⑨不能在72 h内进行手术治疗者。
1.3 研究方法 ①急诊室处理:B组入院后立即在超声引导下行髂筋膜间隙阻滞并置入导管。②髂筋膜间隙阻滞:患者处于合适的体位,皮肤消毒,将高频探头(6~14 Hz)垂直放置于腹股沟韧带中外1/3处,靠近髂前上棘,矢状位下操作;穿刺针平行于探头,从腹股沟韧带下方2~4 cm处进针,在超声引导下穿破腹股沟韧带下方的髂筋膜,可能会有突破感,此时超声下可能看见筋膜折断;回抽无血后,注射0.25%盐酸罗哌卡因注射液1~2 mL,如果位置正确,可以看见一个光束位于髂筋膜下,随后针头进入光束,注入0.25%盐酸罗哌卡因注射液30 mL,一般会观察到局部麻药醉从注射点处由内向外将髂筋膜推开;如果局部麻醉药在髂筋膜上方或髂腰肌内扩散,则需重新调整针的位置,注药后患者主诉疼痛明显缓解即视为阻滞有效;阻滞完成后,经穿刺针置入导管并连接电子镇痛泵持续给药,背景剂量7 mL/h(药物:0.125%盐酸罗哌卡因注射液),患者自控镇痛5 mL,锁定时间15 min;操作均由1名经验丰富的麻醉医生完成,阻滞完成观察30 min后送至病房。③病房镇痛处理:A组住院后,VAS≥5分的患者予地佐辛5 mg肌内注射,6 h后可重复使用。④麻醉过程:2组手术均在静脉吸入复合全身麻醉下完成;患者入室后开放静脉通路,常规监测心电图、心率、血压、血氧饱和度,并持续监测有创血压;麻醉诱导使用丙泊酚注射液1.5~2 mg/kg,顺苯磺酸阿曲库铵0.2 mg/kg,枸橼酸芬太尼注射液5 μg/kg,诱导后置入喉罩通气;手术开始前予芬太尼0.1 mg静脉注射,七氟醚吸入维持麻醉,并根据麻醉深度调整七氟醚吸入浓度以及分次追加芬太尼0.1 mg/次,芬太尼总量不超过0.01 mg/kg;术中维持心率和血压波动幅度不超过基础值的20%,必要时可使用血管活性药物。⑤术后镇痛:2组术后均使用髂筋膜间隙阻滞持续镇痛至术后48 h。
1.4 观察指标 以入院后即刻、术前12 h、术后24 h、术后72 h为监测观察时间点,分别记为T0,T1,T2,T3,并观察以下指标。①VAS评分:随访并记录患者各时间点VAS评分(0分为无痛,10分为剧痛)。②睡眠质量评估:在T1使用匹茨堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评估患者术前的整体睡眠质量;PSQI由19个自评和5个他评条目构成,其中第19个自评条目和5个他评条目不参与计分,参与计分的18个自评条目组成7个成分,每个成分按0~3等级计分,累积各成分得分为PSQI总分,总分范围为0~21,得分越高,表示睡眠质量越差。③术中情况:观察手术时间、术中出血量、输液量、尿量、术中和麻醉恢复室中低血压及低氧血症发生率、术中芬太尼的使用量、术前待床日及总住院时间。④POCD的评定:分别在各时间点对患者进行MMSE测试并记录分值,计算所有患者术前MMSE评分的标准差,以术前测试值为对照,术后测试值与术前值比较等于或超过1个标准差判断该患者出现POCD。⑤血清学指标测定:分别在各时间点取患者右侧颈内静脉血2 mL(征求患者同意后),采用酶联免疫吸附测定法检测并记录血浆白细胞介素6(interleukin-6,IL-6)、中枢神经特异蛋白(S-100β)的浓度。考虑到术中出血和输血输液的影响,术后结果记录使用矫正值,矫正值=实测值×麻醉前Hct/实际Hct。
1.5 统计学方法 应用SPSS 15.0统计软件处理数据。计数资料比较采用χ2检验;计量资料比较分别采用两独立样本的t检验及重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组术中情况比较 2组手术时间、术中出血量、输液量、尿量差异均无统计学意义(P>0.05),B组术中芬太尼用量较A组低(P<0.05),见表2。
表2 2组术中情况比较![]()
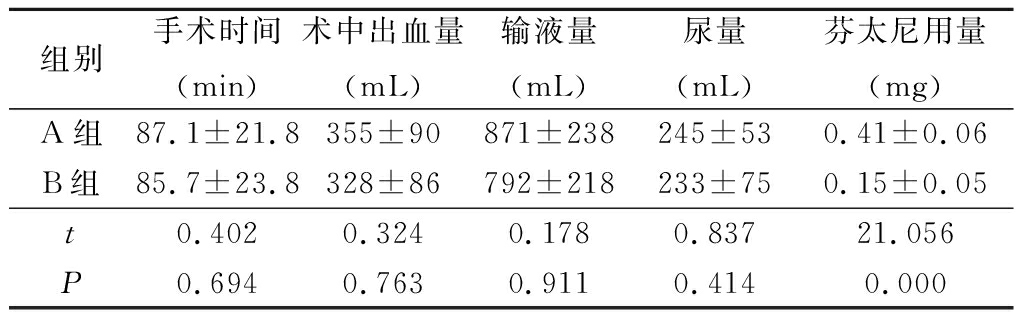
组别手术时间(min)术中出血量(mL)输液量(mL)尿量(mL)芬太尼用量(mg)A组87.1±21.8355±90871±238245±530.41±0.06B组85.7±23.8328±86792±218233±750.15±0.05t0.4020.3240.1780.83721.056P0.6940.7630.9110.4140.000
2.2 2组PSQI评分、POCD发生率和住院时间比较 B组术前PSQI评分少于 A组,POCD发生率低于A组,住院时间少于 A组,差异均有统计学意义(P<0.05),见表3。
表3 2组术前睡眠质量、住院时间和POCD发生率比较![]()
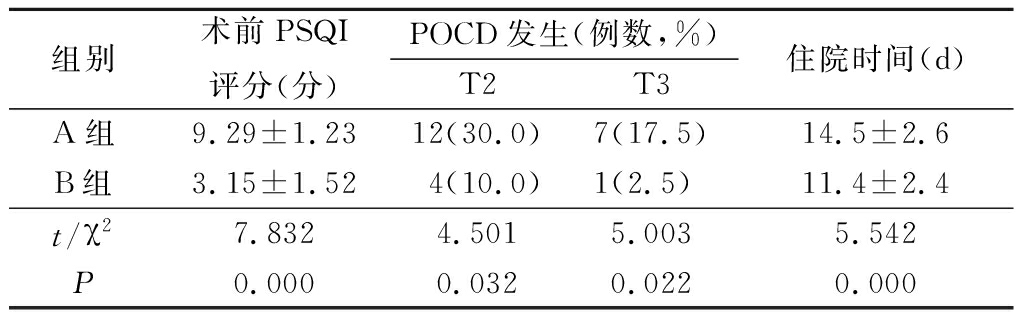
组别术前PSQI评分(分)POCD发生(例数,%)T2T3住院时间(d)A组9.29±1.2312(30.0)7(17.5)14.5±2.6B组3.15±1.524(10.0)1(2.5) 11.4±2.4t/χ27.8324.5015.0035.542P0.0000.0320.0220.000
2.3 2组VAS评分、MMSE评分、IL-6浓度和血清S-100β蛋白浓度比较 2组VAS呈逐渐降低趋势,2组MMSE评分先降低后回升,但B组回升的多, 2组IL-6和S-100β浓度呈先升高(T1、T2)后降低(T3)趋势,B组VAS、IL-6和S-100β浓度降低幅度较A组更多,而MMSE评分较A组更高,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表4。
表4 2组VAS评分、MMSE评分、IL-6浓度和血清S-100β蛋白浓度比较![]()
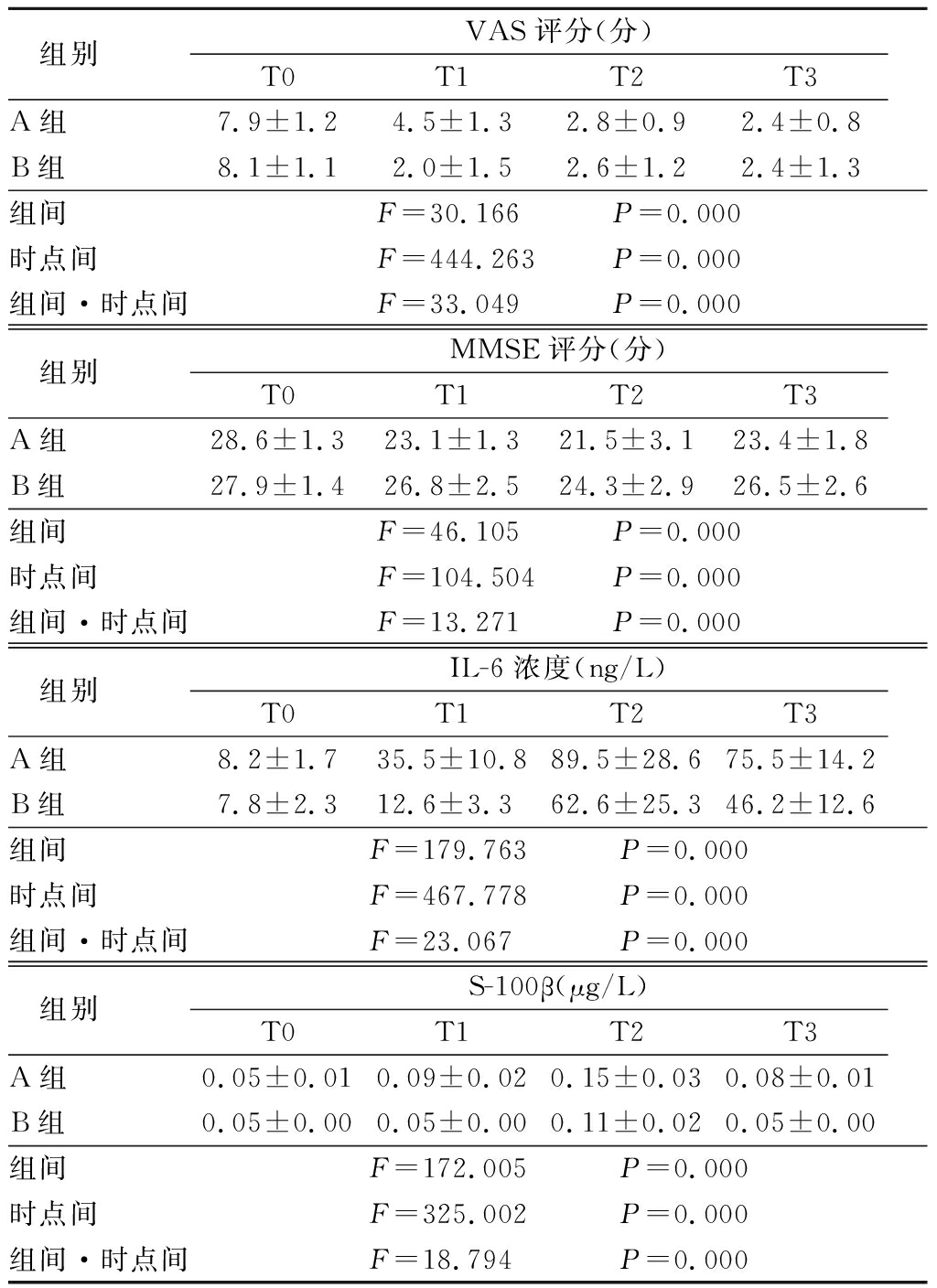
组别 VAS评分(分)T0T1T2T3A组 7.9±1.24.5±1.32.8±0.92.4±0.8B组 8.1±1.12.0±1.52.6±1.22.4±1.3组间 F=30.166 P=0.000时点间 F=444.263 P=0.000组间·时点间F=33.049 P=0.000组别 MMSE评分(分)T0T1T2T3A组 28.6±1.323.1±1.321.5±3.123.4±1.8B组 27.9±1.426.8±2.524.3±2.926.5±2.6组间 F=46.105 P=0.000时点间 F=104.504 P=0.000组间·时点间F=13.271 P=0.000组别 IL-6浓度(ng/L)T0T1T2T3A组 8.2±1.735.5±10.889.5±28.675.5±14.2B组 7.8±2.312.6±3.362.6±25.346.2±12.6组间 F=179.763 P=0.000时点间 F=467.778 P=0.000组间·时点间F=23.067 P=0.000组别 S-100β(μg/L)T0T1T2T3A组 0.05±0.010.09±0.020.15±0.030.08±0.01B组 0.05±0.000.05±0.000.11±0.020.05±0.00组间 F=172.005 P=0.000时点间 F=325.002 P=0.000组间·时点间F=18.794 P=0.000
3 讨 论
髋部骨折包括股骨颈和股骨粗隆间骨折,是由骨质疏松引起的老年最常见的骨折之一。髋部骨折主要的治疗方法是早期外科手术治疗,一般建议在48 h内实施手术[4]。但由于老年患者多伴有并存疾病或新发内科疾病,既增加了手术和麻醉的风险,也使得术后并发症的发生率明显提高,严重影响患者的预后,甚至会导致死亡。
认知功能损害是老年髋部骨折患者术后最常见的中枢神经系统并发症,发生率接近30%,其中15%会发展为POCD[5]。以往的研究认为,手术后的疼痛和镇痛效果不佳是老年髋部骨折患者术后认知功能损伤和谵妄重要的风险因素[6]。但是,关于术前骨折诱发的疼痛却往往容易被临床医生所忽视。
髋部骨折大多为不稳定性骨折,稍有活动就会产生剧烈的疼痛,而且术前持续牵引也不能明显缓解牵引处的疼痛[7]。因此,《2014年AAOS老年髋部骨折循证临床实践指南》[8]和《2017年中国老年髋部骨折患者麻醉及围术期管理指导意见》[9]均强烈推荐,髋部骨折患者入院后,在急诊室就应该接受疼痛评估,尽早开始镇痛治疗。由于老年患者的特殊性,考虑到非甾体抗炎药的肾毒性和胃肠道反应以及阿片类药物对呼吸和意识的影响,应首选区域阻滞控制患者早期疼痛[10]。在各种区域阻滞技术中,髂筋膜间隙阻滞是一项操作简单、容易掌握的技术,其机制是将局麻药注入髂筋膜和髂肌之间的间隙中,阻滞位于其间的股神经和股外侧皮神经,辅以超声引导下操作,用于治疗髋部骨折患者的疼痛,起效迅速,效果确切。本研究结果也显示,与常规术前静脉注射药物镇痛相比,髂筋膜间隙阻滞持续镇痛能够达到更好的围术期镇痛效果。
本研究表明入院早期行髂筋膜间隙阻滞持续镇痛除了提供良好的镇痛效果外,还能够改善患者术前睡眠质量以及减少术中芬太尼用量。以往的动物实验已经证实,术前睡眠剥夺越长,术后大鼠海马胆碱乙酰化转移酶的表达越低,而胆碱乙酰化转移酶的表达量与机体内乙酰胆碱的水平呈正相关[11]。乙酰胆碱是一种与学习和记忆功能密切相关的神经递质,其水平降低与认知功能损害密切相关[12],术中阿片类药物的使用也会干扰睡眠节律,减少体内乙酰胆碱的释放,老年人尤为明显[13],这可能是本研究中B组患者早期POCD发生率降低的原因之一。
疼痛与术后认知功能关系密切,因为痛感处理的关键区域前扣带回皮层也被认为是认知能力和运动过程的执行控制基础[14]。此外,疼痛伤害性刺激会激活机体固有的免疫系统,产生外周炎性反应,外周炎性反应可以直接或间接激活中枢神经胶质细胞产生炎性细胞因子,引起中枢神经系统炎性反应,并造成海马区等大脑结构器质性损害,产生认知功能改变[15]。本研究选择IL-6和S-100β蛋白作为血清学检测指标,促炎细胞因子IL-6会导致海马神经元凋亡[16],而S-100β蛋白则是一种急性脑损伤的生物标志物[17]。本研究中,B组T1、T2、T3的IL-6和S-100β蛋白浓度明显低于A组(P<0.05),说明入院早期行髂筋膜间隙阻滞持续镇痛可以减轻应激,抑制免疫炎性反应,最终降低POCD的发生。本研究中,与A组相比,B组总住院时间明显缩短(P<0.05),说明术后认知功能的改善有利于老年患者的术后康复,节约医疗费用。既往的研究已经证实,急性贫血[18]和术中低血压[19]也是POCD发生的重要危险因素。本研究2组手术时间、术中出血量、输液量、尿量差异无统计学意义,术中及麻醉恢复室中均未有低血压及低氧血症的发生。
本研究的局限是:①目前国内尚缺乏专用于围术期疼痛患者使用的睡眠评估方法,本研究中使用的PSQI是一种主观睡眠评估方法,一般多用于评定被试者一个月的睡眠质量,此次评估时限较短,可能会影响到结果的信度和效度;②患者在短时间内接受多次MMSE评估,个人会逐渐熟悉并记住测试内容,从而造成测试的“学习效应”。但是,在POCD相关的研究中,这种“学习效应”是很难避免的。
总之,本研究显示术前髂筋膜间隙阻滞持续镇痛可以提供完善的围术期镇痛效果,改善睡眠质量,减少术中阿片类药物的用量,减轻机体免疫炎性反应,从而降低患者早期POCD的发生。
[1] Fidalgo AR. Experimental insights into age-exacerbated cognitive dysfunction after peripheral surgery[J]. Aging Cell,2013,12(3):523-524.
[2] Odor PM,Chis Ster I,Wilkinson I,et al. Effect of admission fascia iliaca compartment blocks on post-operative abbreviated mental test scores in elderly fractured neck of femur patients: a retrospective cohort study[J]. BMC Anesthesiol,2017,17(1):2.
[3] Riedel B,Browne K,Silbert B. Cerebral protection:inflammation,endothelial dysfunction,and postoperative cognitive dysfunction[J]. Curr Opin Anaesthesiol,2014,27(1):89-97.
[4] Roberts KC,Brox WT. From evidence to application: aaos clinical practice guideline on management of hip fractures in the elderly[J]. J Orthop Trauma,2015,29(3):119-120.
[5] 郄晓娟,郑文婧.吸入麻醉药与术后认知功能障碍[J].河北医科大学学报,2016,37(8):989-992.
[6] 马辉,徐伟乐,王英.硬膜外麻醉联合静脉全身麻醉对老年开胸手术患者术后认知的影响[J].河北医科大学学报,2015,36(10):1173-1176.
[7] 邵利芳,夏晓斌,鲍荣华.术前皮牵引对髋部骨折疼痛改善及复位的影响[J].上海交通大学学报:医学版,2015,35(6):851-854.
[8] 张英泽.成人髋部骨折指南解读[J].中华外科杂志,2015,53(1):57-62.
[9] 中华医学会麻醉学分会老年人麻醉学组,中华医学会麻醉学分会骨科麻醉学组.中国老年髋部骨折患者麻醉级围术期管理指导意见[J].中华医学杂志,2017,97(12):897-905.
[10] Guay J,Parker MJ,Griffiths R,et al. Peripheral nerve blocks for hip fractures[J]. Cochrane Database Sys Rev,2017,5:CD001159.
[11] 迟蕾,丁明,张迅,等.术前不同时长睡眠剥夺对大鼠认知功能的影响[J].临床麻醉学杂志,2015,31(8):790-792.
[12] 李兵,李彦,聂坤,等.胆碱能系统功能紊乱与帕金森病轻度认知功能障碍研究进展[J].中华老年心脑血管病杂志,2017,19(6):695-661.
[13] 姜华,王维强,李云涛,等.加速康复外科预防老年结直肠肿瘤患者择期手术后认知功能障碍发生的效果[J].癌症进展,2016,14(10):1037-1040.
[14] 刘佳,张晓玲.阿尔茨海默病认知障碍与疼痛的关系[J].中国疼痛医学杂志,2017,23(4):296-298.
[15] Vacas S,Degos V,Feng X,et al. The neuroinflammatory response of postoperative cognitive decline[J]. Br Med Bull,2013,106:161-178.
[16] Zhang X,Dong H,Li N,et al. Activated brain mast cells contribute to postoperative cognitive dysfunction by evoking microglia activation and neuronal apoptosis[J]. J Neuroinflammation,2016,13(1):127.
[17] Peng L,Xu L,Ouyang W. Role of peripheral inflammatory markers in postoperative cognitive dysfunction(POCD):a meta-analysis[J]. PLoS One,2013,8(11):e79624.
[18] 阳志芳,于冬男,孙强,等.急性贫血与老年患者术后认知功能障碍的关系[J].国际麻醉学与复苏杂志,2014,35(5):436-440.
[19] 谢莉,柴小青.术中低血压与血压波动对老年患者术后认知功能的影响[J].安徽医学,2016,37(9):1099-1101.