肝切除术是目前肝胆外科常规开展的手术之一,是治疗肝胆疾患的主要手段。自德国外科医生Langenbuch报道首次完成了世界第一例肝切除术以来,随着医学科学的发展,包括医学影像学、医学解剖学、外科手术器械、计算机科学及医学检测仪器的快速更新,手术模式逐步转向精准外科切除,肝切除术经历了不同的发展阶段,由不规则肝切除转变为规则肝切除术,再转变为解剖性肝段切除术。作为精准肝脏外科的先行者,2006年董家鸿教授在国际肝胆外科论坛上第一次提出“精准肝切除”的理念。2009年初,董家鸿教授在《中华外科杂志》上发表了“精准肝切除——21世纪肝脏外科新理念”的专题论述,这是第一次“精准肝切除”作为一个系统理念出现在医学文献中[1]。精准外科区别于以前的外科范畴,精确度手术能够实现基于多目标优化特点,包括确定性、可预测性、可控性、整合、标准化及个性化。在肝脏外科手术中,精准肝外科的策略正是寻求精准3M之间的平衡:最大限度地去除目标病变,最大限度地发挥功能性肝残余,并尽量减少手术侵袭性。精准肝切除是以患者最大化获益为根本目的,包括术前病情评估、手术规划与实施、麻醉及围手术期管理。现将2017年中国研究型医院学会肝胆胰外科专业委员会由董家鸿教授第一次组织相关专家组讨论制定的《精准肝切除术专家共识》[2]进行简单解读,希望对普外科医师有所帮助。
1 患者病情评估
与普通手术一样,对术前患者的一般情况的评估是手术能否顺利实施的首要因素。一般情况的评估包括对术前患者营养状况、全身各个系统(心血管系统、呼吸系统、肾功能、糖代谢异常)的评估。共识中重点提到对老年手术患者的评估,建议采用美国东部肿瘤协助组织体能评分及ASA分级和CPET检查进行判断[2-3]。
对于肝脏这一特殊器官的手术,除了上述的评估,还要针对肝脏基础疾病及病灶的评估。共识指出,对于合并有乙型肝炎病毒感染的患者,术前检出高病毒载量并ALT升高时,应该先积极抗病毒治疗[4]。对于有严重肝硬化门脉高压的患者,应慎重行肝大部分切除。对于合并时间大于2周的梗阻性黄疸的患者,血清TBil>200 μmol/L,术前应先减黄治疗,以增强肝脏对手术的耐受能力[5]。共识还指出,对于术前因化疗导致肝损伤患者,应重视术后可能出现的急性肝功能损伤[2,6]。
针对肝脏目标病灶的评估,必须综合彩色多普勒超声检查、多排螺旋CT检查、MRI检查、PET/CT检查、胆道造影检查、DSA检查、数字影像重建技术及肝脏穿刺活组织检查。共识指出,应首先采用无创方式,充分利用各个检查的特点对病灶进行评估,包括判断病灶的性质、分析病灶解剖学特点、与周围毗邻脏器的关系、是否需涉及多个脏器切除、肝内是否多个病灶、是否累及重要脉管、预留的肝脏脉管是否齐全、不全的情况下能否通过重建解决[2,7-8]。
2 肝脏储备功能评估及目标病灶可切除性评估
术前肝脏储备功能评估是评估肝脏肿瘤能否完整切除,了解患者不同方式肝切除术后的耐受能力,为手术最初的规划和实际实施提供安全的数据依据和保障,以减少患者术后发生肝衰竭的概率。评估肝脏储备功能的方法众多,各有意义,应进行多方面结合的评估,包括血清学试验、临床综合评价系统(Child评分系统)、吲哚菁绿排泄试验、肝切除安全限量的个体化评估。其中Child评分系统将肝功能分为3级:5~6分为Child A级,7~9分为Child B级,10~15分为Child C级(表1)。共识指出血清学试验检测包括ALT、AST、ALP、r-GGT、胆红素、白蛋白,能大体评判术前肝功能损伤及程度,可作为非肝脏手术的术前评估,但不能作为肝脏手术术前肝脏储备功能的评估及对术后肝衰竭的预测[2,9]。吲哚菁绿排泄试验联合Child分级可以作为肝脏储备功能及肝切除安全限量的评估[2,10]。2011年董家鸿教授关于肝切除术肝脏储备功能评估专家共识提出,苏黎世大学关于正常肝脏及肝硬化状态下的肝切除安全限量体系有一定的参考价值(图1,2)[2,11]。
精准肝切除应该根据目标病灶的性质,判断是否具有手术指征及病灶可否切除。共识指出,对于无症状的肝脏良性病变,应该严格控制手术指征,如肝血管瘤、局灶性结节增生等;对于恶性肿瘤,应进行完整R0切除的可切除性评估,避免对肝脏恶性病变行难以根治非R0切除术。同时共识还指出,定量化肝切除术决策系统是在不同肝病患者的背景下,判定能否安全实施精准肝切除的关键。定量化肝切除术决策系统是将ICG R15水平、Child分级、肝实质及脉管病变的影像学检查评估与肝脏体积测算相结合,采用RES设定肝切除安全限量手术规划[2,12-13](图3)。
表1 Child评分系统
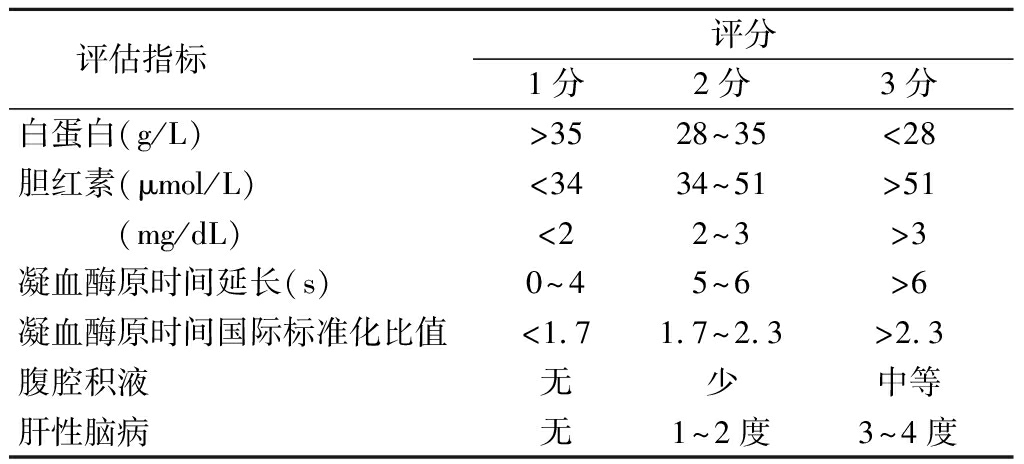
评估指标 评分1分2分3分白蛋白(g/L)>3528~35<28胆红素(μmol/L)<3434~51>51 (mg/dL)<22~3>3凝血酶原时间延长(s)0~45~6>6凝血酶原时间国际标准化比值<1.71.7~2.3>2.3腹腔积液无少中等肝性脑病无1~2度3~4度
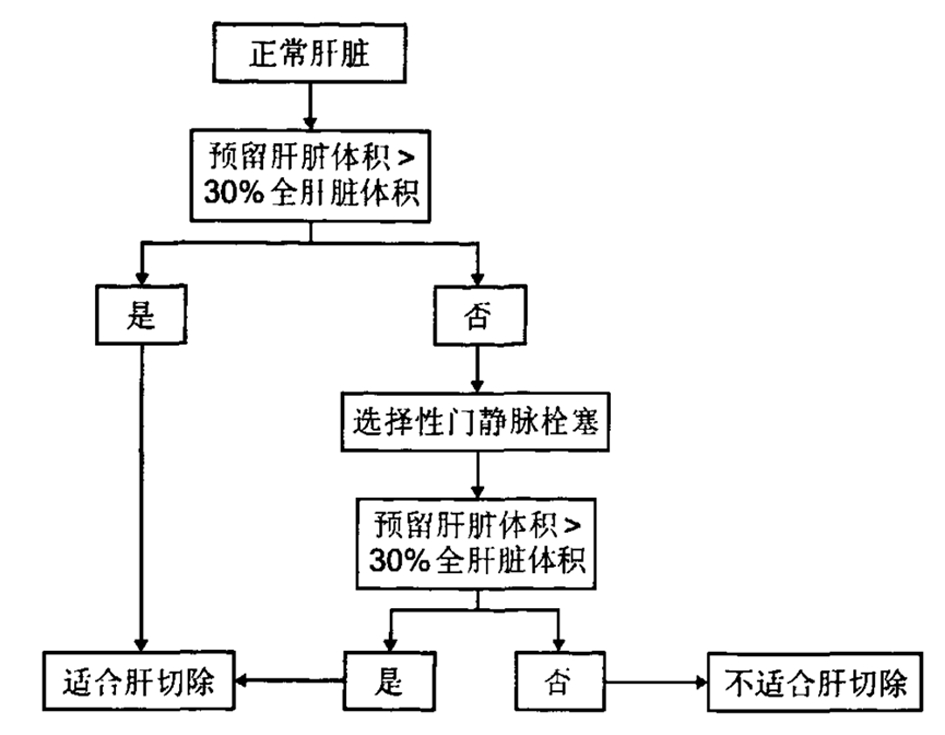
图1 苏黎世大学正常肝脏切除安全限量的评估标准

图2 苏黎世大学肝硬化肝脏切除安全限量的评估标准
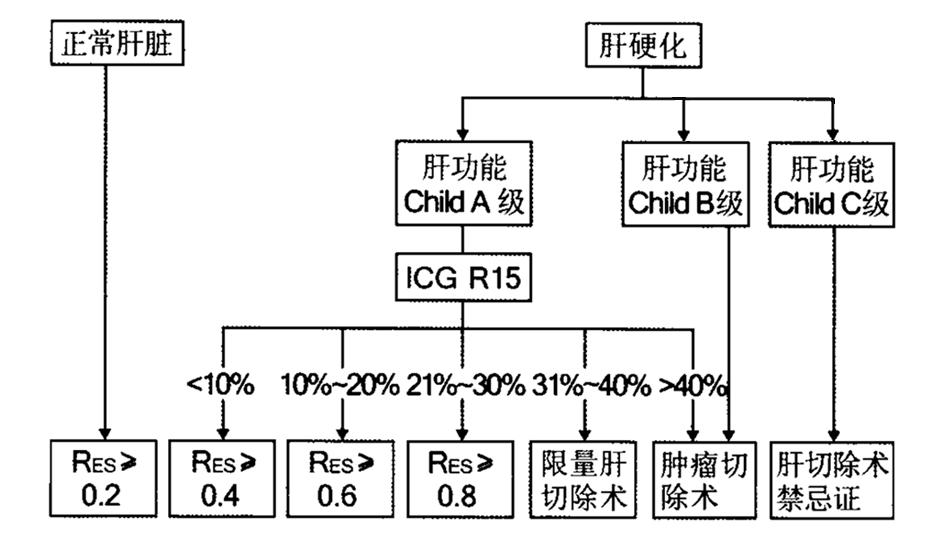
图3 定量化肝切除术决策系统示意图
3 手术规划及实施
精准肝切除手术规划是在患者营养状况,全身各个系统、肝脏目标病灶、肝脏储备功能评估及目标病灶可切除性综合评估的基础上,结合外科经验,对患者个体化手术方案的设计。手术规划包括了手术方式的选择,如开腹和腹腔镜手术、解剖性和非解剖性肝切除术、离体和在体肝切除术及手术时机选择与分期手术。
我科与共识一致,对于肝脏的良性占位,随着腹腔镜技术的成熟,在安全的情况下,包括肝脏各个特殊位置的占位如尾状叶及Ⅵ、Ⅶ、Ⅷ段病变,首选腹腔镜,采取非解剖切除。而对于恶性病变累及脉管,需要手术清扫范围大和脉管重建,建议开腹手术操作。共识还指出,大部分进展期的肝脏恶性占位、按肝脏解剖叶段分部的良性占位行解剖性肝切除,而对于肝储备功能差的恶性病变行非解剖性肝切除。体外肝切除的手术指征必须严格把握。当肝脏肿瘤侵犯脉管,在体肝切除和重建无法完成,且大出血等风险难以控制时,可考虑行体外肝切除[2,14]。
肝切除术手术规划还包括了确定肝脏良、恶性病变肝脏必须切除的范围且确保足够剩余的肝脏功能、确定肝实质的离断平面以及当肝动脉、肝静脉、门静脉受累时,剩余肝脏脉管的重建设计。对于脉管受累的复杂手术,术前应着重对剩余肝脏脉管重建的设计,剩余肝脏的脉管结构是否完好是决定剩余肝脏功能是否正常、减少肝衰竭发生的重要因素[2,15]。我科与共识一致,对于规划剩余肝脏达不到要求时,先行选择性肝动静脉栓塞的方法,使得剩余的肝脏代偿性增大,在达到手术的要求后再进行手术。对于一些合适的病例,还可进行联合肝脏分隔和门静脉接扎手术,二步切除手术。
精准肝切除手术的实施,在肝脏剩余功能性体积最大化、无瘤原则的基础上,应根据目标病灶性质、位置,选择病灶得以充分暴露的合适手术方式及切口、手术入路,以及最大限度控制出血及组织损伤、解剖性及非解剖性切除、肝实质离断平面和离断方法。共识指出,手术方式及切口选择包括腹腔镜手术的戳孔布置、开腹手术切口的选择;肝实质离断平面可以通过解剖标确定、肝脏病理学改变确定、阻断目标脉管后肝脏缺血范围确定、门静脉穿刺染色技术确定及数字影像技术确定;应根据病灶的位置、肝脏质地情况以及与脉管结构的关系,采取合适的确定离断平面及离断方法,轻柔操作、精细解剖,以保护剩余肝脏功能的精准手术理念[2,16]。
术中出血控制血流阻断和可靠的脉管重建是精准肝切除实施的可靠手段。血流的控制方法包括Pringle法、选择性入肝血流阻断(解剖性阻断)、选择性门静脉阻断、肝静脉系统血流阻断、全肝血流阻断等方法,应根据肝脏病变的位置、肝脏基础疾病情况、剩余肝段脉管情况采取合适的血流阻断及脉管重建方式[2,17-18]。
4 麻醉及围手术期的管理
麻醉管理方面也是保证精准肝切除术得以完美实施的重要环节。麻醉除了全面了解评估术前患者一般身体状况,还应针对肝脏疾病患者对麻醉药物代谢的特点,从镇静药物、阿片类药物及肌肉松弛药物的应用剂量等方面,根据不同肝脏情况进行个体化设计。共识指出,在术中,麻醉对于血流动力学的检测和管理、凝血功能的检测、内环境的监测及维护,尤其是术中中心静脉压的控制,建议使用血栓弹力图监测凝血,指导凝血因子的补充,能够有效减少肝切除过程中的出血[2]。我科在肝切除术术中麻醉管理与共识基本一致,在肝切除肝脏实质离断时,要求麻醉在循环稳定下,控制输液量及速度,扩血管药物等使中心静脉压控制在5 cmH2O以下,控制越低,越有利于控制减少肝切除过程中来源于肝静脉系统的出血。对于围手术期术后管理,目前在加快康复外科的理念指导下,术后早期管理包括持续监测循环和量入为出的液体管理,尽早拔除气管插管,尽早去除尿管、胃管及腹部引流管,多模式镇痛,鼓励早期下床活动,并行营养支持治疗。共识重点提到了术后肝功能不全的预防和治疗,术后补充白蛋白、血浆、纤维蛋白原,密切监测术后肝功能的变化,早期预见并及早对症治疗,联合不同药理机制的保肝药物治疗[2]。
5 结 语
肝脏结构上的精致与功能的复杂性构成了特殊的外科挑战。精准肝切除是建立在传统肝脏外科手术基础上发展建立起来的全新外科理念和技术体系。精确的肝脏外科手术体系的建立,将赋予外科实践更大的可预测性,更好的标准化与安全性。近年来,精准肝切除体系在肝胆外科领域逐步得到认可,并应用于临床,共识的形成有利于肝脏外科手术更加规范。随着数字化医学技术的发展及应用 ,精准肝切除理论体系将在实践中得以提升和完善,以患者为中心的诊断、预测和治疗技术的深入集成,必将更好地让患者获益。
[1] 董家鸿,黄志强.精准肝切除——21世纪肝脏外科新理念[J].中华外科杂志,2009,47(21):1601-1605.
[2] 中国研究型医院学会肝胆胰外科专业委员会.精准肝切除术专家共识[J].中华消化外科杂志,2017,16(9):883-893.
[3] Dong J,Yang S,Zeng J,et al. Precision in liver surge ry[J]. Semin Liver Dis,2013,33(3):189-203.
[4] Huang G,Lau WY,Shen F,et al. Preoperative hepatitis B virus DNA level is a risk factor for postoperative liver failure in patients who underwent partial hepatectomy for hepatitis B-related hepatocellular carcinoma[J]. World J Surg,2014,38(9):2370-2376.
[5] Saxena P,Kumbhari V,Zein ME,et al. Preoperative biliary drainage[J]. Dig Endosc,2015,27(2):265-277.
[6] 张玉,张莹,张佳伟,等.精准肝切除与常规肝切除对患者术后康复的临床分析[J].贵阳中医学院学报,2018,40(3):63-65.
[7] 侯建存,张雅敏.三维影像技术引导下复杂肝癌精准切除术的评估与实施[J].国际外科学杂志,2018,45(2):77-79.
[8] Oshiro Y,Yano H,Mitani J,et al. Novel 3-dimensional virtual hepatectomy simulation combined with real-time deformation[J]. World J Gastroenterol,2015,21(34):9982-9992.
[9] 董家鸿,郑数森,陈孝平.肝切除术前肝脏储备功能评估的专家共识(2011版)[J].中华消化外科杂志,2011,10(1):20-25.
[10] 李玉民,陈昊.浅谈精准肝切除术[J].国际外科学杂志,2018,45(2):89-93.
[11] 崔梦莹,盛基尧,张学文.基于精准肝切除理念的肝脏储备功能评估[J].国际外科学杂志,2018,45(2):83-86.
[12] Lau L,Christophi C,Nikfarjam M,et al. Assessment of Liver Remnant Using ICG Clearance Intraoperatively during Vascular Exclusion:Early Experience with the ALIIVE Technique[J]. HPB Surg,2015,2015:57052.
[13] 杨世忠,赵志远.从精准肝切除走向精准医学[J/CD].临床普外科电子杂志,2015,3(2):1-4,9.
[14] 李国兴.精准肝切除在肝脏外科的应用进展[J].交通医学,2012,26(5):424-428.
[15] 李方平,赖星,龚建平.精准肝切除术主要并发症的防治[J].国际外科学杂志,2018,45(2):86-88.
[16] 李德宇.精准肝切除的技术要点[J].新乡医学院学报,2016,33 (6):449-451,456.
[17] 姜玉池,孙备,王刚.浅谈微创观念指导下的精准肝切除[J].中华外科杂志,2009,47(21):1606-1609.
[18] Ross SW,Seshadri R,Walters AL,et al. Mortality in hepatectomy:Model for End-Stage Liver Disease as a predictor of death using the National Surgical Quality Improvement Program database[J]. Surgery,2016,159(3):777-792.