肝缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是肝脏疾病手术治疗过程中常见的并发症。HIRI的发生可引发术后肝功能不全与肝衰竭,直接影响手术成功率和术后生存率[1-4]。在肝脏手术治疗过程中,首先要阻断肝脏的血液供应,待手术完成后再重新恢复其血液供应,此即形成缺血再灌注,这样会有大量活性氧族(reactive oxygen species,ROS) 产生。ROS可通过改变细胞膜的通透性引起脂质过氧化,导致肝脏发生过氧化损伤[5-6]。因此,ROS被认为与HIRI的发生具有密切联系。谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)是机体重要的抗氧化酶。谷胱甘肽过氧化物酶1(glutathione peroxidase1,GPX-1)为GSH-Px家族表达最丰富的成员,存在于所有类型的细胞。GPX-1通过防止细胞内过氧化氢的有害积累等作用,在ROS平衡和应激信号传导中起着至关重要的作用[7-9]。肝脏是血液供应极为丰富的器官,对缺血缺氧的反应也极为敏感[10]。但在HIRI时肝脏GPX-1是否参与未见报道。本研究对此进行探讨。
1 材料与方法
1.1 主要试剂 提取RNA试剂Trizol,PCR扩增试剂dNTP、Taq DNA聚合酶购自Invitrogen公司。RNA-CDNA反转录试剂盒购自Promega公司。蛋白表达检测试剂:GPX-1一抗(兔抗鼠)为Abcam公司生产,GPX-1二抗(羊抗兔)为Zymed公司生产。检测丙二醛(malonaldehyde,MDA)含量、过氧化氢(hydrogen peroxide,H2O2)含量试剂盒购自南京建成科技公司。测定ALT活性试剂盒购自宁美康生物科技公司。
1.2 制备HIRI模型和组织样品采集 制备HIRI动物模型选用雄性Wistar大鼠,体重(200±10) g;12只大鼠随机分为对照组(6只)和肝缺血再灌注损伤组(HIRI组,6只)。建立大鼠HIRI动物模型[11]:腹腔注射6%水合氯醛(5 mL/kg)麻醉大鼠,常规消毒后打开腹腔寻认肝蒂,动脉夹夹闭肝右、中叶的肝蒂;30 min后松开动脉夹,恢复肝右、中叶血液供应,制备HIRI模型。对照组大鼠只游离肝蒂并不夹闭。肝右、中叶血液再灌注6 h后,右颈总动脉取血5 mL,低温离心机以3 000 r/min离心10 min,离心后采集上层血清,用于测定大鼠体内丙氨酸转氨酶(alanine aminotransferase,ALT)的活性;取部分肝组织固定于4%多聚甲醛中,用于观察其形态结构变化;其余置于液氮中,用于MDA、H2O2含量的测定,以及GPX-1表达的测定。
1.3 血清ALT活性测定 按照ALT活性测定说明书步骤测定大鼠血清中ALT的活性。
1.4 肝组织形态结构观察 采用苏木精-伊红(hematoxylin-eosin staining,HE)染色法,观察肝组织形态结构变化。修洁固定后的肝组织,约0.8 cm×0.8 cm×1.0 cm大小,经梯度乙醇脱水,二甲苯透明,随后浸蜡3 h、包埋成2.0 cm×2.0 cm×2.0 cm大小的蜡块,修块后进行连续切片,切片厚度5 μm,经37 ℃恒温水浴箱展片后裱于载玻片上,经常规HE染色操作(二甲苯脱蜡→乙醇至水→苏木精伊红染色→乙醇脱水→二甲苯透明→中性树胶封片),在光学显微镜下观察肝组织形态结构并拍照。
1.5 肝脏MDA、H2O2含量测定 液氮冻存后的肝组织,置于-80℃冰箱中保存。首先制备肝组织匀浆:取出约黄豆大小冻存肝组织,加入零度匀浆缓冲液,冰水浴下匀浆约1.5 min,匀浆液用低温离心机4 ℃下以4 000 r/min离心20 min,采集上清即为10%肝组织匀浆液。依次测定肝脏MDA含量:取肝组织匀浆液,按照南京建成试剂盒中MDA测定使用说明步骤测定MDA含量。最后测定肝脏H2O2含量:同样取肝组织匀浆液,按照南京建成试剂盒中H2O2测定使用说明操作步骤,测定H2O2含量。
1.6 肝组织GPX-1 mRNA表达水平测定 肝组织mRNA提取:取出约绿豆大小冻存肝组织,加入1 mL TRIzol,按照TRIzol使用说明书中操作步骤提取RNA。反转录:按照说明书操作步骤将3 μg RNA反转录成cDNA。PCR过程:mRNA表达的内参照,选用3磷酸甘油醛脱氢酶(GAPDH),GPX-1 mRNA水平的相对表达量,用GPX-1与GAPDH扩增产物灰度值之比表示。
1.7 肝组织GPX-1蛋白表达测定 采用Western blotting方法,测定肝组织内GPX-1蛋白的表达。取约黄豆大小冻存肝组织加入1 mL蛋白提取液,冰预下研磨1 min,离心后收集上清,用改良Lowry法进行蛋白定量。加入上样Buffer后煮沸变性。蛋白上样量62 μg,经SDS-PAGE凝胶电泳、半干转膜、封闭膜用5%脱脂奶粉;在膜上滴加一抗(1∶500稀释),室温(18 ℃)静置过夜,PBS洗膜2次,加辣根过氧化物酶标记的二抗(1∶1 000稀释)。条带出现后将膜扫描,对条带进行灰度值分析,用GPX-1与GAPDH条带的灰度值之比表示GPX-1蛋白水平的相对表达。
1.8 肝组织GPX-1 mRNA和蛋白表达与MDA含量、H2O2含量相关性分析 将大鼠肝组织内MDA、H2O2含量以及与其GPX-1 mRNA和蛋白水平的相对表达,采用Pearson法进行相关性分析。
1.9 统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较采用两独立样本的t检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠血清ALT活性 大鼠血清ALT活性,对照组为(20.03±5.23) U/L,HIRI组为(87.43±9.06) U/L,HIRI组血清ALT活性明显高于对照组,差异有统计学意义(t=15.774,P=0.000)。
2.2 大鼠肝组织形态结构的观察 大鼠肝组织切片HE染色形态结构观察,光学显微镜下400倍显示:对照组大鼠肝组织形态结构规整,未见异常。HIRI组大鼠肝血窦扩张明显,扩张的血窦内可见大量红细胞,肝细胞受压萎缩,胞浆染色变浅,还可见到空泡出现,细胞核染色也变浅,并可见炎细胞浸润现象(图1,2)。
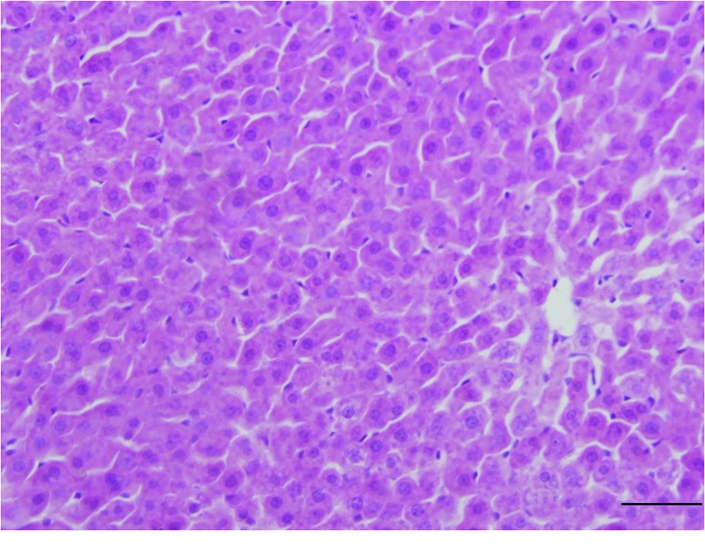
图1 对照组肝组织HE染色(×400)
Figure 1 HE staining of liver of control group (×400)
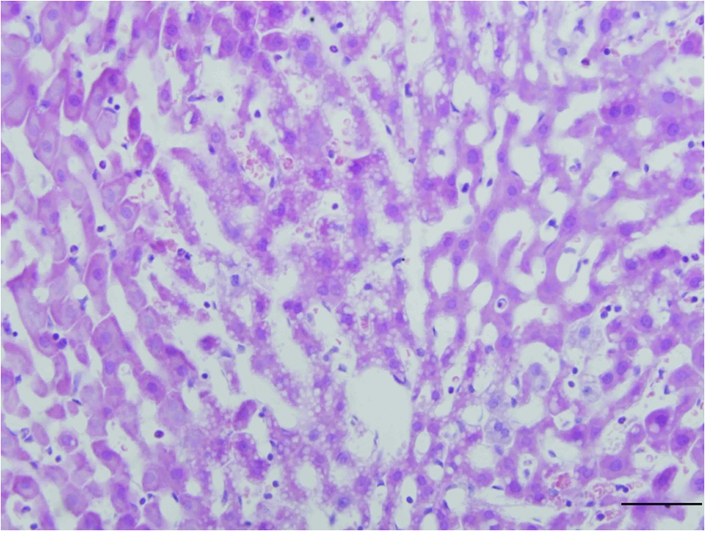
图2 HIRI组肝组织HE染色(×400)
Figure 2 HE staining of liver of HIRI group(×400)
2.3 大鼠肝组织内MDA、H2O2含量的变化 HIRI组肝组织内MDA、H2O2含量均明显高于对照组,差异均有统计学意义(P<0.05),见表1。
表1 大鼠肝组织内MDA,H2O2含量
Table 1 The MDA,H2O2 content in liver ![]()
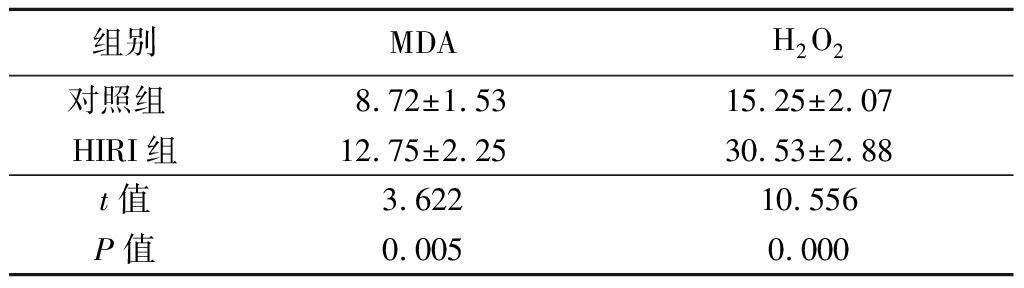
组别MDAH2O2对照组 8.72±1.5315.25±2.07HIRI组12.75±2.2530.53±2.88t值3.62210.556P值0.0050.000
2.4 大鼠肝组织内GPX-1 mRNA的相对表达 HIRI组大鼠肝组织内GPX-1 mRNA表达水平(0.72±0.11)明显高于对照组(0.45±0.07),差异有统计学意义(t=5.026,P<0.05)。
2.5 大鼠肝组织内GPX-1蛋白的相对表达 HIRI组大鼠肝组织内GPX-1蛋白的表达水平(0.76±0.13)明显高于对照组(0.55±0.10),差异有统计学意义(t=3.166,P<0.05)。
2.6 大鼠肝组织内GPX-1 mRNA和蛋白表达与MDA、H2O2含量的相关性 大鼠肝组织内MDA、H2O2的含量与GPX-1 mRNA表达水平呈正相关关系(P<0.05);MDA、H2O2的含量与GPX-1蛋白表达水平呈正相关关系(P<0.05)。见表2。
表2 大鼠肝组织内GPX-1 mRNA和蛋白表达与MDA、H2O2含量的相关性
Table 2 The Correlation between GPX-1 mRNA,protein expression and MDA,H2O2 content in rat liver

项别GPX-1 mRNAr值P值GPX-1蛋白 r值P值MDA0.6430.0240.622 0.031H2O20.7640.0040.6570.020
3 讨 论
肝脏外科手术(如肝外伤、肝脏部分切除、肝脏移植等)治疗过程中,需要暂时阻断肝脏的血液灌注,手术完成后再恢复其血液供应,此后即可引发肝缺血再灌注损伤。临床实践证实,肝缺血再灌注损伤也是引发肝移植术后肝功能不全或衰竭,增加术后病死率的一个主要因素[12-13]。有研究表明,肝脏的血液供应被暂时阻断,其后再恢复灌注的短暂过程中,即缺氧复氧过程中,会有大量ROS产生并释放出来;ROS所诱发的过氧化损伤,是肝缺血再灌注损伤的原因之一[14-15]。肝脏是机体内重要的代谢、解毒、分泌器官,由于其对能源的高要求,在很大程度上肝脏是个依赖氧气供应的器官;因此,容易受到缺血或缺氧的影响。本研究旨在观察HIRI模型组大鼠肝组织内MDA含量、H2O2含量、抗氧化酶GPX-1 mRNA和蛋白表达水平的变化及其相关性,探讨HIRI发生后GPX-1是否会发挥抗氧化作用。
首先,笔者通过夹闭大鼠肝中、右叶的肝蒂30 min,制成HIRI动物模型。在肝脏再灌注6 h后,与对照组相比,HIRI组大鼠的肝组织形态结构已受损明显。ALT主要位于肝细胞内,肝细胞受损后血液中ALT含量升高,导致血液中单位体积内ALT的活性升高。因此,血液中ALT的活性,可以作为检验肝功能的指标。与对照组相比,HIRI组大鼠血清ALT活性明显升高,提示缺血再灌注已导致肝细胞功能明显受损。HIRI组大鼠肝组织形态结构和肝细胞功能的损伤表现,证实HIRI模型建立成功。
ROS包括H2O2、超氧阴离子等,它们代谢活跃,能与许多蛋白和脂类物质发生过氧化反应,导致细胞损伤甚至死亡[16]。H2O2因其含量丰富、形式稳定、半衰期长、可在细胞内外扩散等特点,被认为是造成过氧化损伤的主要原因[17]。因此,笔者选用肝组织内H2O2含量表示肝脏氧化应激的水平。本研究结果显示,HIRI组大鼠肝脏内H2O2含量明显升高。表明HIRI后肝组织产生了大量ROS,使其处于高度氧化应激状态。ROS能与脂类物质发生过氧化反应,MDA 是其代谢产物之一。 因此,肝组织内MDA的含量可以衡量细胞过氧化损伤的程度[18]。本研究结果显示,HIRI组大鼠肝组织内MDA含量明显升高。结合肝细胞内H2O2含量的升高,推测在HIRI发生时肝组织内有大量H2O2等活性氧族产生,它们与胞膜和胞内脂类物质发生过氧化反应产生MDA,表明肝组织此时不仅处于高度氧化应激状态,并且已遭受过氧化损伤。
氧化应激的主要特点是ROS的产生和抗氧化酶活性之间的不平衡。过量ROS的产生会对蛋白质、脂类和DNA造成氧化损伤。因此,维持活性氧平衡对细胞生长和存活至关重要。GPX-1是细胞内抗氧化体系的一种主要酶蛋白,可保护机体免受氧化损伤,它存在于细胞质和线粒体间隔中,也存在于某种细胞的过氧化物酶体内。已有研究发现,在许多生理条件下,GPX-1比过氧化氢酶更能有效保护细胞对抗细胞内过氧化物,分解H2O2和有机过氧化物,抑制H2O2诱导的DNA损伤、脂质过氧化和蛋白质降解等[19-20]。本研究结果显示,HIRI肝脏GPX-1表达升高,并且与H2O2、MDA含量呈正相关。因此,有理由推测HIRI发生时大量ROS由肝脏产生,并与脂类物质发生过氧化反应,诱发肝细胞损伤。这也与上述的肝组织形态结构和肝细胞功能受损相吻合。此时,大鼠受到刺激后上调GPx-1的表达,用以清除大量的ROS,减轻肝细胞损伤。
本研究证实,在HIRI发生时,肝脏处于氧化应激状态,并且遭受过氧化损伤;此时肝组织内GPX-1表达上调,可减轻肝细胞的进一步损伤。
[1] Richards JA,Wigmore SJ,Anderton SM,et al. NKT cells are important mediators of hepatic ischemia-reperfusion injury[J]. Transpl Immunol,2017,45:15-21.
[2] Wei L,Chen WY,Hu T,et al. Effect and mechanism of propofol in hepatic ischemia /reperfusion injury of rat[J]. Eur Rev Med Pharmacol Sci,2017,21(15):3516-3522.
[3] Zhang M,Yang D,Gong X,et al. Protective benefits of AMP-activated protein kinase in hepatic ischemia-reperfusion injury[J]. Am J Transl Res,2017,9(3):823-829.
[4] Kim MS,Lee S,Jung N,et al. The vitamin D analogue paricalcitol attenuates hepatic ischemia/reperfusion injury through down-regulation of Toll-like receptor 4 signaling in rats[J]. Arch Med Sci,2017,13(2):459-469.
[5] Çakir T,Aslaner A,Tekeli SÖ,et al. Grape seed protects cholestatic rats liver from ischemia/reperfusion injury[J]. Acta Cir Bras,2016,31(3):183-189.
[6] Abdo EE,Figueira ERR,Rocha-Filho JA,et al. Preliminary results of topical hepatic hypothermiain a model of liverischemia/reperfusion injury in rats[J]. Arq Gastroenterol,2017,54(3):246-249.
[7] Aghakhani R,Nasiri M,Irani D. Glutathione Peroxidase 1 Gene Polymorphism in Nephrolithiasis Patients From South of Iran[J]. Iran J Kidney Dis,2017,11(1):29-35.
[8] Liu M,Gao L,Zhao L,et al. Peptide-Au Clusters Induced Tumor Cells Apoptosis via Targeting Glutathione Peroxidase-1: The Molecular Dynamics Assisted Experimental Studies[J]. Sci Rep,2017,7(1):131.
[9] Murakoshi M,Osamura RY.Immunolocalization of Glutathione-Peroxidase(GPx1) in the Rat Adrenal Cortex: Correlation between Steroidogenesis and Lipid Peroxidation[J]. Acta Histochem Cytochem,2017,50(2):57-61.
[10] Li J,Li RJ,Lv GY,et al. The mechanisms and strategies to protect from hepatic ischemia-reperfusion injury[J]. Eur Rev Med Pharmacol Sci,2015,19(11):2036-2047.
[11] Yucel AF,Pergel A,Aydin I,et al. Effect of infliximab on acute hepatic ischemia/reperfusion injury in rats[J]. Int J Clin Exp Med,2015,8(11):21287-21294.
[12] Gong J,Wang J,Tian Y,et al. Expression of tubulin folding cofactor B in mouse hepatic ischemia-reperfusion injury[J]. Biomed Rep,2017,6(5):525-531.
[13] Tao YE,Wen Z,Song Y,et al. Paeoniflorin attenuates hepatic ischemia/reperfusion injury via anti-oxidative,anti-inflammatory and anti-apoptotic pathways[J]. Exp Ther Med,2016,11(1):263-268.
[14] Manne NDPK,Arvapalli R,Graffeo VA,et al. Prophylactic Treatment with Cerium Oxide Nanoparticles Attenuate Hepatic IschemiaReperfusion Injury in Sprague Dawley Rats[J]. Cell Physiol Biochem,2017,42(5):1837-1846.
[15] Lin YZ,Lu ZY,Liang XH,et al. Effect of breviscapine against hepatic ischemia[J]. J Surg Res,2016,203(2):268-274.
[16] Kim KS,Lee D,Song CG,et al. Reactive oxygen species-activated nanomaterials as theranostic agents[J]. Nanomedicine(Lond),2015,10(17):2709-2723.
[17] Guesmi F,Tyagi AK,Bellamine H,et al. Antioxidant Machinery Related to Decreased MDA Generation by Thymus Algeriensis Essential Oil-induced Liver and Kidney Regeneration[J]. Biomed Environ Sci,2016,29(9):639-649.
[18] Mumcu UY,Kocer I,Ates O,et al. Decreased paraoxonase1 activity and increased malondialdehyde and oxidative DNA damage levels in primary open angle glaucoma[J]. Int J Ophthalmol,2016,9(10):1518-1520.
[19] Jin L,Li D,Alesi GN,et al. Glutamate dehydrogenase 1 signals through antioxidant glutathione peroxidase 1 to regulateredox homeostasis and tumor growth[J]. Cancer Cell,2015,27(2):257-270.
[20] Mahyar A,Ayazi P,Dalirani R,et al. Feasible Relation between Glutathione Peroxidase and Febrile Seizure[J]. Iran J Child Neurol,2017,11(1):65-69.