颅外段颈动脉狭窄(extracranial carotid stenostic,ECS)主要因颅外段颈动脉粥样硬化(atherosclerosis,AS)而发生血管狭窄,从而引发缺血性脑卒中,且其狭窄程度可影响卒中发生的类型和病灶位置[1-2]。近年来,临床治疗ECS的主要手段为非手术疗法联合手术疗法,血管介入术是囊括颈动脉血管成形和支架植入术的手术治疗手段之一[3]。术后应用氯吡格雷等药物可起到抗血小板聚集的功效,他汀类降脂药物也渐渐被应用于ECS患者血管介入术后的治疗[4-5]。本研究选取我院神经内科择期行血管介入术的82例ECS患者为研究对象,旨在探讨阿托伐他汀联合氯吡格雷对行血管介入术后ECS患者的疗效和安全性。
1 资料与方法
1.1 一般资料 选取2014年1月—2017年1月于我院神经内科择期行血管介入术的82例ECS患者为研究对象。纳入标准:符合ECS的诊断标准[6],经颅CT、颅脑CT血管造影术(CT angiography,CTA)或磁共振血管成像(magnetic resonance angiography,MRA)检查发现颅外段颈AS斑块引起的血管狭窄;均为症状性ECS狭窄程度>50%患者;经数字减影血管造影(digital subtraction angiography,DSA)检查发现位于单侧或双侧;存在短暂性脑缺血发作(transient ischemic attack,TIA)、阵发性头痛、头晕等症状;患者均自愿参与本研究并签署知情同意书。
排除标准:颅内动静脉血管畸形者;严重狭窄(超过95%)者;存在颈动脉瘤或其他脑部肿瘤者;肌纤维发育不良者;患有严重重要脏器功能疾病者;有血管造影剂或研究用药禁忌证者。采用密封信封法分为联合组(41例)和对照组(41例)。2组ECS患者一般资料差异无统计学意义(P>0.05),具有可比性,见表1。
本研究经医院医学伦理委员会批准。
表1 2组一般资料比较
Table 1 Comparison of general data between two groups (n=41,例数)
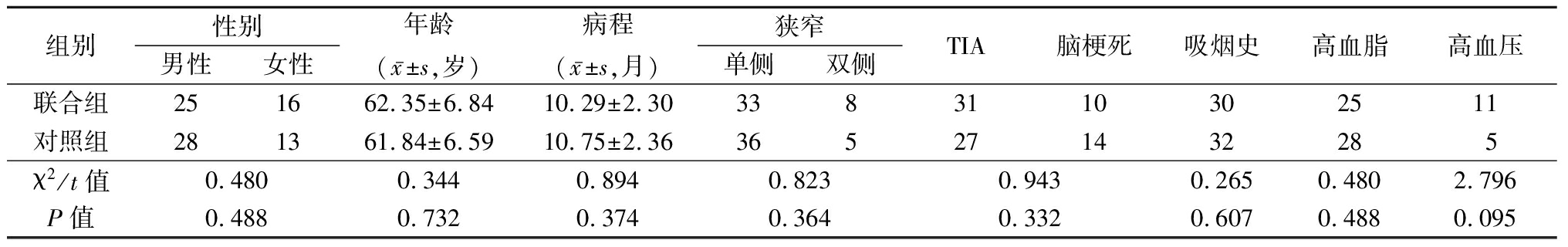
组别性别男性女性年龄(x-±s,岁)病程(x-±s,月)狭窄单侧双侧TIA脑梗死吸烟史高血脂高血压联合组251662.35±6.8410.29±2.303383110302511对照组281361.84±6.5910.75±2.36365271432285χ2/t值0.4800.3440.8940.8230.9430.2650.4802.796P值0.4880.7320.3740.3640.3320.6070.4880.095
1.2 围术期准备及手术方法 患者入院后行常规检查,术前行相应颅CT、CTA及MRA检查,确定患者颅外段动脉的狭窄部位、程度及病变血管的情况。待血糖、血压稳定后择期行血管介入术,手术均由高年资医师完成。术前均给予阿司匹林肠溶片(拜耳公司)0.3 g/次,1次/d,硫酸氢氯吡格雷片[赛诺菲(杭州)制药有限公司,国药准字J20080090,75 mg]75 mg/次,1次/d,均口服3~5 d;术前2 h开始持续静脉泵入尼莫地平注射液(西安德天药业股份有限公司,国药准字H20054543,20 nL:4 mg)。
患者入手术室后均平躺于手术台,实时监测各项生命体征,局麻后行右侧股动脉穿剌,置8 F动脉鞘,经导管给予全身肝素化,行动脉造影以测定狭窄段远端和近端血管内径,路图引导下在远端正常血管处置入脑保护装置,支架植入后即可撤除,狭窄处有AS斑块且支架输送较难的患者现行球囊扩张,按支架直径-血管内经=1 mm和支架两端长度-病变两端≈0.75 cm的标准选择合适支架。复查CTA,观察颈动脉形体是否满意、动脉显影是否良好,再撤除脑保护装置后复查CTA,术后24 h严密监测神经功能和各项生命体征,术后3~6 h将鞘管拔出,若出现心动过缓时应静脉泵注适量多巴胺和阿托品以维持患者动脉压和心率。术后所有患者均持续1周口服阿司匹林肠溶片(拜耳公司)0.3 g/次,1次/d,而后长期继续0.1 g/次,1次/d的剂量口服;硫酸氢氯吡格雷片继续按术前的剂量服用,持续治疗3个月;联合组在上述基础上加用阿托伐他汀钙片(爱尔兰 Pfizer Ireland Pharmaceuticals,国药准字H20120349,10 mg)口服,20 mg/次,1次/d,持续治疗3个月。
1.3 观察指标 ①术后疗效:比较2组手术成功率、术前平均狭窄率和术后平均残余狭窄率,比较2组术前及术后3个月的美国国立卫生研究院卒中量表(National Institutesof Health Stroke Scale,NIHSS)评分[7]、简易智力状况检查(Mini-Mental State Examination,MMSE)评分[8];②2组术前、术后3个月血脂水平:分别于患者入院后第2天和术后3个月抽取清晨空腹12 h静脉血于抗凝管中,离心后取上清液待测,血脂指标低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)及高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平均采用酶法进行测定;③2组血小板活化指标:应用贝克曼Cyto FLEX流式细胞仪分别检测2组术前、术后3个月血小板膜糖蛋白(CD62p、CD63p、GPⅡb/Ⅲa受体复合物)的水平;④2组术前、术后3个月颈动脉内中膜层厚度(intima-media thickness,IMT)、AS斑块数量和面积:IMT超过1.1 mm即为AS斑块;⑤术后并发症:观察比较2组术后3个月内出现血管痉挛、颅内出血及其他症状情况。
1.4 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 术后疗效 2组手术支架植入成功率均为100%。联合组术前平均狭窄率为80.24%、术后平均残余狭窄率为11.30%,对照组术前平均狭窄率为79.58%、术后平均残余狭窄率为10.97%,2组术前平均狭窄率及术后平均残余狭窄率差异均无统计学意义(χ2=0.074、0.125,P>0.05)。术后3个月头颈CTA均未发现再狭窄。2组术后3个月NIHSS和MMSE评分均显著改善,且联合组改善幅度大于对照组,差异均有统计学意义(P<0.05),见表2。
表2 2组NIHSS和MMSE评分比较
Table 2 Comparison of NIHSS and MMSE score two groups ![]() 分)
分)
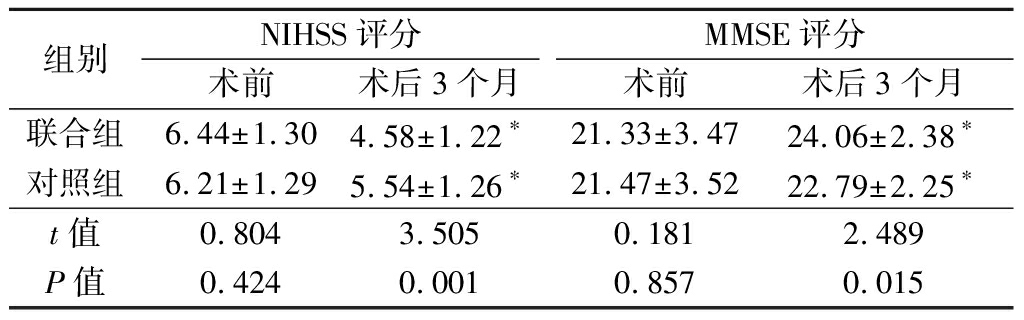
组别NIHSS评分术前术后3个月MMSE评分术前术后3个月联合组6.44±1.304.58±1.22∗21.33±3.4724.06±2.38∗对照组6.21±1.295.54±1.26∗21.47±3.5222.79±2.25∗t值0.8043.5050.1812.489P值0.4240.0010.8570.015
*P值<0.05与术前比较(配对t检验)
2.2 2组血脂水平比较 术前2组TG、TC、HDL-C、LDL-C差异均无统计学意义(P>0.05);术后3个月2组TG、TC、LDL-C均显著下降,HDL-C均显著上升,联合组TG、TC、HDL-C、LDL-C变化幅度均大于对照组,差异有统计学意义(P<0.05)。见表3。
2.3 2组血小板活化指标比较 术前2组CD62p、CD63p、GPⅡb/Ⅲa差异均无统计学意义(P>0.05);术后3个月2组CD62p、CD63p、GPⅡb/Ⅲa均显著下降(P<0.05),而联合组各血小板活化指标与对照组差异无统计学意义(P>0.05)。见表4。
表3 2组术前、术后血脂水平比较
Table 3 Comparison of blood lipids levels before and after operation between two groups ![]()
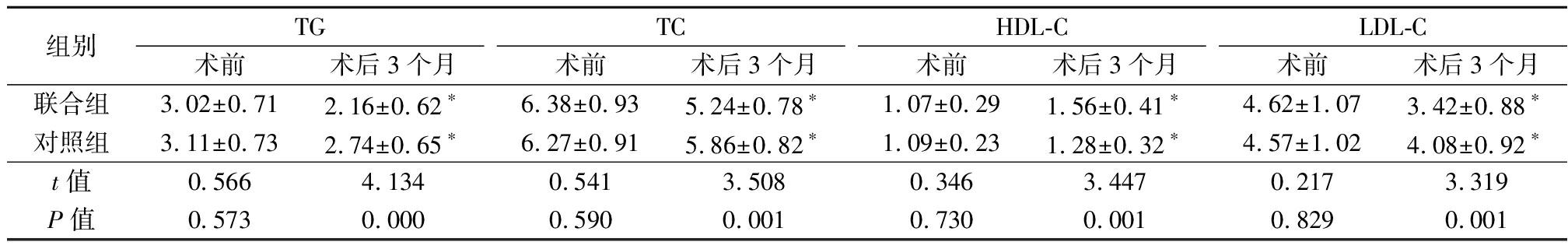
组别TG术前术后3个月TC术前术后3个月HDL-C术前术后3个月LDL-C术前术后3个月联合组3.02±0.712.16±0.62∗6.38±0.935.24±0.78∗1.07±0.291.56±0.41∗4.62±1.073.42±0.88∗对照组3.11±0.732.74±0.65∗6.27±0.915.86±0.82∗1.09±0.231.28±0.32∗4.57±1.024.08±0.92∗t值0.5664.1340.5413.5080.3463.4470.2173.319P值0.5730.0000.5900.0010.7300.0010.8290.001
*P值<0.05与术前比较(配对t检验)
表4 2组术前、术后血小板活化指标比较
Table 4 Comparison of platelet activation indexes before and after operation between two groups ![]()
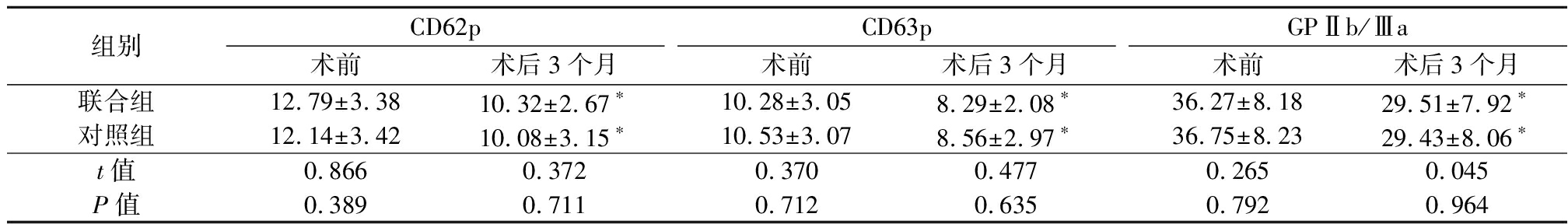
组别CD62p术前术后3个月CD63p术前术后3个月GPⅡb/Ⅲa术前术后3个月联合组12.79±3.3810.32±2.67∗10.28±3.058.29±2.08∗36.27±8.1829.51±7.92∗对照组12.14±3.4210.08±3.15∗10.53±3.078.56±2.97∗36.75±8.2329.43±8.06∗t值0.8660.3720.3700.4770.2650.045P值0.3890.7110.7120.6350.7920.964
*P值<0.05与术前比较(配对t检验)
2.4 2组IMT、AS斑块数量和面积比较 术前2组IMT、AS斑块数量和面积差异均无统计学意义(P>0.05);术后3个月2组IMT、AS斑块数量和面积均显著下降(P<0.05),且联合组各指标降低幅度均大于对照组,差异有统计学意义(P<0.05)。见表5。
表5 2组术前、术后IMT、AS斑块数量和面积比较
Table 5 Comparison of IMT,and quantity and area of AS plaques before and after operation between two groups ![]()
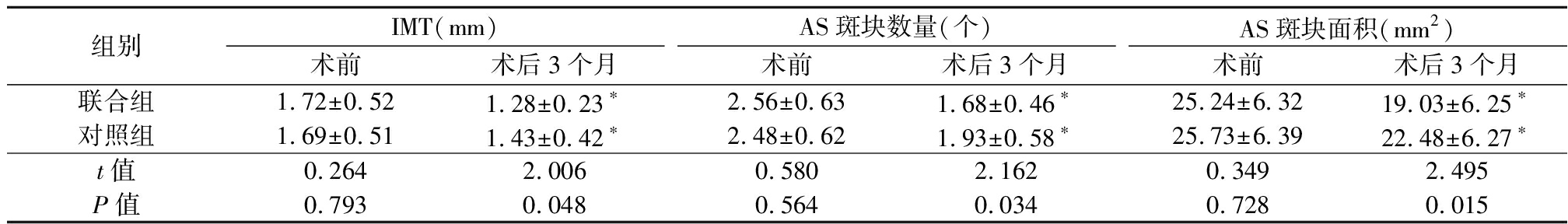
组别IMT(mm)术前术后3个月AS斑块数量(个)术前术后3个月AS斑块面积(mm2)术前术后3个月联合组1.72±0.521.28±0.23∗2.56±0.631.68±0.46∗25.24±6.3219.03±6.25∗对照组1.69±0.511.43±0.42∗2.48±0.621.93±0.58∗25.73±6.3922.48±6.27∗t值0.2642.0060.5802.1620.3492.495P值0.7930.0480.5640.0340.7280.015
*P值<0.05与术前比较(配对t检验)
2.5 2组术后并发症比较 联合组术后出现血管痉挛1例,颅内出血1例,其他症状1例,总发生率为7.32%(3/41);对照组血管痉挛3例,颅内出血2例,其他症状2例,总发生率为17.07%(7/41);2组并发症总发生率差异无统计学意义(χ2=1.822,P=0.177)。
3 讨 论
近年来,全球ECS的发生率呈增长趋势,ECS可引起血管闭塞、颅内供血不足,从而诱发缺血性脑卒中。颈动脉AS斑块的形成和脱落是缺血性脑卒中真正的危险因素[9]。临床对于ECS多采用药物联合手术的方式疏通血管,治疗效果较好,但手术对术者的要求较高,术后易出现再狭窄、颅内出血等并发症,故如何提高患者预后是目前临床研究的热点[10]。本研究结果显示治疗3个月后2组各项检测指标均有显著改善,究其原因为2组术前、术后均服用了氯吡格雷,氯吡格雷是临床常用的一线抗血小板药物,其作用机制为通过选择性地抑制二磷酸腺苷与其血小板膜表面受体结合,达到隐藏血小板膜糖蛋白Ⅱb/Ⅲa受体的纤维蛋白原结合点的目的,阻断纤维蛋白原与血小板Ⅱb/Ⅲa受体的结合,并阻断二磷酸腺苷扩增性血小板活化,最终抑制血小板聚集[11-12]。
患者行血管介入术后血管狭窄率显著改善的同时,也常出现血管内膜损伤,内膜下的各种促凝物质大量释放,从而激活凝血酶原,加快凝血酶的产生,而术前、术后服用氯吡格雷能有效抑制血小板的活化和聚集、预防微血栓的形成以及术后短期支架内再狭窄[13]。本研究术后3个月2组CD62p、CD63p、GPⅡb/Ⅲa均显著下降。有学者指出经CYP3A4代谢的阿托伐他汀可能会削弱经CYP3A4活化的氯吡格雷的抗血小板聚集功能,但本研究与大多数研究结果一致的是2组术后3个月血小板活化指标无显著差异[14]。
本研究结果显示联合组疗效明显优于对照组,表明阿托伐他汀+氯吡格雷可发挥协同作用,能有效改善患者术后的NIHSS评分、MMSE评分、血脂水平、IMT、AS斑块数量和面积。究其原因为阿托伐他汀的药理作用机制是选择性抑制肝脏内三羟基三甲基辅酶A还原酶和胆固醇的合成,可降低血浆中胆固醇、脂蛋白水平,达到调节脂质水平紊乱和抗AS的作用,同时还可通过降低血液中LDL-C水平,缩小斑块面积,从而促进AS斑块消退,并增加其稳定性[15]。血管痉挛、颅内出血是血管介入术常见的手术相关并发症,可能是术中操作导管或鞘管时损伤血管内膜所致。本研究2组并发症总发生率无明显差异,可能与本研究样本例数较少有关[16]。本研究对患者术后观察时间较短,仅代表阿托伐他汀联合氯吡格雷对血管介入术术后短期预后效果,仍需大量临床研究探索阿托伐他汀联合氯吡格雷血管介入术术后的长期疗效。
综上所述,阿托伐他汀联合氯吡格雷可有效改善行血管介入术后ECS患者的预后,改善血脂水平、神经功能缺损和认识功能,控制血小板活化,抑制AS的发生。
[1] 刘奇,郭飞,赵宇,等.颈动脉支架成形术治疗颅外段颈动脉夹层的疗效观察[J].卒中与神经疾病,2016,23(4):228-231.
[2] 戚悠飞,肖占祥,曾昭凡,等.症状性颈内动脉闭塞的术前评估及手术治疗[J].中国普通外科杂志,2016,25(12):1707-1712.
[3] 高鹏,马妍,王亚冰,等.颅内大动脉慢性闭塞血管内再通的可行性和安全性分析[J].中国脑血管病杂志,2017,14(8):405-409.
[4] Tsoumani ME,Tatsidou PT,Ntalas IV,et al. Dynamic platelet adhesion in patients with an acute coronary syndrome:the effect of antiplatelet therapy[J]. Platelets,2016,27(8):812-820.
[5] Wang H,Qi J,Li Y,et al. Pharmacodynamics and Pharmacokinetics of Ticagrelor Versus Clopidogrel in Patients with Acute Coronary Syndromes and Chronic Kidney Disease[J]. Br J Clin Pharmacol,2017,84(1):88-96.
[6] 中华医学会外科学分会血管外科学组.颅外段颈动脉狭窄治疗指南[J].中国实用外科杂志,2008,28(11):913-915.
[7] 黄圣明,王明科,郑春玲,等.血管内支架植入术治疗症状性颅内动脉狭窄的临床研究[J].中风与神经疾病杂志,2016,33(12):1126-1127.
[8] 李菁,韩冰莎,贺迎坤,等.重度颈动脉狭窄腔内支架植入术后认知功能临床研究[J].介入放射学杂志,2015,24(11):943-945.
[9] Selwaness M,Bos D,van den Bouwhuijsen Q,et al. Carotid Atherosclerotic Plaque Characteristics on Magnetic Resonance Imaging Relate With History of Stroke and Coronary Heart Disease[J]. Stroke,2016,47(6):1542-1547.
[10] 张利通,董文涛,高峰,等.颈动脉狭窄患者术后并发症影响因素的研究现状[J].中华神经外科杂志,2015,31(1):98-101.
[11] 彭凌云,丁怀胜,李原,等.氯吡格雷低反应的高危冠心病患者改用替格瑞洛抗血栓治疗效果观察[J].河北医科大学学报,2016,37(12):1370-1373.
[12] Saati S,Abrams-Ogg ACG,Blois SL,et al. Comparison of Multiplate,Platelet Function Analyzer-200,and Plateletworks in Healthy Dogs Treated with Aspirin and Clopidogrel[J]. J Vet Intern Med,2018,32(1):71-72.
[13] 李然,王德良,王文素.术前强化阿托伐他汀联合充分水化疗法对PCI术后并发造影剂肾病的影响[J].河北医科大学学报,2017,38(3):262-265.
[14] 王鹏,严妍,于文君,等.阿托伐他汀与瑞舒伐他汀对冠心病患者的疗效与安全性对比观察[J].中国医院药学杂志,2018,38(2):169-172.
[15] 姚立军,陈弹.瑞舒伐他汀与阿托伐他汀对冠心病患者血脂、动脉粥样硬化程度和血管内皮舒张功能的疗效对比[J].中国药房,2017,28(35):4963-4966.
[16] 徐正虎,王君.颈动脉支架置入术后并发症及处理方法[J].中华老年心脑血管病杂志,2015,17(8):837-840.