荟萃分析显示,1975—2014年40年间,全球体重指数(body mass index,BMI)≥30的肥胖人口患病率显著增加,其中男性肥胖人口的患病率由3.2%(2.4%~4.1%)增长至10.8%(9.7%~12.0%),女性肥胖人口的患病率由6.4%(5.1%~7.8%)增长至14.9%(13.6%~16.1%);全球男性肥胖人口数量由0.34亿增至2.66亿,女性肥胖人口数量由0.71亿增长至3.75亿,严重肥胖的男性人口为0.58亿,严重肥胖的女性人口为1.26亿;至2014年,我国男性肥胖人口数量由1975年的70万人增长至4 320万人,女性肥胖人口由170万人增长至4 640万人,肥胖的总人口数量已位居世界首位,其中严重肥胖的男性患者为430万、女性患者为760万,严重肥胖总人口数量位居世界第二位[1]。肥胖症会造成2型糖尿病(type 2 diabetes mellitus,T2DM)、心脑血管疾病发生风险显著增加[2],超重以及肥胖症对T2DM患者的心脏功能有不良影响[3]。因此,对肥胖症进行早期精准评估和防治有重要意义。胰岛素抵抗(insulin resistance,IR)是T2DM的重要发病机制之一,腹型肥胖与IR密切相关[4],腹部脂肪增多、特别是内脏脂肪增多在IR发生中起重要作用。评价IR的指标及方法多样,但各有优缺点,如简易体脂参数方便简洁,但准确性有待于进一步探讨。本研究通过简易体脂参数与CT测量的腹部内脏脂肪面积(the area of intraabdominal adipose,I)、皮下脂肪面积(the area of subcutaneous adipose,S)及I/S比值评价腹型肥胖程度,分析简易体脂参数与CT测量的腹部内脏脂肪面积、皮下脂肪面积及两者比值与IR指数(HOMA1-insulin resistance index,HOMA1-IRI)的相关性,从而确定CT测量腹部脂肪面积对IR评价功能的优势及其意义。
1 资料与方法
1.1 一般资料 选择2013年1—12月河北医科大学第三医院内分泌一科收治的腹型肥胖(BMI>25.0)且糖耐量正常的患者50例作为对照组,其中男性25例,女性25例,年龄32~66岁,平均(56.2±2.4)岁;伴腹型肥胖的T2DM患者(T2DM组)50例,其中男性26例,女性24例,年龄35~64岁,平均(57.8±3.5)岁。 2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
本研究经河北医科大学第三医院伦理委员会批准通过。
诊断标准:诊断T2DM依据1999年世界卫生组织糖尿病专家委员会制定的糖尿病诊断标准;诊断肥胖依据2000年亚太地区关于肥胖症的诊断标准(BMI>25.0)。排除标准:①1型糖尿病、妊娠期糖尿病及其他特殊类型糖尿病;②并发心力衰竭、肝衰竭、肾衰竭、呼吸衰竭等任何脏器功能衰竭;③创伤、感染等应激所致的糖代谢异常;④合并高血压病、冠心病,或出现糖尿病肾病、糖尿病足等严重糖尿病并发症。
1.2 观察指标 ①血压、体重、身高、腰围、臀围(计算腰臀比),连续测量3次 取平均值;计算BMI。②所有受试者均行75 g葡萄糖耐量试验,血糖用葡萄糖氧化酶-过氧化物酶法,胰岛素用放射免疫法;采用酶法检测空腹血三酰甘油(triglycerides,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C);测得的空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)数值用稳态模型评估1法计算HOMA1-IRI(HOMA1-IRI=FBG×FINS/22.5)。③所有受试者取仰卧位、屏气状态下取脐平面由固定专业技术人员以西门子64排螺旋CT扫描仪进行扫描,扫描层厚及重建间隔均为5 mm;CT后处理工作站对腹部内脏及皮下脂肪面积进行测算;沿腹部皮肤轮廓及腹壁肌肉外缘界限画出皮下脂肪兴趣区(ROI 1区),沿腹壁肌肉内缘及脊柱前缘界限画出腹腔及腹膜后兴趣区(ROI 2区) ,分别完成ROI 1区及ROI 2区衰减范围内全部像素面积的测量后,计算二者的比值(脂肪衰减范围为-250~-50 Hu)。
1.3 统计学方法 应用SPSS 20.0统计软件分析数据。HOMA1-IRI取自然对数(lnHOMA1-IRI)使其正态化,计量资料比较采用t检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组观察指标比较 T2DM组FBG、FINS、空腹C肽、HOMA1-IRI、lnHOMA1-IRI、腹部内脏脂肪面积、I/S比值高于对照组,HDL-C低于对照组,差异有统计学意义(P<0.05);2组腹围、BMI、TG、LDL-C、腰臀比和皮下脂肪面积差异均无统计学意义(P>0.05)。见表1。
表1 2组观察指标比较
Table 1 Comparison of some parameters between two groups ![]()
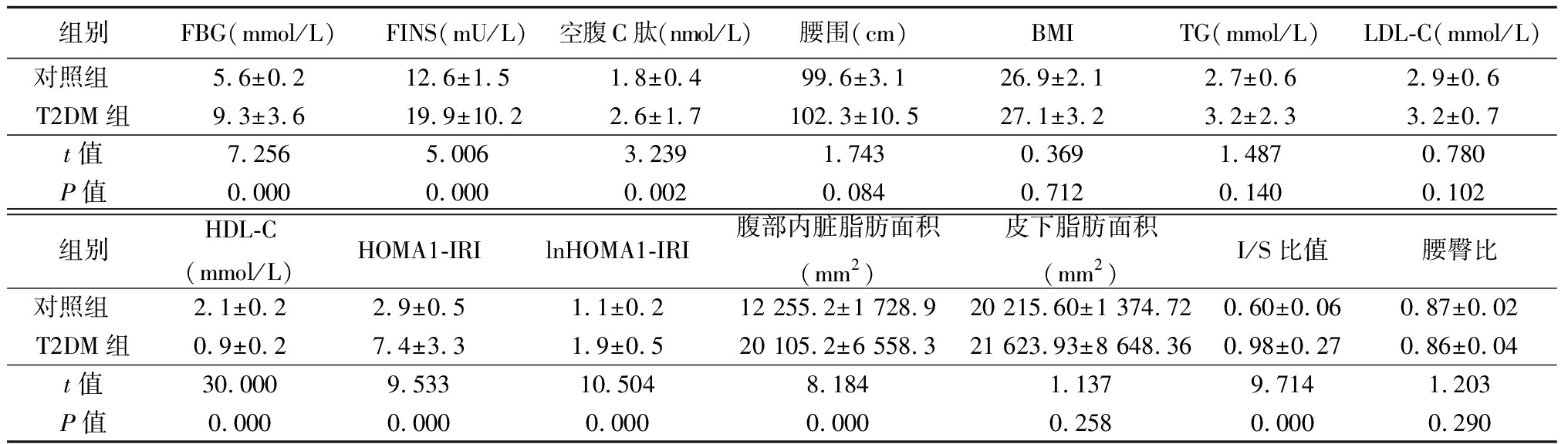
组别FBG(mmol/L)FINS(mU/L)空腹C肽(nmol/L)腰围(cm)BMITG(mmol/L)LDL-C(mmol/L)对照组 5.6±0.212.6±1.51.8±0.499.6±3.126.9±2.12.7±0.62.9±0.6T2DM组9.3±3.619.9±10.22.6±1.7102.3±10.527.1±3.23.2±2.33.2±0.7t值7.2565.0063.2391.7430.3691.4870.780P值0.0000.0000.0020.0840.7120.1400.102组别HDL-C(mmol/L)HOMA1-IRIlnHOMA1-IRI腹部内脏脂肪面积(mm2)皮下脂肪面积(mm2)I/S比值腰臀比对照组 2.1±0.22.9±0.51.1±0.212 255.2±1 728.920 215.60±1 374.720.60±0.060.87±0.02T2DM组0.9±0.27.4±3.31.9±0.520 105.2±6 558.321 623.93±8 648.360.98±0.270.86±0.04t值30.0009.53310.5048.1841.1379.7141.203P值0.0000.0000.0000.0000.2580.0000.290
2.2 相关性分析 lnHOMA1-IRI与FBG、FINS、空腹C肽、LDL-C、TG、腹部内脏脂肪面积、I/S比值、HOMA1-IRI呈正相关(P<0.05),与HDL-C呈负相关(P<0.05),与腰围、腰臀比、BMI、皮下脂肪面积无相关性(P>0.05)。见表2。
表2 lnHOMA1-IRI的相关性分析
Table 2 The correlation analysis of lnHOMA1-IRI
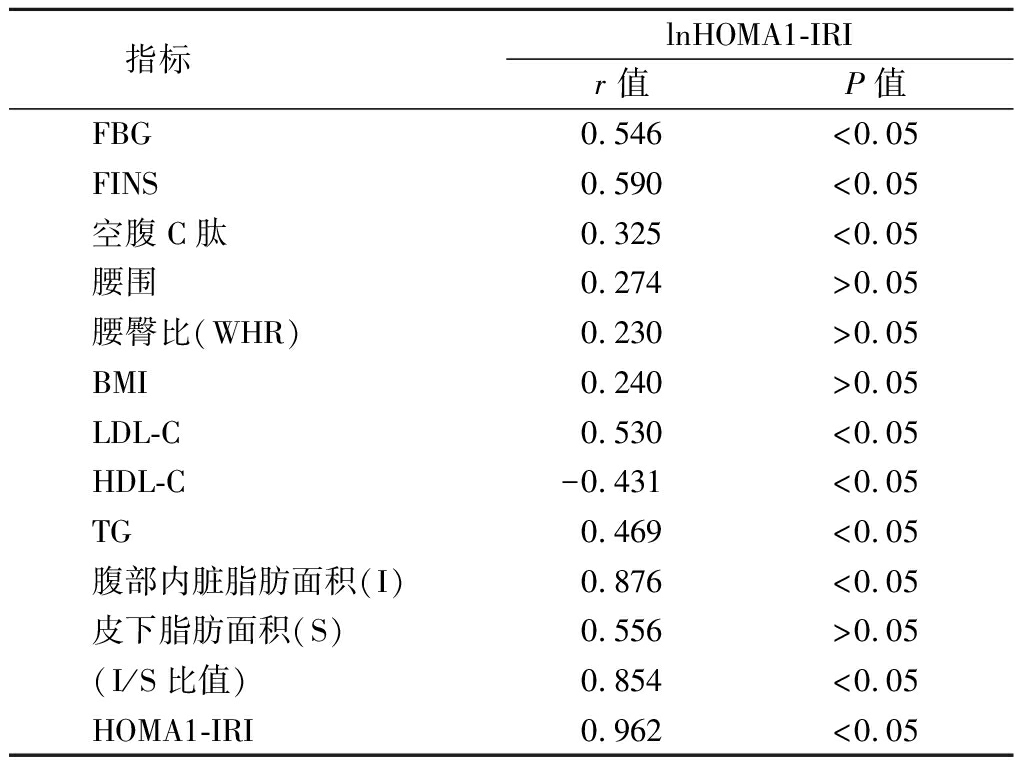
指标 lnHOMA1-IRIr 值P值FBG0.546<0.05FINS0.590<0.05空腹C肽0.325<0.05腰围0.274>0.05腰臀比(WHR)0.230>0.05BMI0.240>0.05LDL-C0.530<0.05HDL-C-0.431<0.05TG0.469<0.05腹部内脏脂肪面积(I)0.876<0.05皮下脂肪面积(S)0.556>0.05(I/S比值)0.854<0.05HOMA1-IRI0.962<0.05
3 讨 论
肥胖症是严重威胁、危害人类健康的疾病,1990—2015年,全球范围内高BMI导致肥胖症患者病死率增加了28.3%,肥胖导致了1.2亿人出现残疾[5]。腹型肥胖是代谢综合征或IR发生发展的关键因素和核心环节。近年来,研究发现肥胖与高胰岛素血症、IR、T2DM、代谢综合征、甲状腺轴功能轻度异常等发病密切相关[6-7],而且肥胖使高血压病、缺血性心脏病、脑血管疾病的发病风险增加[3]。本研究结果显示,T2DM组FBG、FINS、空腹C肽、HOMA1-IRI、lnHOMA1-IRI、腹部内脏脂肪面积、I/S比值高于对照组,HDL-C低于对照组,差异有统计学意义(P<0.05);2组腹围、BMI、TG、皮下脂肪面积差异无统计学意义(P>0.05)。表明以简易体脂参数作为衡量指标时,腹型肥胖程度相似的2型糖尿病患者与糖代谢正常的肥胖症人群,前者的腹部内脏脂肪堆积程度更严重,进一步证实腹部内脏脂肪增多与高胰岛素血症、IR、糖代谢异常关系密切,而以螺旋CT评估腹部内脏脂肪堆积程度时,合并T2DM的肥胖患者较血糖正常的肥胖患者的腹部内脏脂肪面积明显增多。因此,血糖升高与内脏脂肪堆积、IR加重、TG及游离脂肪酸增多造成胰岛细胞凋亡、胰岛功能下降有关。
本研究结果显示,如果以简易体脂参数作为衡量肥胖症的指标,结论为腹型肥胖程度相近的单纯肥胖症患者与肥胖症合并T2DM人群,如果以螺旋CT测量腹部内脏脂肪面积、皮下脂肪面积并计算二者比值作为衡量肥胖症的标准,结果发现其腹部内脏脂肪堆积程度不同,而腹部内脏脂肪堆积程度与糖耐量异常程度(即血糖水平)一致,即T2DM合并肥胖症的患者较单纯肥胖症患者的腹部内脏脂肪的比例增加。表明以螺旋CT测量腹部内脏脂肪面积、皮下脂肪面积及二者比值,比简易体脂参数衡量腹部内脏肥胖程度更准确。同时也说明,内脏脂肪比例增多较皮下脂肪比例增多的肥胖患者IR程度更严重,与国外研究结果一致[8]。
腹部脂肪包括腹部内脏脂肪和腹部皮下脂肪,腹部内脏脂肪和皮下脂肪比例不同即体脂分布不同,可导致IR程度不同。腹部内脏脂肪增多与高胰岛素血症、IR密切相关,是糖耐量减低和糖尿病的易患因素。腹部内脏脂肪增多释放过量的游离脂肪酸进入门静脉,游离脂肪酸能抑制磷酸果糖激酶活性和胰岛素信号转导,还能导致胰岛素受体下游信号转导受阻,使糖酵解和葡萄糖摄取受阻,引起IR[9]。脂肪组织分泌的多种细胞因子水平异常,如肥大增生的脂肪细胞可以分泌低水平的肿瘤坏死因子α,肿瘤坏死因子α能够刺激前脂肪细胞和内皮细胞产生单核细胞趋化蛋白,单核细胞趋化蛋白进一步吸引巨噬细胞包围脂肪组织,造成慢性炎症,从而导致IR[9]。糖皮质激素刺激腹部内脏脂肪堆积,腹部内脏脂肪中的糖皮质激素受体是皮下脂肪的4倍[10],肥胖患者β3肾上腺素能受体、过氧化酶体增殖物激活受体γ、解偶联蛋白、浆细胞膜糖蛋白1表达可出现异常,加重IR[9]。循环中过量的肿瘤坏死因子α通过胰岛素受体1的丝氨酸、酪氨酸磷酸化的双重机制,导致胰岛素受体1的降解并抑制胰岛素受体信号转导,从而导致IR[9]。胰岛素受体数目下调,腹部内脏脂肪增多患者体内脂肪细胞肥大、增生,组织细胞上胰岛素受体数目减少、活性减低,对胰岛素敏感性下降。受体后缺陷,腹部内脏脂肪增多患者细胞膜上的Ca2+APT酶活性减弱,内皮细胞内Ca2+增加、抑制胰岛素的作用,从而导致IR。肥胖症患者体内拮抗胰岛素作用的升糖激素活性增高[9] ,进一步加重高胰岛素血症,最终造成糖代谢紊乱,进展为糖尿病。IR是T2DM重要的发病机制,故IR已成为T2DM研究的热点,尤其是肥胖的T2DM患者。然而,评价肥胖的临床指标中哪些与IR程度相关目前尚无一致认识。
衡量腹型肥胖的常用指标有标准体重、腰围、臀围、腰臀比、BMI等简易体脂参数,然而上述评价指标各自存在其局限性。体重对体脂含量的判定,受性别、年龄、种族、骨骼类型、身高等因素的影响,故并不能准确评价体脂分布及腹部内脏脂肪。腰围测量不能除外胃肠等腹部内脏器官的影响,不能区分腹部脂肪与内脏,故不能准确地反映腹部内脏脂肪的严重程度。臀围测量不能除外肌肉组织的影响,也不能区分腹型肥胖。腰臀比、BMI在筛选腹部内脏型肥胖时可靠性及精确性较差。近年来兴起的生物阻抗分析、水下称重检测技术、双能X线吸收测量法、总体水法等体脂评价方法的准确性均有待于进一步研究。因此,探讨和分析内脏型肥胖与IR的关系,对内脏脂肪的测定方法提出了更高要求。近年来CT以其在测量人体腹部脂肪组织含量及分布的优势,被认为能较好地评价腹型肥胖及脂肪分布。通过划分兴趣区使用CT对纵隔、颊部、大腿脂肪组织面积进行测量,其2次测量结果的变异系数为0.38%~1.70%,表明通过划分兴趣区进行测量的可重复性较高。本研究通过CT对兴趣区脂肪面积和皮下脂肪面积进行精确测量,以二者比值来评价腹型肥胖与IR的关系。流行病学中HOMA1-IR是评价IR的常用指标。本研究采用Pearson相关分析结果显示,lnHOMA1-IRI与FBG、FINS、空腹C肽、LDL-C、TG、腹部内脏脂肪面积、I/S比值、HOMA1-IRI呈正相关(P<0.05),与HDL-C呈负相关(P<0.05)。其中与IR相关性最密切的是腹部内脏脂肪面积,说明通过CT测量腹部内脏脂肪面积、腹部皮下脂肪面积评价IR程度较简易体脂参数敏感,与国内外研究一致[11-12]。
IR与腹型肥胖关系密切,腹型肥胖患者与正常体脂分布的人群比较,与IR相关的糖尿病、心血管疾病、脂代谢异常等疾病发生风险增加。准确评价肥胖与IR的关系至关重要,本研究采用联合检测简易体脂参数、CT测量腹部内脏脂肪面积和皮下脂肪面积, 并用HOMA1-IRI公式,共同评价IR,更加科学、可靠。CT测量腹部内脏脂肪面积、皮下脂肪面积及其比值较简易体脂参数更能反映T2DM患者的IR程度。CT脂肪组织测量技术的应用范围已涉及临床营养学、老年医学、流行病学、遗传学, 特别是内分泌与代谢性疾病及心血管疾病等多种领域。肥胖症及其相关性疾病的发生机制和防治措施是内分泌领域的研究热点。干预并处理肥胖尤其是腹型肥胖是降低心脑血管疾病患病率和病死率的重要环节。一项在英国49个初级护理中心开展的开放、随机试验,评估了强化体重管理是否能实现T2DM的缓解,该研究纳入了20~66岁在过去6年内明确诊断为T2DM患者298例,干预组停用所有降糖、降压药物,坚持低热量配方饮食3~5个月,对照组采用国际糖尿病治疗指南中的最佳治疗方案,研究主要复合终点为体重下降≥15 kg、糖尿病缓解(停用降糖药物至少2个月后,糖化血红蛋白<6.5%),共随访12个月,结果显示干预组中大约半数患者退回到非糖尿病状态或者脱离了抗糖尿病药物[13]。表明强化体重管理对T2DM的缓解有益。Look AHEAD研究中糖化血红蛋白水平≥6.8%的T2DM患者(即血糖控制较差)以及糖化血红蛋白<6.8%的T2DM患者均能通过生活方式控制及减轻体重而避免心血管事件,但15%糖化血红蛋白控制良好的患者以及未认真进行健康报告的患者未显示出减重能带来其心血管事件的获益[14]。Look AHEAD研究的事后分析旨在探讨强化生活方式干预疗效的异质性问题,以及确认强化生活方式干预是否能有效改善T2DM患者的心血管事件及降低其心血管死亡风险,亚组分析发现,T2DM患者在以减重为目的的强化生活方式控制中可能获益[14]。
本研究局限性在于样本量少,应增加样本量和分层设计,进行深入研究,以便为存在代谢综合征的糖尿病患者的预防指明方向,改善内脏型肥胖是其治疗的潜在靶点[15]。
[1] NCD Risk Factor Collaboration(NCD-RisC).Trends in adult body-mass index in 200 countries from 1975 to 2014: a pooled analysis of 1698 population-based measurement studies with 19.2 million participants[J]. Lancet,2016,387(10026):1377-1396.
[2] Franssens BT,van der Graaf Y,Kappelle LJ,et al. Body weight,metabolic dysfunction,and risk of type 2 diabetes in patients at high risk for cardiovascular events or with manifest cardiovascular disease: a cohort study[J]. Diabetes Care,2015,38(10):1945-1951.
[3] Suto M,Tanaka H,Mochizuki Y,et al. Impact of overweight on left ventricular function in type 2 diabetes mellitus[J]. Cardiovasc Diabetol,2017,16(1):145.
[4] Gluvic Z,Zaric B,Resanovic I,et al. Link between metabolic syndrome and insulin resistance[J]. Curr Vasc Pharmacol,2017,15(1):30-39.
[5] Saklayen MG. The global epidemic of the metabolic syndrome[J]. Curr Hypertens Rep,2018,20(2):12.
[6] Angulo P. Nonalcoholic fatty liver disease[J]. N Engl J Med,2002,346(16):1221-1231.
[7] 龚敏,王爱华,李秀财.2型糖尿病合并肥胖患者的甲状腺轴微紊乱及其对胰岛素抵抗的影响[J].河北医科大学学报,2017,38(1):6-10.
[8] Matsuzawa Y,Funahashi T,Nakamura T. The concept of metabolic syndrome: contribution of visceral fat accumulation and its molecular mechanism[J]. J Atheroscler Thromb,2011,18(8):629-639.
[9] Capurso C,Capurso A. From excess adiposity to insulin resistance: the role of free fatty acids[J]. Vascul Pharmacol,2012,57(2/4):91-97.
[10] Pedersen SB,Kristensen K,Hermann PA,et al. Estrogen controls lipolysis by up-regulating alpha2A-adrenergic receptors directly in human adipose tissue through the estrogen receptor alpha. Implications for the female fat distribution[J]. J Clin Endocrinol Metab,2004,89(4):1869-1878.
[11] Barreira TV,Staiano AE,Harrington DM,et al. Anthropometric correlates of total body fat,abdominal adiposity,and cardiovascular disease risk factors in a biracial sample of men and women[J]. Mayo Clin Proc,2012,87(5):452-460.
[12] 王传海,王新江,田慧,等.老年人腹部脂肪(CT测量)分布与体质指数及代谢综合征的关系[J].中华医学杂志,2014,94(12):908-912.
[13] Lean ME,Leslie WS,Barnes AC,et al. Primary care-led weight management for remission of type 2 diabetes(DiRECT):an open-label,cluster-randomised trial[J]. Lancet,2018,391(10120):541-551.
[14] Baum A,Scarpa J,Bruzelius E,et al. Targeting weight loss interventions to reduce cardiovascular complications of type 2 diabetes: a machine learning-based post-hoc analysis of heterogeneous treatment effects in the Look AHEAD trial[J]. Lancet Diabetes Endocrinol,2017,5(10):808-815.
[15] Kishida K,Funahashi T,Matsuzawa Y,et al. Visceral adiposity as a target for the management of the metabolic syndrome[J]. Ann Med,2012,44(3):233-241.