内分泌系统主要包括下丘脑、垂体、甲状腺、甲状旁腺、胰岛、性腺、肾上腺等。内分泌系统功能异常可累及上述腺体引起疾病[1]。临床中致儿童矮小症病因较多,常见有生长激素缺乏症、生长激素神经分泌障碍、甲状腺功能减退、宫内发育迟缓、特发性矮小、性早熟、营养缺乏等,临床早期诊断并干预可促进患儿生长,改善患儿预后[2]。甲状腺功能减退症是儿童矮小症中常见的类型之一,指身高低于本民族、本地区、健康同性别同年龄儿童平均身高的2个标准差,且具有甲状腺功能减退症的患儿。甲状腺功能减退症是由于甲状腺激素合成、分泌或生物效应不足,所导致的以甲状腺功能减退为主要特征的疾病。发病始于胎儿或新生儿期,表现为生长和发育迟缓、智力障碍,称为呆小症[3]。此类患儿若不接受治疗,其最终成年身高和智力将低于平均水平,达到正常身高的机会较小,给患儿带来心理等方面的不良影响。研究指出,补充甲状腺激素可能会对矮小症起到一定的治疗作用。也有学者在小鼠等动物模型上进行实验发现甲状腺激素联合生长激素(growth hormone,GH)治疗矮小症能够在不影响小鼠寿命的同时发挥刺激生长的作用[4-5]。本研究在左甲状腺素片治疗甲状腺功能减退导致矮小症的基础上联合GH治疗,并通过严格的检测和随访分析,以期为矮小症的治疗提供新的理论依据。
1 资料与方法
1.1 一般资料 选择2011 年 11 月—2015 年 1 月河北省石家庄市第一医院内分泌科确诊为甲状腺功能减退导致的矮小症患儿 80 例。随机分为试验组和对照组各40 例。入院检查提示患儿身材矮小低于标准身高的2个标准差,且已明确诊断为原发性甲状腺功能减退症。2组性别、年龄、骨龄(bone age,BA)、生长速度(growth velocity,GV)、身高标准差积分(height standard deviation score,HtSDS)、预测成年身高(prediction of adultheight,PAH)等差异均无统计学意义(P>0.05),具有可比性,见表1。
本研究经医院伦理委员会审查通过,批准实施。
表1 2组治疗前各项指标比较
Table 1 Comparison of various indexes before treatment between two groups ![]()
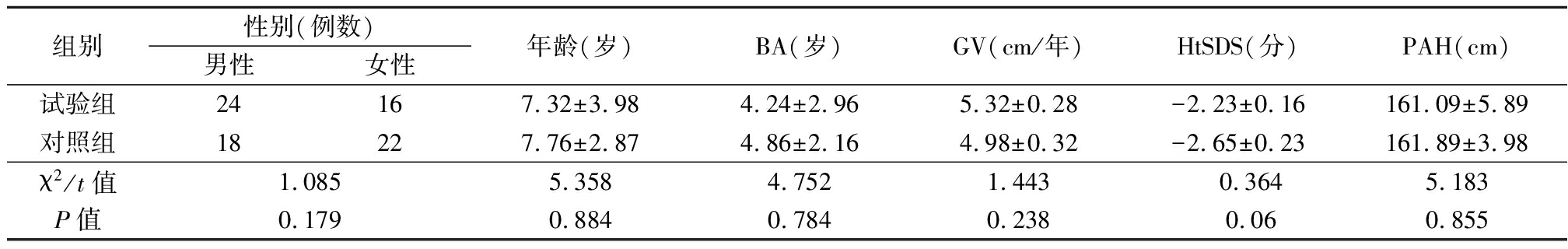
组别性别(例数)男性女性年龄(岁)BA(岁)GV(cm/年)HtSDS(分)PAH(cm)试验组24167.32±3.984.24±2.965.32±0.28-2.23±0.16161.09±5.89对照组18227.76±2.874.86±2.164.98±0.32-2.65±0.23161.89±3.98χ2/t值1.0855.3584.7521.443 0.3645.183P值0.1790.8840.7840.238 0.060.855
1.2 治疗方法 对照组给予左甲状腺素片50 μg(商品名:优甲乐,Merck Serono,H20140052),1次/d,首餐前服用,4周后根据复查甲状腺功能3项结果调整服用剂量,治疗时间为6个月。试验组在对照组给药的基础上,添加睡前1 h皮下注射GH 0.15 U/kg(4 U,长春金赛药业有限公司生产,国药准字s10980098),1次/d,同时给予定量的钙和赖氨肌醇维生素B12合剂,治疗时间6个月[2]。
1.3 观察指标 治疗前期对每位患儿进行至少3个月的身高测量记录,计算其自然GV、HtSDS数值,预测其成年身高;治疗后每月检测身高,计算治疗后的GV、HtSDS及PAH。比较治疗前和治疗后3个月、6个月GV、HtSDS、PAH的变化情况。观察治疗前和治疗后3个月、6个月BA和血清骨钙素(osteocalcin,OC)水平变化。
1.4 血液指标检测 GH激发试验采用胰岛素低血糖兴奋试验及左旋多巴兴奋试验。采集患儿治疗前和治疗后3个月、6个月空腹静脉血,采用化学发光免疫分析血清甲状腺激素水平变化。
1.5 统计学方法 应用SPSS 17.0软件分析数据。计量资料比较分别采用t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组治疗前后GV比较 2组治疗后GV均随时间逐渐升高,在治疗3个月时GV无显著差异,治疗6个月时试验组GV明显高于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表2。
表2 2组治疗前后GV比较
Table 2 Comparison of the GV before and after treatment between two groups ![]() 年)
年)
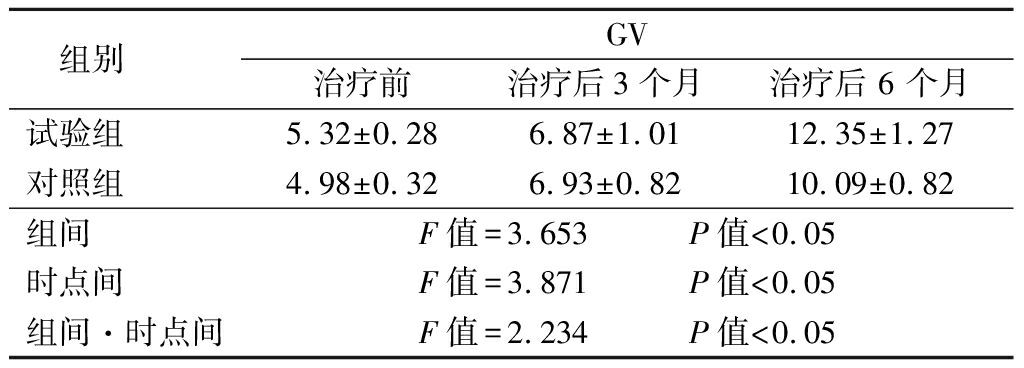
组别 GV治疗前 治疗后3个月 治疗后 6 个月试验组 5.32±0.286.87±1.0112.35±1.27对照组 4.98±0.326.93±0.8210.09±0.82组间 F值=3.653 P值<0.05时点间 F值=3.871 P值<0.05组间·时点间F值=2.234 P值<0.05
2.2 2组治疗前后HtSDS比较 2组治疗后HtSDS明显增加,治疗3个月时无显著差异,治疗6个月时试验组HtSDS明显高于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表3。
表3 2组治疗前后HtSDS比较
Table 3 Comparison of the HtSDS before and after treatment between two groups ![]() 分)
分)
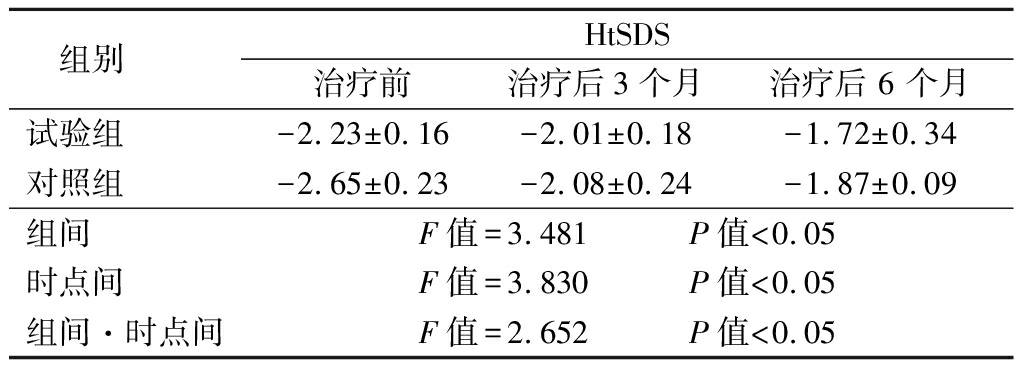
组别 HtSDS治疗前 治疗后3个月 治疗后 6 个月试验组 -2.23±0.16-2.01±0.18 -1.72±0.34 对照组 -2.65±0.23-2.08±0.24 -1.87±0.09 组间 F值=3.481 P值<0.05时点间 F值=3.830 P值<0.05组间·时点间F值=2.652 P值<0.05
2.3 2组治疗前后PAH比较 2组治疗后PAH明显增加,治疗3个月时2组无显著差异,治疗6个月时试验组PAH明显高于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表4。
表4 2组治疗前后PAH比较
Table 4 Comparison of the PAH obefore and after treatment between two groups ![]()
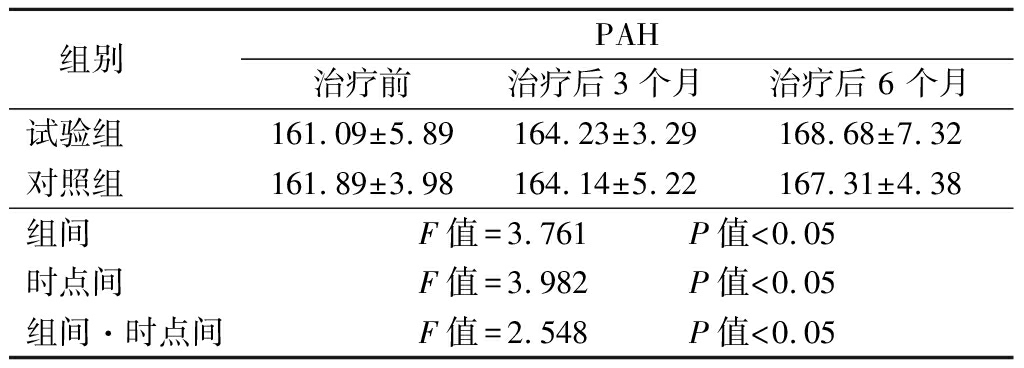
组别 PAH治疗前 治疗后3个月 治疗后 6 个月试验组 161.09±5.89164.23±3.29 168.68±7.32 对照组 161.89±3.98164.14±5.22 167.31±4.38 组间 F值=3.761 P值<0.05时点间 F值=3.982 P值<0.05组间·时点间F值=2.548 P值<0.05
2.4 2组治疗前后血清OC水平比较 2组治疗后OC水平均明显升高,治疗3个月时2组无显著差异,治疗6个月时试验组OC水平明显高于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表5。
表5 2组治疗前后血清OC水平比较
Table 5 Comparison of the OC before and after treatment between two groups ![]()
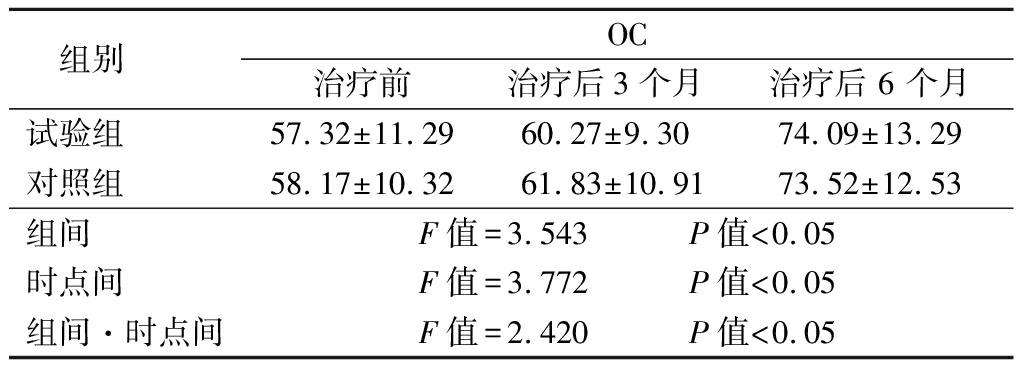
组别 OC治疗前 治疗后3个月 治疗后 6 个月试验组 57.32±11.2960.27±9.3074.09±13.29对照组 58.17±10.3261.83±10.9173.52±12.53组间 F值=3.543 P值<0.05时点间 F值=3.772 P值<0.05组间·时点间F值=2.420 P值<0.05
2.5 2组治疗前后BA比较 2组治疗后BA组间、时点间、组间·时点间交互作用差异均无统计学意义(P>0.05),见表6。
表6 2组治疗前后BA比较
Table 6 Comparison of the BA before and after treatment between two groups ![]() 岁)
岁)
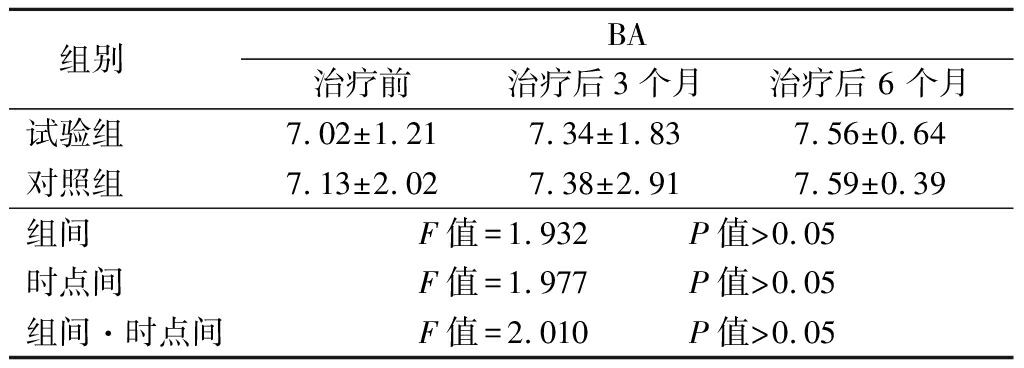
组别 BA治疗前 治疗后3个月 治疗后 6 个月试验组 7.02±1.217.34±1.837.56±0.64对照组 7.13±2.027.38±2.917.59±0.39组间 F值=1.932 P值>0.05时点间 F值=1.977 P值>0.05组间·时点间F值=2.010 P值>0.05
2.6 2组治疗前后T4比较 2组治疗后 3个月T4水平均明显升高,其时点间差异有统计学意义(P<0.05),而其组间、组间·时点间交互作用差异均无统计学意义(P>0.05),见表7。
表7 2组治疗前后T4比较
Table 7 Comparison of the T4 before and after treatment between two groups ![]()
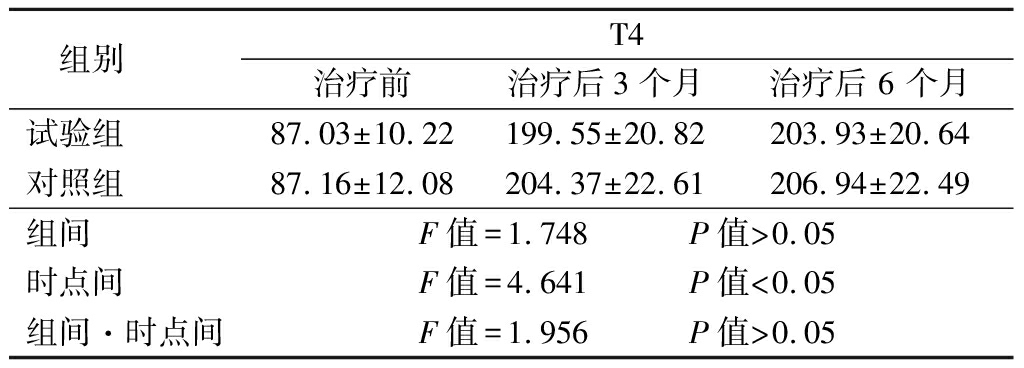
组别 T4治疗前 治疗后3个月 治疗后 6 个月试验组 87.03±10.22199.55±20.82203.93±20.64对照组 87.16±12.08204.37±22.61206.94±22.49组间 F值=1.748 P值>0.05时点间 F值=4.641 P值<0.05组间·时点间F值=1.956 P值>0.05
3 讨 论
根据原发性病因的不同,甲状腺功能减退症可以分为:①原发性甲状腺功能减退症,由甲状腺病变所致;②继发性甲状腺功能减退症,因垂体促甲状腺激素缺乏所致;③三发性甲状腺功能减退症,系下丘脑促甲状腺激素缺乏所致;④外周组织性甲状腺功能减退症,由甲状腺激素受体或受体后病变所致。不论是甲状腺本身功能减退还是下丘脑性、垂体性甲状腺功能减退症,用甲状腺激素治疗效果良好。除了抗甲状腺药物及甲状腺次全切除术引起的暂时性甲状腺功能减退症外,其他原因所致的甲状腺功能减退症均应长期服用甲状腺激素[6-7]。因此,采用甲状腺激素治疗甲状腺功能减退导致的矮小症效果确切。本研究针对甲状腺功能减退导致的矮小症患儿,在正常甲状腺激素治疗的基础上添加GH治疗以观察是否有更进一步的效果。
重组人生长激素(recombinant human growth hormone,rhGH)对矮小症儿童的促生长作用已经得到证实。rhGH治疗矮小症可以提高患儿的GV,而且对BA和儿童生长发育的进程影响较小。有研究指出,rhGH对矮小症的治疗效果明显,长期治疗后能够使患儿成年后接近成人正常身高[8]。但是rhGH的安全性一直是争论的焦点,其可能导致甲状腺功能减低、关节痛、乏力、水肿等不良反应。本研究结果显示,在甲状腺激素治疗的基础上添加rhGH治疗,可以更显著提高患儿的GV、HtSDS、PAH、OC和T4,但是对患儿的BA影响不大。有研究显示,用GH治疗幼年雄性侏儒小鼠可以显著增加体细胞生长,但严重削弱胰岛素敏感性、葡萄糖耐受性、细胞应激性和小鼠寿命,停用GH后,体细胞生长减慢,体重稳定在正常小鼠和未经处理的侏儒小鼠中间水平[9]。将GH和甲状腺激素联合用药后小鼠体细胞的GV明显增加,小鼠会向正常小鼠的生长趋势发展,但是小鼠的寿命不会受到影响[10-11]。因此,GH的使用可能会辅助甲状腺激素对矮小症的治疗,尤其是对于甲状腺功能减退导致的矮小症患儿。
本研究结果显示,左甲状腺素片联合GH治疗,与单纯甲状腺激素治疗相比,效果更好。
综上所述,左甲状腺素片联合rhGH用于治疗甲状腺功能减退导致的矮小症患儿,可以有效促进其身高的增长,提高其甲状腺激素水平。进一步的大样本量数据和更长期的随访研究正在进行中。
[1] Howell JC,Joshi SA,Hornung L,et al. Growth hormone improves short stature in children with Diamond-Blackfan anemia[J]. Pediatr Blood Cancer,2015,62(3):402-408.
[2] Do A,Menon V,Zh X,et al. Thyroxine modifies the effects of growth hormone in Ames dwarf mice[J]. Aging (Albany NY),2015,7(4): 241-255.
[3] Messina MF,Aversa T,Salzano G,et al. Early discrimination between transient and permanent congenital hypothyroidism in children with eutopic gland[J]. Hom Res Paediatr,2015,84(3):159-164.
[4] Darcy J,Bartke A. Functionally enhanced brown adipose tissue in Ames dwarf mice[J]. Adipocyte,2017,6(1):62-67.
[5] Ren S,Nie Y,Wang A. Effects of recombinant human growth hormone in the treatment of dwarfism and relationship between IGF-1,IGFBP-3 and thyroid hormone[J]. Exp Ther Med,2016,12(6):3579-3582.
[6] Darcy J,McFdden S,Fang Y,et al. Brown Adipose Tissue Function Is Enhanced in Long-Lived,Male Ames Dwarf Mice[J].Endocrinology,2016,157(12):4744-4753.
[7] Blasig S,Kühnen P,Schuette A,et al. Positive correlation of thyroid hormones and serum copper in children with congenital hypothyroidism[J]. J Trace Elem Med Biol, 2016,37:90-95.
[8] Wassner AJ,Brown RS. Congenital hypothyroidism: recent advances[J]. Curr Opin Endocrinol Diabetes Obes,2015,22(5):407-412.
[9] Silva PP,Bhatnagar S,Herman SD,et al.,Predictors of Hypopituitarism in Patients with Traumatic Brain Injury[J]. J Neurotrauma,2015,32(22):1789-1795.
[10] Hojat L,Schweiger M. 45,X/46,XY Mosaicism and Possible Association With Hypothyroidism in Males[J]. Clin Pediatr (Phila),2016,55(6):549-551.
[11] Shimatsu A,Ishii H,Nishinaga H,et al. Safety and effectiveness of long-term growth hormone therapy in Japanese patients with adult growth hormone deficiency: a postmarketing,multicenter,observational study[J].Endocr J,2017,64(7):651-662.