脓毒症是宿主对感染的免疫反应失调引起的危及生命的器官功能障碍,可发展为脓毒性休克。如何诊断和治疗严重脓毒症和脓毒性休克是重症医学科医生面对的重点研究课题[1]。对于脓毒症患者初期采取适当的治疗可能改善预后。内皮细胞功能紊乱及血管通透性增加导致的组织水肿是脓毒症重要病理生理改变。内皮细胞表面带负电荷的网状结构——多糖包被在这个过程中发挥重要作用,其对于维持内皮通透性、调节白细胞迁移及抑制血管内凝血作用扮演着重要角色[2-3]。严重的组织水肿是脓毒症患者血管通透性增加的表现,水肿的累积会损伤器官功能,增加氧弥散的距离和损伤微循环。当脓毒性休克患者进入恢复期时尿量明显增多,这不是巧合而是与血管壁功能恢复相吻合。但临床中有些脓毒症患者会发生明显的组织水肿,而另一些患者组织水肿却不明显,其中的原因是什么?与脓毒症的致病原因有关系吗?既然多糖包被与组织水肿有密不可分的关系,那么是否不同的致病因素导致的多糖包被损伤程度不同呢?本研究复制脂多糖(lipopolysaccharide,LPS)与盲肠结扎穿孔(cecal ligation and puncture,CLP)2种致病因素导致脓毒性休克兔模型,观察联合应用去甲肾上腺素给予相同剂量晶体液复苏后2种模型内皮多糖包被的变化,报告如下。
1 材料与方法
1.1 实验动物 雄性新西兰大白兔36只,体质量2.5~3.0 kg,由河北省实验动物中心提供,合格证号:SCXK(冀)2013-1-003。所有动物均饲养于我院动物中心,提供昼夜节律,避免环境应激。实验前12 h禁食水。本研究中动物处置方法符合动物伦理学标准。
1.2 主要试剂和设备 LPS(Sigma,美国),syndecan-1抗体(ABclonal,美国),全功能酶标仪(BioTek公司,美国),小型垂直电泳槽(BIO RAD,美国),UVP凝胶成像系统(BIO RAD美国),DM-IRBE倒置显微镜(Leica公司)
1.3 方法
1.3.1 LPS与CLP致脓毒症 休克兔模型的建立采用CLP方法复制CLP动物模型,采用兔耳缘静脉注射LPS 3 mg/kg制备LPS动物模型。当动物活动减少、蜷缩、精神萎靡、不思饮食,出现逐渐加重的呼吸困难、肢端发绀时,给予实验动物乌拉坦4 mg/kg麻醉,并迅速给予左颈动脉置管术、右颈内静脉置管术及气管切开术,当颈动脉插管监测平均动脉压<65 mmHg、颈动脉血气分析乳酸>3 mmol/L时制模成功。CLP对照组动物只探查腹腔找到盲肠后缝合。次日在对应的时间点处理同CLP组。LPS对照组兔耳缘静脉注射生理盐水5 mL,其他处理在对应的时间点同LPS组。
1.3.2 实验过程 实验兔子被随机分成6组,分别为LPS对照组、LPS组、LPS 30 mL组、CLP对照组、CLP组、CLP组30 mL组,每组6只,模型建立如上述。分别记录成模时间及2种脓毒症模型的数据:血常规白细胞计数,血气分析乳酸、中心静脉血氧饱和度(central venous blood oxygen saturation,ScVO2)及留取血培养。2种休克模型建立后LPS对照组、LPS组、CLP对照组与CLP组仅给予5 mL/h生理盐水维持液路,CLP 30 mL组与LPS 30 mL组则在模型建立后给予静脉泵入去甲肾上腺素和30 mL/kg速度输入生理盐水1 h,使平均动脉压≥75 mmHg以上,以后以5 mL/h生理盐水维持液路。分别于0,3,6 h采集血标本1 mL离心并留取上清液置于-80 ℃冰箱以备行酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测。活杀动物后立即留取肾组织置于-80 ℃冰箱和4%多聚甲醛溶液中以备行蛋白印迹法(Western blot)和免疫组织化学检测。
1.3.3 ELISA检测 测定各组0,3,6 h多糖包被标志物血浆syndecan-1浓度。
1.3.4 Western blot检测 肾组织中syndecan-1蛋白表达常规用RIPA裂解液提取总蛋白,采用BCA法测定蛋白浓度。等量蛋白(30 μg)进行SDS-PAGE电泳,转膜,以5%脱脂奶粉37 ℃封闭2 h,一抗4 ℃过夜,syndecan-1抗体浓度1∶1 000。TBST洗膜后以HPR标记的IgG二抗(1∶3 000)37 ℃封闭2 h,TBST洗膜后ECL化学发光成像。底片透扫后以ImageJ2X软件对条带进行定量分析,以目的条带与β-actin条带积分光密度比值代表目的蛋白的相对表达量。
1.3.5 免疫组织化学检测 肾皮质中syndecan-1蛋白的表达切片厚4 μm,常规脱蜡水化,采用高压修复方式暴露抗原,一抗为鼠抗兔syndecan-1(1∶100稀释),二抗为生物素化羊抗鼠IgG(1∶100稀释),以PBS代替一抗作阴性对照,DAB显色,光镜观察。结果判定:syndecan-1阳性信号定位于细胞质和细胞膜,为棕黄色颗粒。
1.4 统计学方法 应用SPSS 19.0统计软件处理数据。计量资料比较分别采用t检验、F检验、Dunnet-t检验及重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2种模型成模时间比较 CLP组制模时间(15.70±1.47) h,LPS组制模时间(2.30±0.87) h,CLP组制模时间长于LPS组,差异有统计学意义(t=19.216,P<0.05)。
2.2 血培养结果 CLP组、LPS组均可检出大肠埃希菌及少量革兰阳性球菌,CLP对照组、LPS对照组均为阴性。
2.3 各组白细胞计数、ScVO2和乳酸含量比较 LPS组和CLP组白细胞计数均明显低于LPS对照组和CLP对照组(P<0.05);LPS组和CLP组乳酸值均高于LPS对照组和CLP对照组(P<0.05);LPS组和CLP组ScVO2均低于LPS对照组和CLP对照组,LPS组高于CLP组,差异有统计学意义(P<0.05)。见表1。
表1 4组脓毒症模型相关指标比较
Table 1 Comparison of the various indexes among four groups ![]()
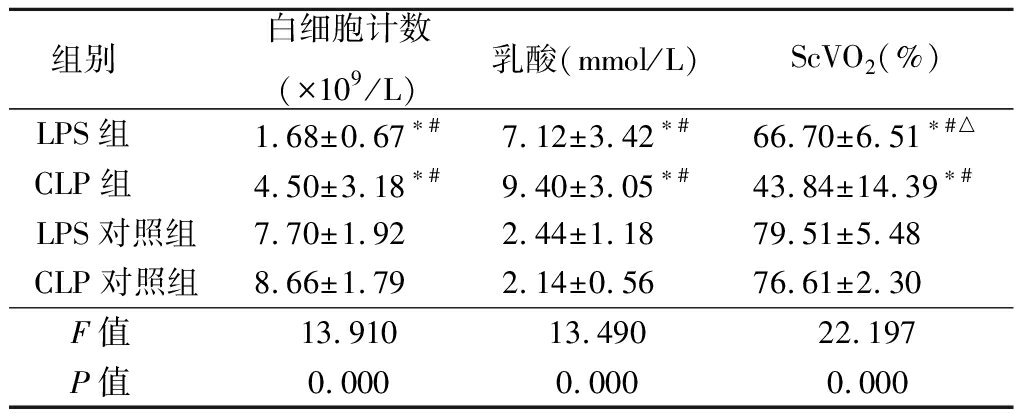
组别 白细胞计数(×109/L)乳酸(mmol/L)ScVO2(%)LPS组 1.68±0.67∗#7.12±3.42∗#66.70±6.51∗#△CLP组 4.50±3.18∗#9.40±3.05∗#43.84±14.39∗#LPS对照组7.70±1.922.44±1.1879.51±5.48CLP对照组8.66±1.792.14±0.5676.61±2.30F值 13.91013.49022.197P值 0.0000.0000.000
*P值<0.05与LPS对照组比较 #P值<0.05与CLP对照组比较 △P值<0.05 与CLP组比较(Dunnet-t检验)
2.4 各组血浆标志物比较 4组syndecan-1含量均随时间延长呈逐渐升高趋势,LPS组和CLP组升高幅度较大,而LPS 30 mL组和CLP 30 mL组升高幅度较小,4组在组间、时点间及组间·时点间交互作用差异均有统计学意义(P<0.05),见表2。
表2 4组不同时点血浆标志物比较
Table 2 Comparison of plasma markers at different time points among four groups ![]()
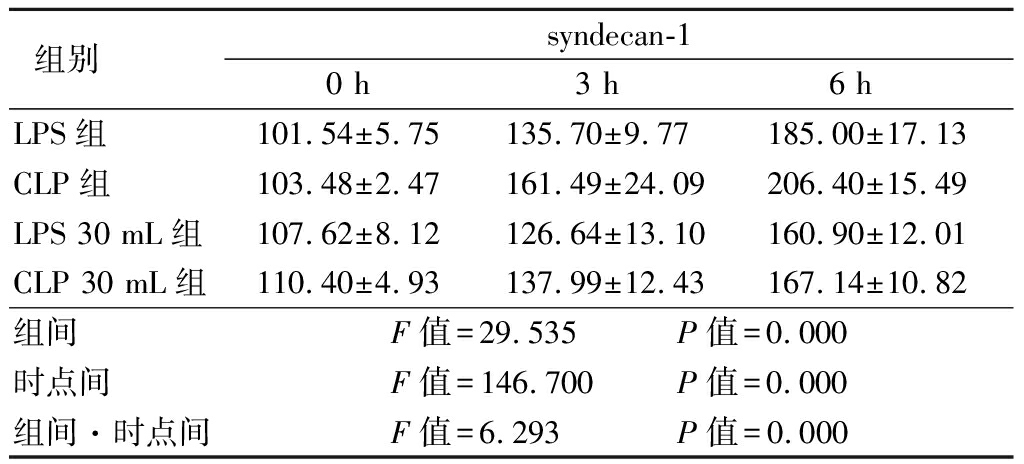
组别 syndecan-1 0 h 3 h 6 hLPS组 101.54±5.75135.70±9.77185.00±17.13CLP组 103.48±2.47161.49±24.09206.40±15.49LPS 30 mL组107.62±8.12126.64±13.10160.90±12.01CLP 30 mL组110.40±4.93137.99±12.43167.14±10.82组间 F值=29.535 P值=0.000时点间 F值=146.700 P值=0.000组间·时点间F值=6.293 P值=0.000
2.5 Western blot结果 在各组肾组织中syndecan-1表达由高到低顺序依次为LPS对照组、CLP对照组、LPS 30 mL组、CLP 30 mL组、LPS组、CLP组,差异有统计学意义(P<0.05),见图1,表3。
2.6 免疫组织化学结果 syndecan-1阳性信号主要定位肾血管内皮细胞和肾小球固有细胞的胞浆和(或)胞膜,呈棕黄色颗粒状。与正常对照组相比,LPS组与CLP组肾组织中syndecan-1表达显著降低,而经过液体复苏治疗后,syndecan-1蛋白表达不同程度上调,LPS 30 mL组升高程度大于CLP 30 mL组,见图2。
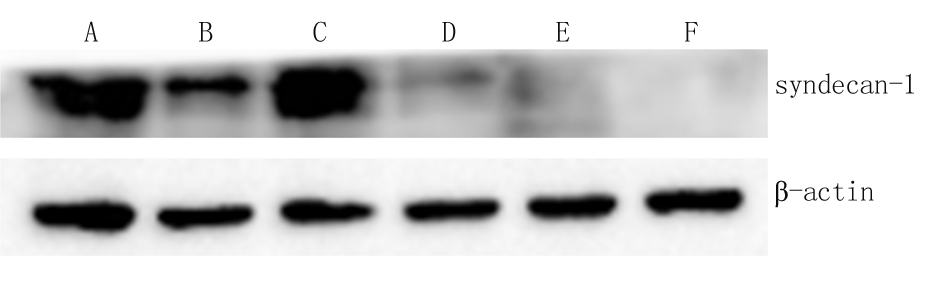
图1 Western blot检测各组肾组织中syndecan-1表达
A.LPS对照组;B.LPS 30 mL组;C.CLP对照组;D.CLP 30 mL组;E.LPS组;F.CLP组
Figure 1 Expression of syndecan-1 in renal tissue of each group by Western blot
表3 各组肾组织中syndecan-1表达比较
Table 3 Comparison of syndecan-1 expression in kidney tissues of each group ![]()
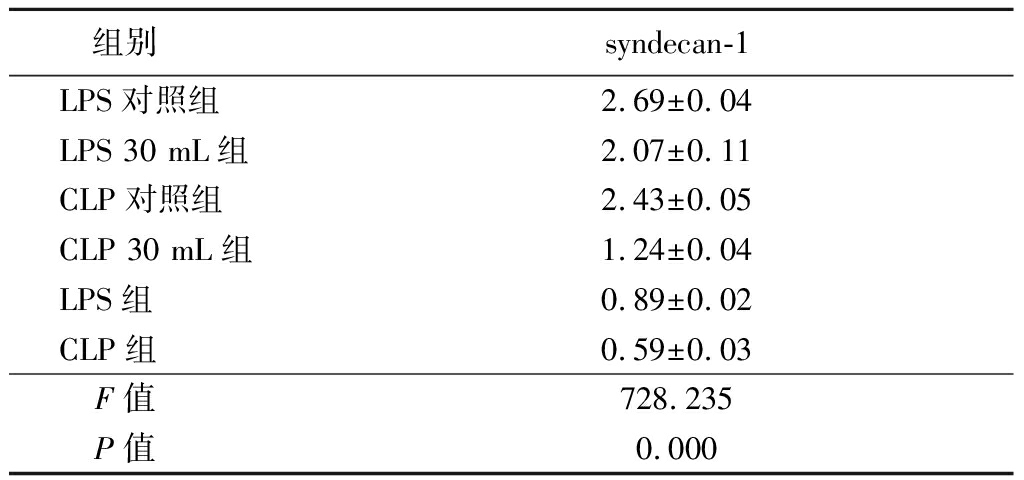
组别 syndecan-1LPS对照组2.69±0.04LPS 30 mL组2.07±0.11CLP对照组2.43±0.05CLP 30 mL组1.24±0.04LPS组0.89±0.02CLP组0.59±0.03F值 728.235P值 0.000
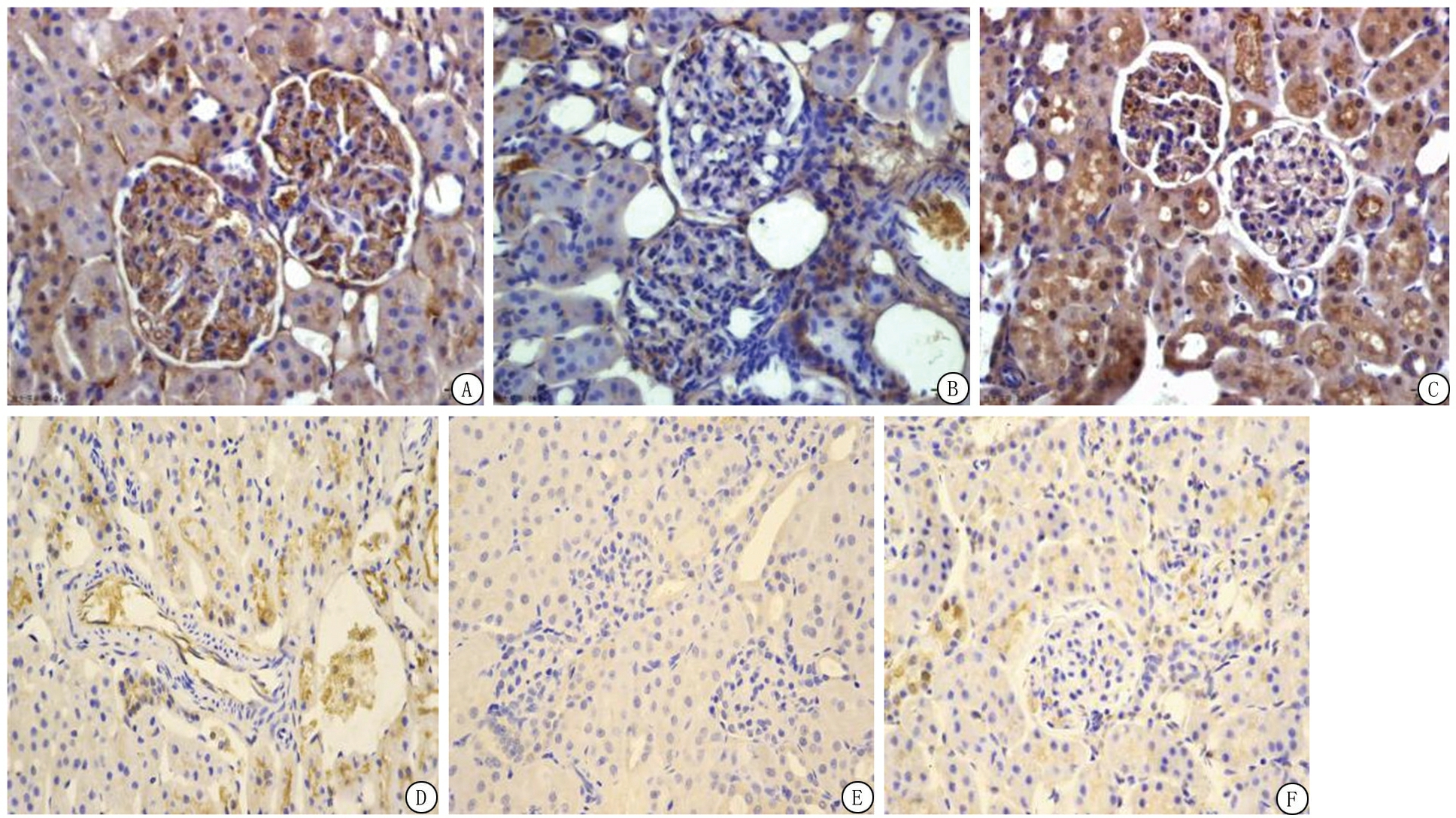
图2 免疫组织化学检测肾组织中syndecan-1表达
A.CLP对照组;B.CLP组;C.CLP 30 mL组;D.LPS对照组;E.LPS组;F.LPS 30 mL组
Figure 2 Expression of syndecan-1 in renal tissue of each group by immunohistochemical
3 讨 论
多糖包被是血管与组织间的界面,它不仅在血液和组织间液体维持平衡的过程中起到了屏障作用[4],而且在调节微循环血流变、信号传导、血管保护方面扮演重要角色。应用活体显微镜技术可以清楚地显示多糖包被的厚度,为400~500 nm,明显超过体外固定或体外培养的尺寸。由于这层像胶冻样结构的发现使得经典的Starling′s 机制得以修改[5]。很多病理生理过程实际上均与多糖包被的结构和功能紊乱有关。有大量的证据表明缺血再灌注损伤[6]、脓毒症和炎症[7-10]、肾脏疾病[11]、严重创伤[12]、糖尿病血管损伤及动脉粥样硬化等均与多糖包被功能有密切联系。在脓毒症器官衰竭的进程中内皮细胞功能紊乱及多糖包被受损被认为是中心环节。脓毒症导致多糖包被发生独特的功能紊乱及内皮通透性改变,从而引发低血容量、低蛋白血症及水肿[9]。
在重症感染中,血管通透性的异常增高是一个重要特征。如果血管内皮多糖包被完整性遭到破坏,无论血浆胶体渗透压如何,均将发生血管渗漏。在严重感染的过程中,炎症介质导致金属基质蛋白酶的活化,从而使得内皮多糖包被脱落造成屏障功能的缺失,破坏了细胞间的紧密连接[13]。这种脓毒症相关的内皮细胞损伤导致的通透性增加引发了一系列的级联反应,并导致了灾难性的后果。在这个过程中多糖包被的损伤可能引发包括急性肾损伤、呼吸衰竭及脓毒症心肌抑制等多系统器官损伤[14]。而循环中syndecan-1与heparan sulfate的浓度水平与多糖包被的损伤相联系[15]。近期有研究显示脓毒症第一个24 h的syndecan-1的血浆浓度增加与液体治疗和器官衰竭密切相关[16]。本研究旨在探讨不同的致病因素导致脓毒性休克的内皮多糖包被改变是否相同,结果显示2种休克模型血浆标志物syndecan-1浓度均较对照组明显升高(P<0.05);LPS组均值低于CLP组,且各组均值随着时间而升高;经过早期相同剂量液体复苏后,LPS 30 mL组较CLP 30 mL组血浆syndecan-1浓度低。这说明CLP 30 mL组多糖包被的脱落更明显,导致其血浆浓度较LPS 30 mL组血浆浓度高。
本研究进一步行肾组织的免疫组织化学检测显示,无论是对照组、脓毒症组,还是液体干预组,均表现为LPS组较CLP组syndecan-1的表达增高,且本研究在Western blot检测中得到了同样的结果,即在各组模型肾组织中syndecan-1表达由高到低顺序依次为LPS对照组、CLP对照组、LPS 30 mL组、CLP 30 mL组、LPS组、CLP组。这个结果可能代表2种原因导致的脓毒性休克虽然临床表现及临床组织灌注指标(本研究中LPS组与CLP组白细胞计数和乳酸指标差异均无统计学意义)未见明显差异,但在特殊蛋白表达水平层面仍是有区别的。因此,这可能直接影响到对治疗的不同反应和最终的预后。
有研究表明,在革兰阳性球菌感染的脓毒性休克动物中多糖包被的脱落是机体的防御反应,syndecan-1可以保护宿主压制T细胞介导的炎症风暴和组织损伤的扩大,而syndecan-1缺失的动物更容易发生严重的病生理反应,这很有可能导致机体发生更猛烈的炎症风暴[17]。但也有研究并不完全支持上述观点[18]。本研究结果显示,在脓毒性休克早期及时给予液体复苏可以减轻多糖包被的脱落,从而达到保护内皮功能的作用,减轻一系列瀑布样反应。
总之,在实际工作中,同是诊治脓毒性休克患者,转归截然不同的原因也许与致病因素的差别导致的微循环改变不同有关。本研究结果显示,在脓毒性休克动物中,不同的制模方式虽然在临床数据中无明显差别,但是从微观观察表现是不同的,一些标志性蛋白的表达不同,液体复苏对其影响也不同。这提示临床医生对于疾病的治疗,准确把握病因至关重要。本研究样本量较小,是对多糖包被具体变化及影响机制的初步观察和探讨,有待进一步的深入探究。
[1] 武新慧,胡振杰.中国严重脓毒症/脓毒性休克治疗指南(2014)、重症血流动力学治疗(北京共识)——重症医生的左膀右臂[J].河北医科大学学报,2016,37(12):1478-1481.
[2] Woodcock TE,Woodcock TM.Revised Starling equation and the glycocalyx model of transvascular fluid exchange:an improved paradigm for prescribing intravenous fluid therapy [J]. Br J Anaesth,2012,108(3):384-394.
[3] Lipowsky HH,Lescanic A. Inhibition of inflammation induced shedding of the endothelial glycocalyx with low molecular weight heparin [J]. Microvasc Res,2017,112:72-78.
[4] Chelazzi C,Villa G,Mancinelli P,et al. Glycocalyx and sepsis-induced alterations in vascular permeability[J]. Crit Care,2015,19:26.
[5] Pillinger NL,Kam P. Endothelial glycocalyx:basic science and clinical implications [J]. Anaesth Intensive Care,2017,45(3):295-307.
[6] Song JW,Goligorsky MS. Perioperative implication of the endothelial glycocalyx [J]. Korean J Anesthesiol,2018,71(2):92-102.
[7] Song JW,Zullo J,Lipphardt M,et al. Endothelial glycocalyx-the battleground for complications of sepsis and kidney injury [J]. Nephrol Dial Transplant,2018,33(2):203-211.
[8] Ostrowski SR,Berg RM,Windelov NA,et al. Coagulopathy,catecholamines,and biomarkers of endothelial damage in experimental human endotoxemia and in patients with severe sepsis:a prospective study [J]. J Crit Care,2013,28(5):586-596.
[9] Smart L,Bosio E,Macdonald SPJ,et al. Glycocalyx biomarker syndecan-1 is a stronger predictor of respiratory failure in patients with sepsis due to pneumonia,compared to endocan[J]. J Crit Care,2018,47:93-98.
[10] Song JW,Zullo JA,Liveris D,et al. Therapeutic Restoration of Endothelial Glycocalyx in Sepsis [J]. J Pharmacol Exp Ther,2017,361(1):115-121.
[11] Padberg JS,Wiesinger A,di Marco GS,et al. Damage of the endothelial glycocalyx in chronic kidney disease [J]. Atherosclerosis,2014,234(2):335-343.
[12] Johansson PI,Stensballe J,Rasmussen LS,et al. A high admission syndecan-1 level,a marker of endothelial glycocalyx degradation,is associated with inflammation,protein C depletion,fibrinolysis,and increased mortality in trauma patients [J]. Ann Surg,2011,254(2):194-200.
[13] Nelson A,Berkestedt I,Bodelsson M. Circulating glycosaminoglycan species in septic shock [J].Acta Anaesthesiol Scand,2014,58(1):36-43.
[14] Martin L,Koczera P,Zechendorf E,et a1. The Endothelial Glycocalyx:New Diagnostic and Therapeutic Approaches in Sepsis [J]. Biomed Res Int,2016,2016:3758278.
[15] Torres Filho IP,Torres LN,Salgado C,et al. Plasma syndecan-1 and heparan sulfate correlate with microvascular glycocalyx degradation in hemorrhaged rats after different resuscitation fluids[J]. Am J Physiol Heart Circ Physiol,2016,310(11):H1468-1478.
[16] Smart L,Macdonald SPJ,Burrows S,et al. Endothelial glycocalyx biomarkers increase in patients with infection during Emergency Department treatment [J]. J Crit Care,2017,42:304-309.
[17] Hayashida K,Chen Y,Bartlett AH,et al.Syndecan-1 is an in vivo suppressor of Gram-positive toxic shock[J]. J Biol Chem,2008,283(29):19895-19903.
[18] Kowalewska PM,Patrick AL,Fox-Robichaud AE. Syndecan-1 in the mouse parietal peritoneum microcirculation in inflammation [J]. PLoS One,2014,9(9):e104537.