胆管癌是发生于胆管上皮细胞的一种恶性肿瘤,分为肝内和肝外胆管细胞癌2种,由于解剖关系复杂,缺乏特异性标记物,早期发现困难,易向周围组织横向浸润转移和沿胆管纵向跳跃式转移,往往伴发严重梗阻性黄疸,患者耐受性差,根治手术难度大,术后易出现肝衰竭,综合治疗效果不理想,5年生存率不足40%,是严重影响人民生命健康的一种消化道恶性肿瘤,发病率逐年增高[1]。故研究影响胆管癌侵袭转移相关因素尤为重要。生长停滞特异性基因6(growth arrest specific-6,Gas6)由生长停滞特异性基因编码组成,属于生长停滞特异性基因家族成员,是维生素K依赖性的生长促进因子之一,具有细胞因子一样的功能。与相应配体Axl结合后,通过特定的信号传导通路参与肿瘤的凋亡、分化、转移、血管形成等过程[2]。基质金属蛋白酶9(matrix metallo proteinase-9,MMP-9)是一种明胶酶,可以降解以Ⅳ型胶原为主的基底膜和细胞外基质,促进肿瘤细胞穿越基底膜进入周围组织,在肿瘤生长第一阶段发挥着重要作用[3-4]。Gas6与MMP-9在恶性肿瘤患者血清中均可检测到并发挥着重要的作用[5-6]。目前,Gas6与MMP-9在胆管癌中的表达研究尚未见报道。本研究采用免疫组织化学技术检测Gas6与MMP-9在胆管癌及癌旁组织中的表达情况,以期了解Gas6是否通过MMP-9途径发挥促进胆管癌浸润转移的作用,旨在为胆管癌的治疗寻找新的特异性靶点,报告如下。
1 资料与方法
1.1 一般资料 选取2011年9月—2016年7月于河北省定州市人民医院肝胆外科手术切除且病理证实为胆管癌组织石蜡标本和癌旁胆管蜡块组织(病理均证实为非癌组织)。入选标准:①临床资料完整且术前均未进行放化疗;②未合并其他肿瘤;③由2位主治病理医师共同阅片确定。胆管癌组60例,男性39例,女性21例,年龄40~75岁,平均(50.0±6.5)岁,≥50岁者39例,<50岁者21例;肿瘤直径 0.8~ 2.0 cm,平均(1.4±0.4)cm,≥2 cm者24例,<2 cm者36例;发生淋巴结转移23例,出现门静脉和(或)肝动脉受侵19例;高分化24例,中分化12例,低分化24例。对照组17例中,男性10例,女性7例,年龄 35~82 岁,平均(52.0±9.7)岁。
1.2 试剂 浓缩型兔抗人Gas6多克隆抗体、浓缩型兔抗人MMP-9多克隆抗体为英国Abcam公司产品。兔SP检测试剂盒、DAB显色试剂盒、辣根过氧化物酶标记的羊抗兔IgG二抗均购自北京中杉金桥生物技术有限公司。
1.3 方法 采用免疫组织化学(SP)法染色检测标本中Gas6 和MMP-9蛋白的表达,操作步骤严格按照试剂盒操作说明进行。用组织切片机将石蜡包埋组织连续切片,切片厚度约4 μm。石蜡切片经过脱蜡、水化后进行高压修复5 min,3%过氧化氢溶液室温孵育10 min,消除内源性过氧化物酶活性,冲洗,山羊血清封闭减少非特异性着色,室温放置30 min后滴加兔抗人Gas6多抗(工作液浓度为1∶150,由PBS液稀释),兔抗人MMP-9多抗(工作液浓度为1∶200由PBS液稀释)。湿盒内4 ℃过夜。PBS液冲洗,滴加二抗,常温反应15 min。DAB显色,苏木素复染,脱水,二甲苯透明,封固。用PBS替代一抗为阴性对照,已知阳性片作对照,出现棕黄色颗粒为阳性表达。
1.4 结果判断 Gas6蛋白染色在胞浆及胞核中出现棕黄色颗粒为阳性, MMP-9蛋白染色在胞浆中出现棕黄色颗粒为阳性。采用半定量积分分级分析阅片结果,包括染色强度和阳性细胞计数。染色强度标准:0分呈现无染色;1分呈现浅黄色;2分呈现棕黄色;3分呈现棕褐色;4分呈现极强染色。光镜下选取10个高倍视野,分别计数100个细胞,计算阳性细胞百分数。阳性细胞百分比评分:0分为阳性细胞≤5%;1分为阳性细胞6%~25%;2分为阳性细胞26%~50%;3分为阳性细胞51%~75%;4分为阳性细胞>76%。采用H-Score评分系统进行结果判定,阳性细胞数和阳性细胞百分比2项积分相乘,评分<4分为阴性(-),评分≥4分为阳性(+)。
1.5 统计学方法 应用SPSS 20.0统计软件包分析数据。计数资料比较采用χ2检验;相关性采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Gas6及MMP-9在胆管癌组织及癌旁组织中的表达 胆管癌60例中Gas6蛋白表达阳性43例(71.7%),对照组17例中Gas6蛋白表达阳性5例(29.4%),胆管癌组织中Gas6蛋白阳性表达率明显高于对照组,差异有统计学意义(χ2=10.074,P=0.001)。胆管癌60例中MMP-9蛋白表达阳性40例(66.7%),对照组17例中MMP-9蛋白表达阳性6例(35.3%),胆管癌组织中MMP-9蛋白阳性表达率明显高于对照组,差异有统计学意义(χ2=5.420,P=0.012)。见图1,2。
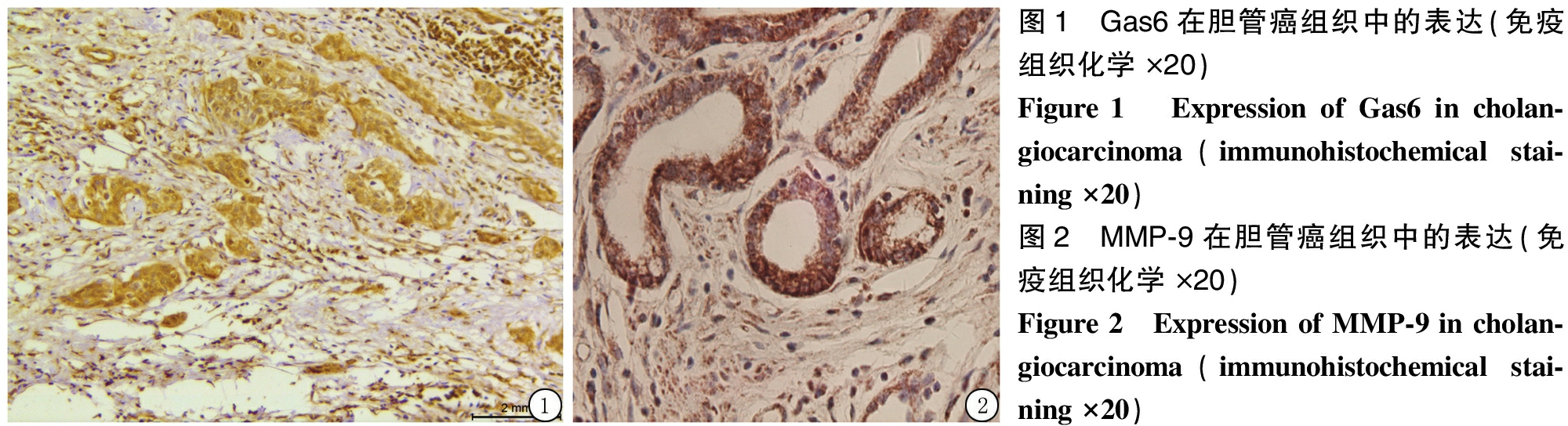
2.2 不同临床参数胆管癌患者Gas6、MMP-9蛋白表达情况比较 发生淋巴结转移患者Gas6、MMP-9蛋白阳性表达率明显高于无淋巴结转移患者,有肝动脉/门静脉受侵患者Gas6、MMP-9蛋白阳性表达率明显高于无肝动脉/门静脉受侵患者,差异均有统计学意义(P<0.05);不同年龄、肿瘤直径、组织学分级Gas6、MMP-9蛋白阳性表达率差异均无统计学意义(P>0.05)。见表1。
表1 不同临床参数胆管癌患者Gas6、MMP-9蛋白阳性表达率比较
Table 1 Comparison of positive expression rates of Gas6 and MMP-9 proteins in patients with different clinical parameters of cholangiocarcinoma (例数,%)
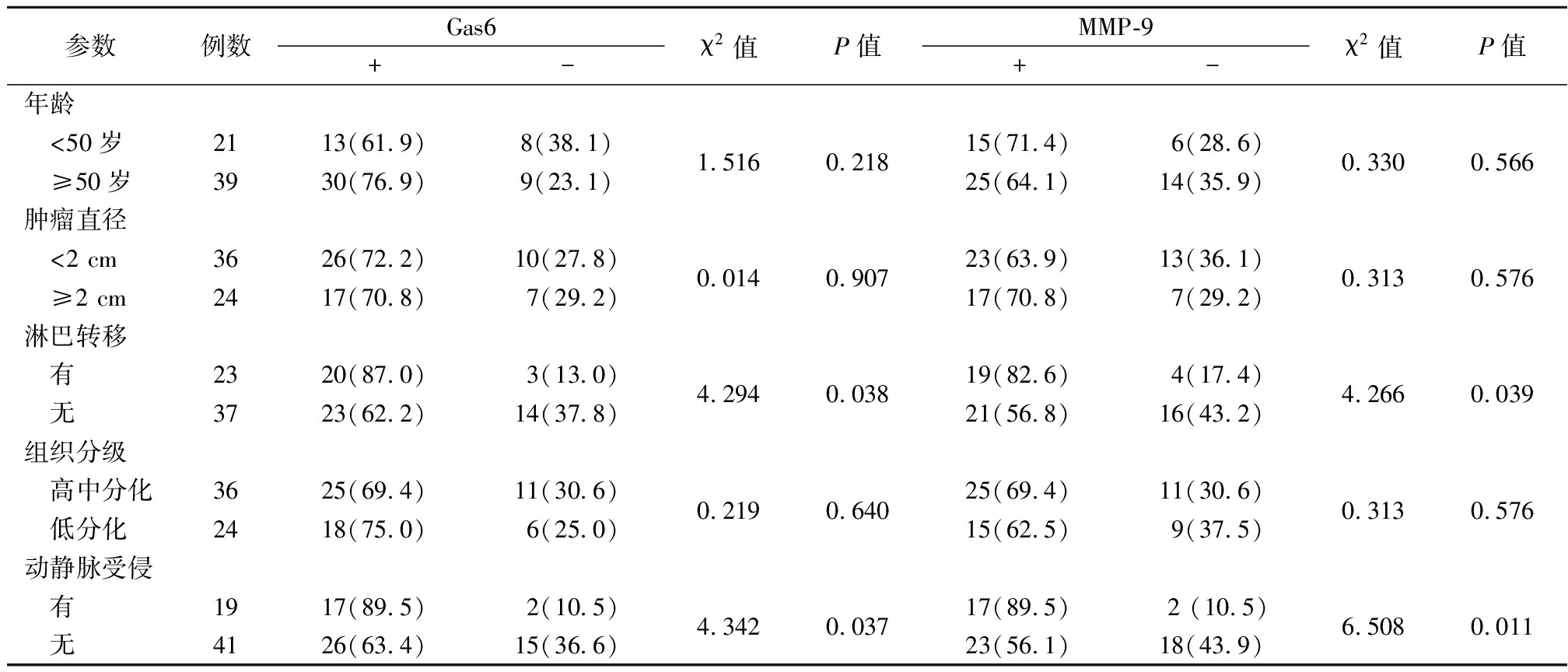
参数例数Gas6+-χ2值P值MMP-9+-χ2值P值年龄 <50岁 ≥50岁213913(61.9)30(76.9)8(38.1)9(23.1)1.5160.21815(71.4)25(64.1)6(28.6)14(35.9)0.3300.566肿瘤直径 <2 cm ≥2 cm362426(72.2)17(70.8)10(27.8)7(29.2)0.0140.90723(63.9)17(70.8)13(36.1)7(29.2)0.3130.576淋巴转移 有 无233720(87.0)23(62.2)3(13.0)14(37.8)4.2940.03819(82.6)21(56.8)4(17.4)16(43.2)4.2660.039组织分级 高中分化 低分化362425(69.4)18(75.0)11(30.6)6(25.0)0.2190.64025(69.4)15(62.5)11(30.6)9(37.5)0.3130.576动静脉受侵 有 无194117(89.5)26(63.4)2(10.5)15(36.6)4.3420.03717(89.5)23(56.1)2 (10.5)18(43.9)6.5080.011
2.3 Gas6与MMP-9蛋白在胆管癌组织中表达的相关性分析 Spearman等级相关性分析显示,胆管癌组织中Gas6与MMP-9蛋白表达呈正相关关系(rs=0.497,P=0.001),见表2。
表2 Gas6与MMP-9蛋白在胆管癌组织中表达的
相关性分析
Table 2 Correlation between Gas6 and MMP-9 protein expression in cholangiocarcinoma tissue (例数)

MMP-9Gas6+-合计rs值P值+-35851240200.4970.001合计431760
3 讨 论
肿瘤往往是原癌基因激活和抑癌基因失活所造成的多基因相互作用的结果。胆管癌是起源于肝外胆道从肝门区到胆管下端的恶性肿瘤,发病率呈逐年升高的趋势。好发年龄为50~70岁,男性多于女性,占全身恶性肿瘤的2%,肝内外胆道肿瘤的60%。早期发现率低,易侵袭周围组织器官,发生肝转移,各种治疗效果不满意,需要寻找新的治疗思路以提高疗效。
Gas6是由678个氨基酸组成的一个多功能域构架蛋白,属于维生素K依赖的分泌蛋白,相对分子质量为75 000,由羧基端、氨基端和表皮生长因子样重复区三部分组成,是受体络氨酸激酶亚家族TAM受体的配体。Gas6广泛表达于人体多种组织器官。研究发现,Gas6与TAM家族成员之一的Axl相结合,能够调节细胞的凋亡、黏附、增殖等多种功能,并通过PI3K/Akt、丝裂原活化蛋白激酶、STAT1等多种信号途径影响肿瘤细胞的增殖、凋亡、迁移、血管形成[7-9]。由于作用广泛,目前已成为肿瘤治疗研究的热点基因。有望成为肿瘤标记物提高肿瘤的诊断率,为肿瘤治疗提供新的方向。同时还发现Gas6在前列腺癌、肺腺癌、骨肉瘤、宫颈鳞癌、卵巢癌等[10-12]中高表达,并且与肿瘤的淋巴结转移和局部浸润密切相关。本研究结果显示,胆管癌组织中Gas6蛋白阳性表达率显著高于癌旁组织,说明Gas6在胆管癌的发生当中可能发挥了重要的作用;另外,有淋巴结转移和有肝动脉或门静脉受侵胆管癌患者Gas6蛋白阳性表达率明显高于无淋巴结转移和无肝动脉或门静脉受侵患者,提示Gas6在胆管癌的侵袭转移中发挥重要促进作用,与国外Martinelli等[8]对结肠癌和国内张明帅等[13]对Gas6在乳腺癌中的研究结果相一致,证实Gas6高表达促进了胆管癌的局部进展,表明Gas6可以作为反映胆管癌恶性程度的指标之一。
MMPs属于锌离子依赖性内肽酶,能够水解细胞外基质,其中MMP-9是MMPs中发挥降解基底膜重要的蛋白酶之一,属于明胶酶的一种,能够降解基底膜和细胞外基质成分,包括各种胶原和明胶,促进肿瘤的转移浸润及血管形成,在肿瘤的早期形成阶段发挥着重要作用,能够促进肿瘤向周围浸润转移或发生血道和淋巴转移。临床和基础研究发现,MMP-9在多种实性恶性肿瘤中高表达促进了肿瘤的转移过程,MMP-9蛋白过表达与肿瘤的淋巴结转移脉管浸润密切相关,在胆汁中的含量明显高于良性组,对胆管癌具有很好的诊断价值[5]。本研究结果显示,胆管癌组织中MMP-9蛋白阳性表达率明显高于癌旁组织,说明MMP-9在胆管癌的发生当中可能发挥一定的作用;同时,有淋巴结转移和有肝动脉或门静脉受侵胆管癌患者中MMP-9蛋白阳性表达率明显高于无淋巴结转移和无肝动脉或门静脉受侵患者,表明MMP-9对胆管癌的局部浸润转移起着重要的促进作用,与国内张静怡等[14]在胃癌的相关研究结论类似。胰腺癌细胞研究也证实罗格列酮通过活化过氧化物酶体增殖物激活受体减少MMP-9,明显抑制胰腺癌细胞侵袭和转移,表明通过/PTEN/MMP-9信号途径,下调MMP-9蛋白的表达,能够抑制胰腺癌细胞株PANC-1的侵袭和转移,说明MMP-9高表达促进了胆管癌的局部进展,提示MMP-9可以作为反映胆管癌恶性程度的指标。
肿瘤的发生是多基因、多信号通路、多级调控的过程。本研究结果显示,胆管癌组织中Gas6与MMP-9蛋白表达呈正相关(rs=0.497,P=0.001),35例Gas6与MMP-9共同表达阳性的患者,发生淋巴结转移和发生肝动脉或门静脉受侵的概率也相应增加,说明Gas6和MMP-9在促进胆管癌发生发展和转移过程中发挥了协同作用。研究表明Gas6能够激活Axl受体,并通过ERK等信号通路激活下游基因NF-κB和Brg-1,导致MMP-9蛋白过表达,有利于突破肿瘤基底膜及细胞外基质,促进肿瘤的转移[15]。表明联合检测Gas6和MMP-9有助于判断胆管癌的恶性程度和预后。
[1] 王文斌,刘兵,王天阳,等.信号转导与转录激活因子3、细胞周期素D1在胆管癌组织中的表达及意义[J].河北医科大学学报,2017,38(12):1397-1400,1405.
[2] 陈立婷,卢萍,孙宇辉.Gas6/Axl信号通路与肿瘤关系的研究进展[J].现代肿瘤医学,2016,24(19):3165-3168.
[3] 刘亚彬,郑万磊,张静,等.华北地区结直肠癌发病风险与基质金属蛋白酶-9表达及基因多态性的相关性[J].中华实验外科杂志,2017,34(1):14-16.
[4] 郑春雷,张忠泰,高红.胃癌组织中生存素和基质金属蛋白酶-9的表达及其与胃癌临床病理特点的关系[J].中华实验外科杂志,2017,34(2):214-216.
[5] Jiang T,Liu G,Wang L,et al. Elevated serum Gas6 is a novel prognostic biomarker in patients with oral squamous cell carcinoma[J]. PLoS One,2015,10(7):e0133940.
[6] 解芳,刘鸿梅.血清和胆汁MMP-9、TIMP-1检测在胆管癌诊断中的价值[J].山东医药,2016,56(25):56-58.
[7] Wu X,Liu X,Koul S,et al. Axl kinase as a novel target for cancer therapy[J]. Oncotarget,2014,5(20):9546-9563.
[8] Martinelli E,Martini G,Cardone C,et al. Axl is an oncotarget in human colorectal cancer[J]. Oncotarget,2015,6(27):23281-23296.
[9] 姜涛,刘洪臣.生长停滞特异性基因6在肿瘤研究中的进展[J].中华老年口腔医学杂志,2017,15(2):121-124.
[10] 王建澍,移志刚,蒲彦川,等.ERK5和MMP-9在骨肉瘤中的表达及其临床意义[J].中国肿瘤临床,2017,44(14):689-694.
[11] 程甜甜,杨贤子,骆志国.Axl及其配体Gas6在宫颈鳞癌中的表达与意义[J].川北医学院学报,2016,31(2):228-231.
[12] 黄小娟,王俊艳,齐文慧,等.Axl及其配体Gas6在Ⅰ型和Ⅱ型上皮性卵巢癌中的表达和意义[J].天津医科大学学报,2014,20(5):342-346,353.
[13] 张明帅,朱丽萍,欧江华,等.Axl及其配体在乳腺癌组织中的表达及临床意义[J].临床肿瘤学杂志,2014,19(1):29-33.
[14] 张静怡,单丽珠,张洁,等.LAPTM4B-35和MMP-9在胃癌中表达及临床意义[J].中国肿瘤临床,2017,44(24):1226-1231.
[15] Tai KY,Shieh YS,Lee CS,et al. Axl promotes cell invasion by inducing MMP-9 activity through activation of NF-kapa B and Brg-1 [J]. Oncogene,2008,27(29):4044-4055.