结直肠癌是世界上最常见的恶性肿瘤之一,有8%~13%的结直肠肿瘤患者伴发肠梗阻[1]。由于左半结肠特殊的生理结构,左半结肠癌患者大都伴随急、慢性肠梗阻。很多结肠癌患者以急性肠梗阻为首发症状,继而发现恶性肿瘤。约60%结肠癌性梗阻发生在左半结肠。急性梗阻需要急诊手术治疗,其手术风险明显增加[2]。为了解除梗阻[3],普外科医生不得不采取分期手术,患者需要承受二次手术打击,承担二次手术风险及痛苦,很多患者在造瘘期间,肿瘤持续进展出现转移等病情恶化的情况,使患者完全失去行根治性手术的机会。当结肠癌发展到肠梗阻时,肿瘤组织周围可能已经出现微转移病灶,行手术局部切除时这些微转移灶无法明确是否切除,故外科专家达成共识,在术前通过化疗,消除微转移病灶,缩小原发肿瘤的体积,从而为后续手术切除提供良好的切除条件[4-6]。但目前关于通过置入支架解除癌性梗阻后行新辅助化疗,然后再行手术,并将上述方法连续应用的研究临床报道较少。本研究将置入肠道支架解除梗阻后行新辅助化疗再手术这一方法应用于梗阻型左半结肠癌患者,重点分析其对血清标本中肿瘤标记物、肿瘤组织恶性生物学行为及手术效果的影响,报告如下。
1 资料与方法
1.1 一般资料 选取2016年12月—2018年2月我院收治的因肠梗阻入院并确诊为左半结肠癌的患者81例。纳入标准:①肠梗阻入院,入院检查后诊断为左半结肠癌;②影像学分期TⅩNⅩM0;③年龄≥40岁;④无心脑血管及肺部引起手术禁忌的疾病;⑤肝肾功能正常;⑥能顺利完成根治手术。按照治疗方法不同分为试验组39例和对照组42例。试验组男性22例,女性17例,年龄43~81岁,平均(74.6±5.8)岁;对照组男性25例,女性17例,年龄45~80岁,平均(72.7±6.9)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
患者或家属均签署知情同意书。
1.2 治疗方法 试验组在肠镜引导下置入肠道Wall Flex支架(美国Boston Scientific公司),待梗阻解除后,接受新辅助化疗。具体方案:第1天给予静脉滴注奥沙利铂130 mg/m2,第1天至第14天给予口服卡培他滨片1 000 mg/m2,2次/d;休息1周,为1个完整周期,连续2个周期后,行常规开腹结肠癌根治手术治疗。对照组行急诊开腹结肠癌根治术。
1.3 肿瘤标记物检测 对照组留取入院时和术后血清标本;试验组留取入院时、置入支架化疗后和术后血清学标本。肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)、CA724、CA199、CA125含量均用酶联免疫吸附测定试剂盒测定。
1.4 肿瘤组织中恶性分子表达量检测 肿瘤标本离台后立即进行处理,取癌灶的周边、基底部各3块,首先用氯化钠注射液清洗,接着加入Trizol裂解液,提取肿瘤组织中的总RNA,采用试剂盒合成cDNA,荧光定量PCR试剂盒测定结肠癌组织中Survivin、CHD1L、骨桥蛋白(osteopontin,OPN)、SMYD3的mRNA表达量。
1.5 观察指标 比较2组手术时间、术中失血情况、手术切除标本中淋巴结数目、手术后排气时间、肠管吻合后漏发生率、Ⅰ期切除吻合情况、切口感染情况。
1.6 统计学方法 应用SPSS 20.0统计软件处理数据。计量资料比较分别采用两独立样本t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组肿瘤标记物含量比较 入院时,2组血清 CEA、CA724、CA199、CA125水平差异均无统计学意义(P>0.05)。对照组术后血清 CEA、CA724、CA199、CA125水平均明显低于入院时(P<0.05);试验组化疗后和术后血清 CEA、CA724、CA199、CA125水平均明显低于入院时,术后血清 CEA、CA724、CA199、CA125水平均明显低于化疗后(P<0.05);术后,试验组血清 CEA、CA724、CA199、CA125水平均明显低于对照组(P<0.05)。见表1。
表1 2组肿瘤标记物含量比较
Table 1 Comparison of tumor markers between two groups ![]()
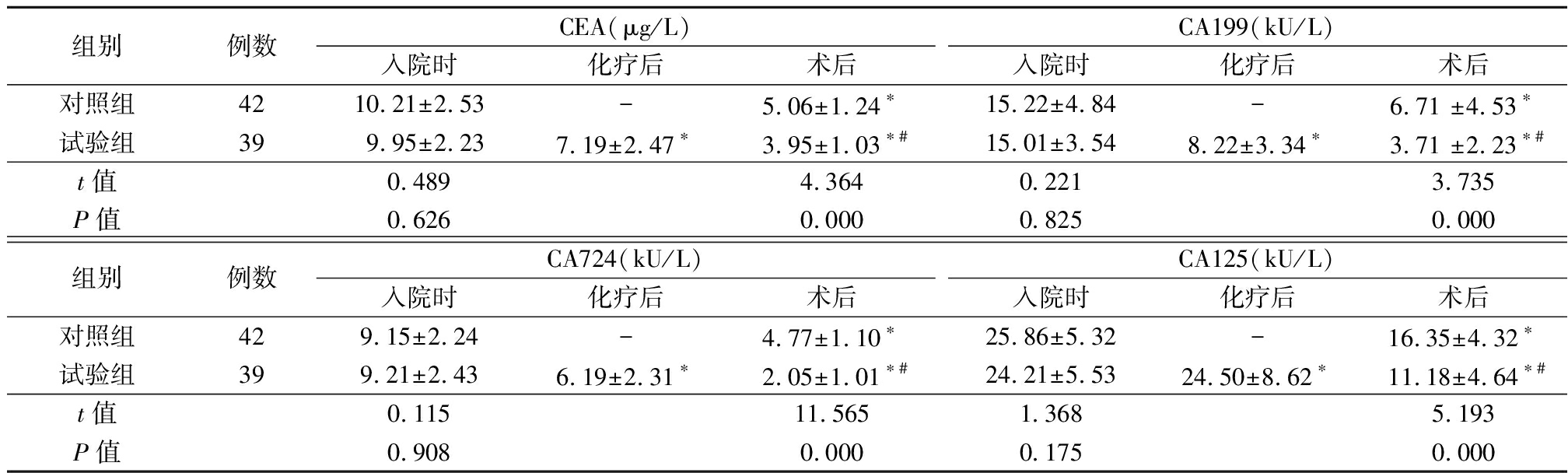
组别例数CEA(μg/L)入院时化疗后术后CA199(kU/L)入院时化疗后术后对照组4210.21±2.53-5.06±1.24∗15.22±4.84-6.71 ±4.53∗试验组399.95±2.237.19±2.47∗3.95±1.03∗#15.01±3.548.22±3.34∗3.71 ±2.23∗#t值0.4894.3640.2213.735 P值0.6260.0000.8250.000组别例数CA724(kU/L)入院时化疗后术后CA125(kU/L)入院时化疗后术后对照组429.15±2.24-4.77±1.10∗25.86±5.32-16.35±4.32∗试验组399.21±2.436.19±2.31∗2.05±1.01∗#24.21±5.5324.50±8.62∗11.18±4.64∗#t值0.11511.5651.3685.193P值0.9080.0000.1750.000
*P值<0.05与入院时比较 #P值<0.05与化疗后比较(配对t检验)
2.2 2组肿瘤组织恶性分子mRNA表达量比较 试验组肿瘤组织中SMYD3、CHD1L、OPN、Survivin的mRNA表达量均明显低于对照组(P<0.05),见表2。
2.3 2组手术指标比较 试验组手术时间、手术至排气时间均短于对照组,术中失血量少于对照组,肠管吻合口漏发生率、切口感染率均明显低于对照组,Ⅰ期切除吻合率明显高于对照组(P<0.05);2组术中切除组织中淋巴结数量差异无统计学意义(P>0.05)。见表3。
表2 2组肿瘤组织恶性分子mRNA表达量比较
Table 2 Comparison of malignant molecular mRNA expression between two groups of tumor tissues ![]()
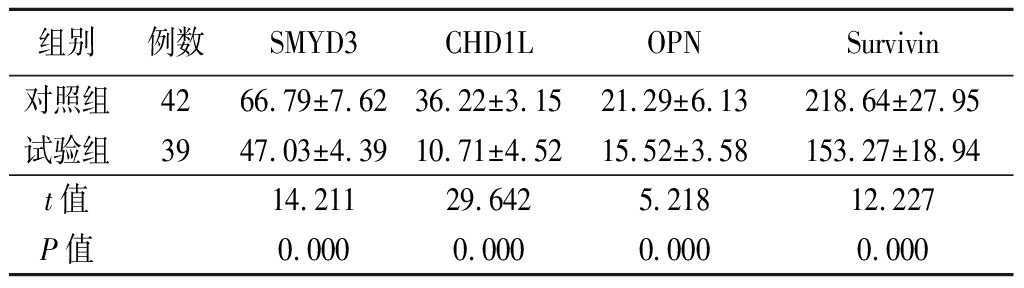
组别例数SMYD3CHD1LOPNSurvivin对照组4266.79±7.6236.22±3.1521.29±6.13218.64±27.95试验组3947.03±4.3910.71±4.5215.52±3.58153.27±18.94t值14.211 29.6425.21812.227P值0.0000.0000.0000.000
表3 2组手术指标比较
Table 3 Comparison of surgical indices between two groups ![]()
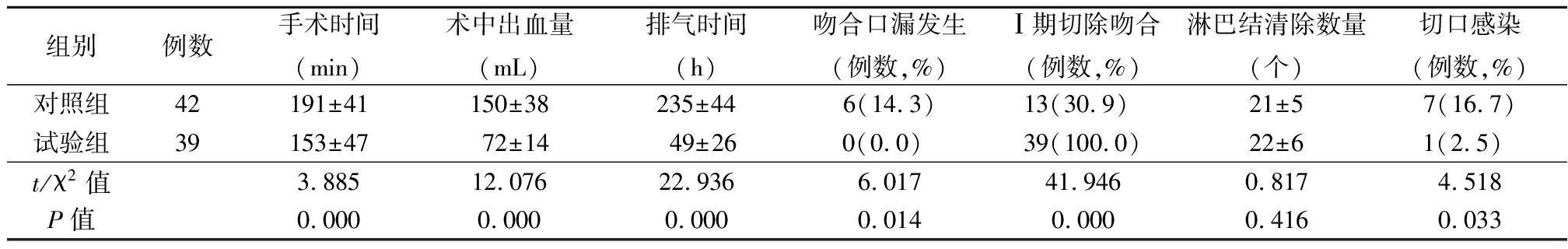
组别例数手术时间(min)术中出血量(mL)排气时间(h)吻合口漏发生(例数,%)Ⅰ期切除吻合(例数,%)淋巴结清除数量(个)切口感染(例数,%)对照组42 191±41150±38235±446(14.3)13(30.9) 21±57(16.7)试验组39 153±4772±1449±260(0.0) 39(100.0)22±61(2.5) t/χ2值 3.88512.07622.9366.01741.9460.8174.518P值0.0000.0000.0000.0140.0000.4160.033
3 讨 论
由结肠癌导致的急性肠梗阻需要急诊手术治疗,但其并发症发生率非常高,其中吻合口漏是最大的风险。由于是急诊梗阻手术,术前没有办法行肠道准备,结肠水肿、缺血、炎症等因素使得吻合口漏发生率高达34.1%,其次是切口感染[7-8]。外科医生常规做法是分期手术,先行结肠造瘘和(或)结肠癌手术,等待情况允许后二次手术再行结肠造瘘还纳。有学者发现,56%左半结肠癌并发急性肠梗阻的患者术中需要行结肠造口[9]。左半结肠癌出现急性肠梗阻行分期手术的弊端是显而易见的:①术后佩戴造瘘袋,降低生活质量;②患者需要承受多次手术叠加在一起的更高风险和痛苦;③由于造瘘口,产生新的造口疝、造口旁感染、造口旁皮肤肠液腐蚀等问题;④有些患者当时无法切除肿瘤,行单纯造瘘,恢复过程中肿瘤继续进展,失去了后期再次根治的机会;⑤多次手术易引起机体过度应激,免疫抑制,导致癌细胞增长迅速;⑥营养状态差,各种炎性介质及肿瘤恶性分子的影响,肿瘤进展更加迅速;⑦梗阻性结肠癌患者一般全身状态很差,术后出现切口感染、腹腔感染、肺部感染等并发症的概率大大增加。
为了减少Ⅰ期切除吻合口漏的发生率,外科医生尽可能地创造条件改善患者的局部及全身状况。结肠自膨胀金属支架可用于失去手术机会结肠癌性梗阻患者的姑息性治疗。目前,该方法已被广泛用于结肠癌恶性梗阻[10-11]。结肠癌出现肠梗阻后肠腔内充满气液混合的肠内容物,导致肠壁扩张,张力很大,在对肠管进行减压及手术时,极易污染腹腔和切口。长时间梗阻后局部缺血坏死,各种炎症介质对各个脏器的打击,严重影响了患者对手术的耐受性,甚至由于各种原因无法立即手术,出现感染性休克,危及生命。
支架的使用缓解了梗阻,使扩张的肠管压力迅速减小,恢复局部血液供应,消除水肿,完成肠道准备,同时又能积极纠正水电解质紊乱,纠正低蛋白血症和贫血,极大地增强了耐受手术打击的能力,从而降低围手术期内死亡风险,挽救了部分患者的生命。此外,老年人往往合并心脑血管疾病,而长期服用阿司匹林、波立维等抗凝药物,增加了急诊手术发生大出血的风险,但如果置入支架,可极大地规避这些问题。并且其创伤小、操作时间短,手术风险也将大大降低[12-13]。
当结肠癌出现梗阻,特别是左半结肠,一般局部分期均比较晚,而且是急诊手术,手术的主要目的是解除梗阻,挽救生命,其次才是考虑肿瘤的切除。对于微小转移灶,是无法手术安全切除的,这也是术后很快就出现远处转移的主要原因。已经有研究证实在消化道肿瘤的治疗方面,术前的化疗(新辅助化疗) 比术后化疗效果更好,能有效清除微转移灶,很大程度避免手术刺激后早期生长因子的激活,能将瘤体缩小而降低术中肿瘤细胞脱落的风险[14-15]。新辅助化疗对于局部晚期癌症患者的疗效是确切的,为患者的根治性切除创造了机会,更有利于预后[16-17]。置入支架解除梗阻,不仅避免了急诊手术,又为术前新辅助化疗争取了机会,变急诊手术为限期手术,减小了瘤体体积,有效根除微转移病灶,极大增加了手术根治性切除的机会。术前进行充分的肠道准备,然后再行手术,降低了围手术期的风险,且能使患者术后恢复得更快、更好。
本研究结果显示,试验组手术时间、手术至排气时间短于对照组,术中失血量少于对照组,肠管吻合口漏发生率、切口感染率均明显低于对照组,Ⅰ期切除吻合率明显高于对照组(P<0.05),进一步证实了试验组治疗方式更优,疗效更确切;对照组术中组织水肿、炎症、局部粘连增加了出血,故术者将很大一部分时间用在了术中肠道减压、减少扩张、止血、分离粘连上。本研究2组手术切除的淋巴结数量差异无统计学意义(P>0.05),说明2组手术切除范围均是很积极的,即便是对照组手术中肠腔扩张、感染较重、急诊手术等不利条件情况下,仍然可以保证可视条件下的切除范围,这也是本研究试验组术前比对照组术后肿瘤标记物含量高的原因,反映出单纯手术与支架植入加化疗相比,手术切除能更有效抑制肿瘤进展和恶性程度的原因之一。
血清中肿瘤标记物CEA、CA199、CA724、CA125是目前公认的反映患者肿瘤进展情况,评价结直肠癌复发、浸润和转移等预后的指标[18],其在血清中的含量与癌症进展情况呈正相关。本研究结果显示,试验组化疗后肿瘤标记物水平明显低于入院时(P<0.05),提示术前支架植入及新辅助化疗能明显降低肿瘤的进展程度;试验组术后肿瘤标记物水平明显低于对照组(P<0.05),说明置入支架加新辅助化疗后手术,能更有效地抑制肿瘤恶性生物学行为相关细胞因子的分泌,进而抑制肿瘤的进展,减少肿瘤侵袭及转移。
恶性分子通过介导癌细胞的生物学行为,在恶性肿瘤的发生和发展过程中发挥着重要作用。肿瘤细胞主要恶性生物学行为包括增殖、迁移、侵袭,这些生物学行为完成了恶性肿瘤细胞转移、复发等状态[18-19]。
细胞向外侵袭和上皮间质转化是肿瘤细胞浸润性生长的生物学基础。 CHD1L是SFN2家族的重要成员,有促进细胞侵袭的作用,能够通过调控蛋白质与DNA之间的相互作用和相互结合的方式促进细胞侵袭[20]。SMYD3可以影响肿瘤细胞的黏附及迁移,在肿瘤发生发展的分子水平发挥重要作用[21-22]。SMYD3作为RNA多聚酶复合物的重要成员,可以通过甲基化组蛋白调控细胞周期相关蛋白与非细胞周期相关蛋白的表达,促进癌细胞增殖,基因启动子结合,抑制细胞凋亡;还可以通过激活多种信号通路及上皮间质转化过程 促进癌细胞的浸润转移[23]。近年来有研究显示,SMYD3在多种肿瘤过表达,并与肿瘤的局部浸润与远处转移呈正相关[24]。
OPN是一类分泌型糖基化、磷酸化的非胶原蛋白,具有促进细胞迁移、侵袭等功能。在胃癌、肠癌、肺癌等多种肿瘤细胞中均发现其高表达。目前已经证实OPN参与骨形成、血管形成、细胞侵袭、细胞凋亡等过程,其通过刺激体内NF-κB表达调控基质金属蛋白2促进细胞外基质的降解,完成癌细胞的侵袭、迁移、浸润等。OPN高表达能促进结肠癌细胞增殖、迁移,进一步证实了OPN在结肠癌细胞恶性生物学行为中的重要临床意义。Survivin 是凋亡抑制蛋白家族的一员,也是目前发现凋亡作用最强的因子,可通过多种途径抑制细胞凋亡参与肿瘤的发生。 Survivin 参与结直肠腺瘤癌变的过程,同时提示预后不良,在正常成熟组织内基本不表达,而在结直肠癌组织内过表达。
本研究通过对肿瘤标本中恶性分子的分析,明确了其在肿瘤增殖、凋亡及转移过程中的表达变化,结果显示试验组术后SMYD3、CHD1L、OPN和Survivin的mRNA表达量均低于对照组(P<0.05)。表明新辅助化疗在影响肿瘤组织合成和分泌恶性分子的同时,也会影响局部病灶组织中恶性分子的表达。
综上所述,梗阻型左半结肠癌置入支架解除梗阻后联合新辅助化疗,然后行手术治疗,能降低肿瘤细胞的恶性程度,最大程度抑制肿瘤细胞的全身转移,提升了手术对肿瘤的可切除性,可以将急诊手术变为限期手术,降低肿瘤分期,使手术风险降至最小,从而为患者谋求了最大的获益及更长的生存时间,并能最大程度地提升整体治疗效果,在目前阶段是极佳的治疗手段。
[1] Winner M,Mooney SJ,Hershman DL,et al. Incidence and predictors of bowel obstruction in elderly patients with stage IV colon cancer:a population-based cohort stud[J]. JAMA Surg,2013,148(8):715-722.
[2] Kobayashi H,Miyata H,Gotoh M,et al. Risk model for right hemicolectomy based on 19,070 Japanese patients in the National Clinical Databas[J]. J Gastroenterol,2014,49(6):1047-1055.
[3] 林仁芳,柯鹏翔.58例结肠癌并发急性肠梗阻手术疗效临床分析[J].中国当代医药,2013,20(3):56-57.
[4] A1-Shamsi HO,Kee BK,Tetzlaff MT,et al. Capecitabine-in-dueed leukocytoclastic vasculitis under neoadjuvant chemotherapy for locallyadvanced colorectal cancer[J]. J Gastrointest Oncol,2015,6(3):E40-43.
[5] 王锡山.局部晚期结直肠癌联合脏器切除的适应证和治疗策略的选择[J].中国癌症杂志,2015,25(11):861—864.
[6] 张福杰,张文俊,于登峰.术前短程辅助化疗联合根治性手术治疗结肠癌的临床效果及对患者CDX2、ING4表达的影响[J].河北医科大学学报,2018,39(1):54-57.
[7] 田步宁,符颖,岳红,等.自膨胀型金属支架治疗晚期结直肠癌合并急性肠梗阻的临床初步研究[J].中国普通外科杂志,2016,25(4):481-486.
[8] 杨永锐,王明元,戴文捷.老年结肠癌并肠梗阻采用不同手术时机治疗的效果及对术后并发症的影响[J].现代诊断与治疗,2016,27(2):280-281.
[9] 熊为民,陈声飞,胡斌,等.左半结肠癌合并肠梗阻置入金属内支架后I期切除吻合术的疗效分析[J].中国当代医药,2016,23(8):71-74.
[10] 周艳华,李鹏,冀明,等.结肠自膨胀金属支架治疗右半结肠癌性梗阻的疗效研究[J].临床和实验医学杂志,2016,15(14):1439-1442.
[11] 刘祺,卢太亮,董宏宇,等.非透视结肠自扩张金属支架置入过渡治疗急性梗阻性结直肠癌的临床分析[J].中国现代手术学杂志,2018,22(1):1-5.
[12] 祝保玺,徐艺可,阿不都外力·吾守尔,等.经内镜结肠支架置入后再行手术与急诊手术治疗梗阻性左半结肠癌的Meta分析[J].中国普通外科杂志,2014,23(4):436-441.
[13] 穆占增.急诊手术和择期手术治疗梗阻性结肠癌的效果比较[J].河北医科大学学报,2014,35(7):848-849.
[14] Garde-Noguera J,Gil-Raga M,Evgenyeva E,et al. High pKDR immunohistochemical expression is an unfavourable prognostic biomarker in patients with advanced colorectal cancer treated with chemotherapy plus bevacizumab[J]. Clin Transl Oncol,2016,18(4):405-412.
[15] 文新元,雷雄,肖本萍,等.可切除局部晚期结肠癌临床应用新辅助化疗的可行性分析[J].中国现代医学杂志,2014,24(14):86-88.
[16] Umehara M,Umehara Y,Takahashi K,et al. Preoperative chemotherapy with bevacizumab extends disease-free survival after resection of liver metastases from colorectal cancer[J]. Anticancer Res,2016,36(4):1949-1954.
[17] 潘修勇,夏子泳,郭居.结肠次全切除治疗梗阻性左半结肠癌32例临床研究[J].河北医科大学学报,2012,33(2):154-156.
[18] 邓伟伟,黄艳春,阿先古丽·阿不力孜.肿瘤标记物联合检测对肿瘤高危人群筛查的临床意义[J].国际免疫学杂志,2016,39(1):29-33.
[19] 程群英,邹春标.联合检测血清肿瘤标记物在恶性肿瘤诊断中的价值[J].现代预防医学,2015,42(22):4221-4224.
[20] Liu M,Chen L,Ma NF,et al. CHD1L promotes lineage reversion of hepatocellular carcinoma through opening chromatin for key developmental transcription factors[J]. Hepatology,2016,63(5):1544-1559.
[21] Tsai CH,Chen YJ,Yu CJ,et al. SMYD3-mediated H2A.Z.1 methylation promotes cell cycle and cancer proliferation[J]. Cancer Res,2016,76(20):6043-6053.
[22] Sarris ME,Moulos P,Haroniti A,et al. SMYD3 Is a Transcriptional Potentiator of Multiple Cancer-Promoting Genes and Required for Liver and Colon Cancer Development[J]. Cancer Cell,2016,29(3):354-366.
[23] Zhu Y,Zhu MX,Zhang XD,et al. SMYD3 Stimulates EZR and LOXL2Transcription to Enhance Proliferation,Migration,and Invasion in Esophageal Squamous Cell Carcinoma[J]. Hum Pathol,2016,52(1):153-163.
[24] 夏传友,李路超,李孝峰,等.组蛋白甲基化酶SMYD3在前列腺癌组织的表达及对mTOR通路的影响[J].山东大学学报:医学版,2016,54(5):12-16,44.