白蒲黄胶囊具有清热燥湿、解毒凉血的功效,主要由白头翁、蒲公英、黄芩和黄柏4味中药组成。其中君药白头翁药材具有清热解毒、凉血止痢的功效,临床上广泛用于免疫修饰[1]、抗氧化[2]和抗炎[3]等方面。近年来,其抗肿瘤[4-6]的作用越来越被广泛关注。但在国内市场中,白头翁药材经常与翻白草等中草药混用,造成了最终治疗效果良莠不齐。目前文献中尚未见对白蒲黄胶囊质量控制方法的报道。为进一步控制白蒲黄胶囊质量,建立一个灵敏度高、专属性好的分析方法对其进行质量控制[7]是一个亟待解决的问题。近年来,液质联用法已被广泛应用于复杂中药体系中化合物的定性、定量研究[8-15],随着高效液相色谱技术的飞速发展,超高效液相色谱具有缩短分析时间、提升灵敏度和分辨率的优点。因此,为进一步有效控制白蒲黄胶囊的质量,本实验基于超高效液相色谱质谱联用技术,建立同时测定白蒲黄胶囊中β-蜕皮甾酮、筋骨草甾酮C、常春藤皂苷C、刺人参皂苷S、白头翁皂苷C、C47H76O17、白头翁皂苷B4、常春藤皂苷B、白头翁皂苷A3、α-常春藤皂苷、23-羟基白桦脂酸和常春藤皂苷元12种成分含量的方法,旨在为白蒲黄胶囊内在质量的综合评价和全面控制提供新的方法。
1 仪器与试药
对照品β-蜕皮甾酮、筋骨草甾酮C、刺人参皂苷S、白头翁皂苷C、白头翁皂苷B4、白头翁皂苷A3、23-羟基白桦脂酸和C47H76O17均由本实验室提取分离得到,其H-NMR,C-NMR和MS等波谱数据与相关文献一致,经高效液相色谱法面积归一化法分析,其纯度大于95%。α-常春藤皂苷、常春藤皂苷元(纯度大于98%)购于上海诗丹德生物技术有限公司,常春藤皂苷C和常春藤皂苷B购于上海源叶生物科技有限公司。甲醇(色谱纯,Merck Company,Germany);甲酸为色谱纯(色谱纯,Diamond Technology Incorporation,USA);水为屈臣氏纯净水(屈臣氏集团有限公司,香港);样品制备的乙醇为分析纯(天津富宇化学品公司,天津);白蒲黄胶囊(批号:160501、160605、160609)购于黑龙江瑞格制药有限公司。
2 方法与结果
2.1 色谱条件 色谱柱为Phenomenex Kinetex-C18色谱柱(100×3 mm,2.6 mm);柱温为40 ℃;流动相为甲醇-0.1%甲酸(A),水-0.1%甲酸(B),采用梯度洗脱方式,洗脱程序如下:0.0~6.0 min,60%~95% A;6.0~8.0 min,95%A等度洗脱;8.1 min,60%A;每次进样前预平衡1 min。流速为0.4 mL/min。色谱柱后溶液无分流,全部进入离子源,总体分析时间8 min,进样量2 μL。
2.2 质谱条件 电喷雾离子源(ESI源),StepWaveTM离子源,离子源温度(Source Temp)为150 ℃,毛细管(Capillary)电压为2.0 kV,离子源补偿电压(Source Offset)为50 V,脱溶剂气温度(Desolvation Temp)为500 ℃,脱溶剂气(Desolvation)流量为800 L/Hr,锥孔气(Cone)流量为150 L/Hr,雾化气(Nebuliser)压力为7.0 Bar,接口处加热,采用多反应监测模式。待测化合物中β-蜕皮甾酮,筋骨草甾酮C,常春藤皂苷C,刺人参皂苷S,白头翁皂苷C,C47H76O17采用正离子模式监测,常春藤皂苷B,白头翁皂苷A3,α-常春藤皂苷,23-羟基白桦脂酸和常春藤皂苷元采用负离子模式监测。12种目标化合物保留时间、测定离子对和质谱参数信息见表 1。
表1 12种待测化合物的保留时间、质谱碎片、触碰电压和碰撞能量
Table 1 Retention time,tandem mass spectrometry fragment ions,cone voltage,collision energy of 12 targeted components
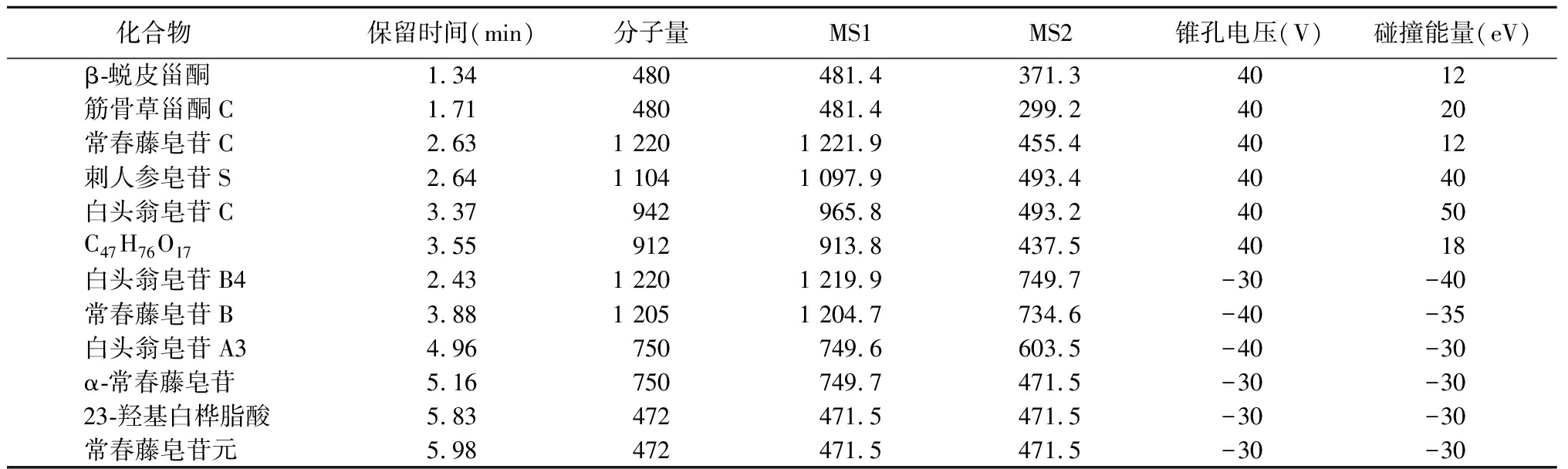
化合物 保留时间(min)分子量MS1MS2锥孔电压(V)碰撞能量(eV)β-蜕皮甾酮1.34480481.4371.34012筋骨草甾酮C1.71480481.4299.24020常春藤皂苷C2.631 2201 221.9455.44012刺人参皂苷S2.641 1041 097.9493.44040白头翁皂苷C3.37942965.8493.24050C47H76O173.55912913.8437.54018白头翁皂苷B42.431 2201 219.9749.7-30-40常春藤皂苷B3.881 2051 204.7734.6-40-35白头翁皂苷A34.96750749.6603.5-40-30α-常春藤皂苷5.16750749.7471.5-30-3023-羟基白桦脂酸5.83472471.5471.5-30-30常春藤皂苷元5.98472471.5471.5-30-30
2.3 溶液的制备
2.3.1 对照品溶液的制备 分别取β-蜕皮甾酮、筋骨草甾酮C、常春藤皂苷C、刺人参皂苷S、白头翁皂苷C、C47H76O17、常春藤皂苷B、白头翁皂苷A3、α-常春藤皂苷、23-羟基白桦脂酸和常春藤皂苷元对照品适量,精密称定,置于1 mL量瓶中,加甲醇溶解并稀释至刻度,配制成一定浓度的储备液。用80%甲醇配制混合对照品溶液。其中各对照品浓度分别为β-蜕皮甾酮432.0 μg/L、筋骨草甾酮C 142.0 μg/L、常春藤皂苷C 450.0 μg/L、刺人参皂苷S 45.5 μg/L、白头翁皂苷C 104.0 μg/L、C47H76O17 565.0 μg/L、常春藤皂苷B 3 825.0 μg/L、白头翁皂苷A3 980.0 μg/L、α-常春藤皂苷265.0 μg/L、23-羟基白桦脂酸140.0 μg/L和常春藤皂苷元66.7 ng/mL。将混合对照品溶液用80%甲醇逐级稀释得到标准系列溶液。所有溶液存储于4 ℃冰箱备用。
2.3.2 供试品溶液的制备 取白蒲黄胶囊内容物,约0.5 g,精密称定,置于提取瓶中,加入70%乙醇100 mL,称定重量,闪式提取处理200 s,静置至室温,再称定重量,用70%乙醇补足减失的重量,以14 000 r/min,离心10 min,取上清液,0.22 μm微孔滤膜滤过,取续滤液,即得。浓度超出线性范围的供试品溶液用80%甲醇溶液定量稀释后依法测定。
2.4 方法学考察
2.4.1 线性关系考察 分别精密量取混合对照品溶液,以甲醇为溶剂采用倍数稀释法分别稀释。制得6个不同浓度梯度的系列标准溶液,按上述LC-MS条件进行分析,记录各待测物的峰面积。各待测物的质量浓度X (μg/mL)为横坐标,以峰面积Y为纵坐标,绘制标准曲线。将混合对照品溶液逐步稀释,分别以信噪比S/N=3和S/N=10时各对照品溶液的质量浓度作为检测限和定量限。见表2。
表2 12种被测组分的标准曲线、相关系数、线性范围、检测限和定量限
Table 2 Calibration curves,correlation coefficients,linear ranges,LODs,and LOQs of twelve detected constituents
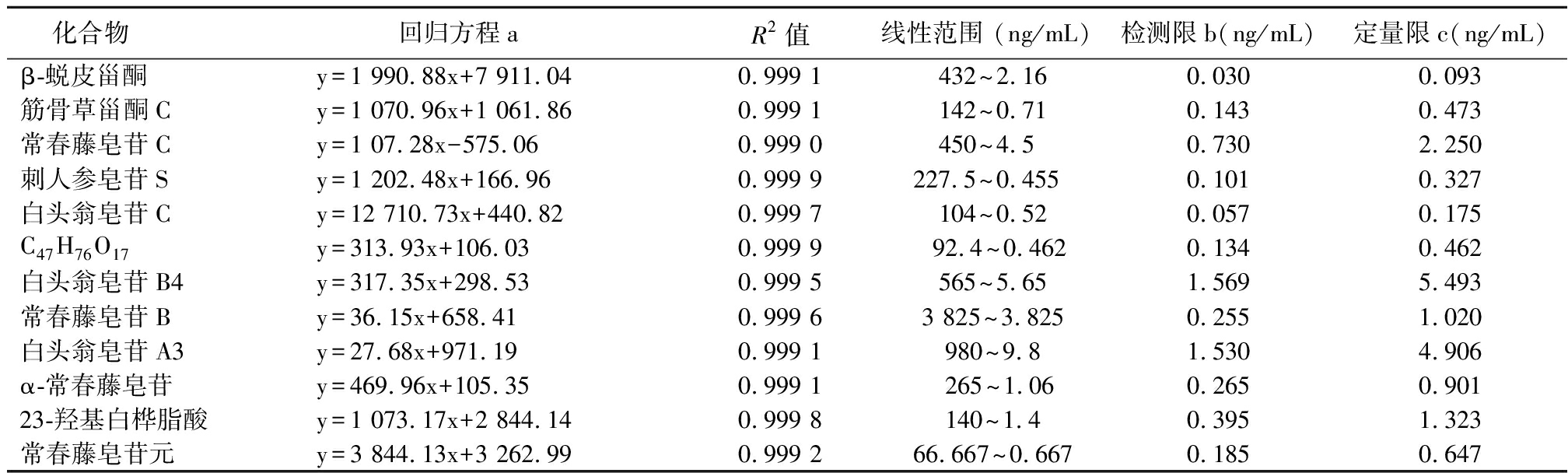
化合物 回归方程aR2值线性范围 (ng/mL)检测限b(ng/mL)定量限c(ng/mL)β-蜕皮甾酮y=1 990.88x+7 911.040.999 1432~2.160.0300.093筋骨草甾酮Cy=1 070.96x+1 061.860.999 1142~0.710.1430.473常春藤皂苷Cy=1 07.28x-575.060.999 0450~4.50.7302.250刺人参皂苷Sy=1 202.48x+166.960.999 9227.5~0.4550.1010.327白头翁皂苷Cy=12 710.73x+440.820.999 7104~0.520.0570.175C47H76O17y=313.93x+106.030.999 9 92.4~0.4620.1340.462白头翁皂苷B4y=317.35x+298.530.999 5565~5.651.5695.493常春藤皂苷By=36.15x+658.410.999 63 825~3.8250.2551.020白头翁皂苷A3y=27.68x+971.190.999 1980~9.81.5304.906α-常春藤皂苷y=469.96x+105.350.999 1 265~1.060.2650.90123-羟基白桦脂酸y=1 073.17x+2 844.140.999 8140~1.40.3951.323常春藤皂苷元y=3 844.13x+3 262.990.999 266.667~0.6670.1850.647
2.4.2 精密度试验 精密吸取同一混合对照品溶液各20 μL,连续进样5次,计算各成分峰面积的相对标准差(relative standard deviation,RSD)。结果β-蜕皮甾酮、筋骨草甾酮C、常春藤皂苷C、刺人参皂苷S、白头翁皂苷C、C47H76O17、白头翁皂苷B4、常春藤皂苷B、白头翁皂苷A3、α-常春藤皂苷、23-羟基白桦脂酸和常春藤皂苷元的日内RSD和日间RSD分别小于3.5%和4.8%,均符合精密度试验的要求,说明该方法的精密度良好。
2.4.3 重复性试验 按“2.3.2”项下方法制备白蒲黄胶囊样品(批号:160501)的供试品溶液,共5份,进样10 μL测定,记录色谱峰面积。结果β-蜕皮甾酮、筋骨草甾酮C、常春藤皂苷C、刺人参皂苷S、白头翁皂苷C、C47H76O17、白头翁皂苷B4、常春藤皂苷B、白头翁皂苷A3、α-常春藤皂苷、23-羟基白桦脂酸和常春藤皂苷元含量的RSD分别为2.0%、1.6%、1.5%、3.1%、4.2%、1.7%、2.2%、3.5%、4.1%、2.9%、2.7%和3.5%。均符合规定,表明本方法重复性良好。
2.4.4 稳定性试验 取同一白蒲黄胶囊(批号:160501)供试品溶液分别于0,2,6,10,12和24 h进样分析,记录峰面积。结果表明12个待测五环三萜皂苷化合物峰面积的RSD均小于4.9%,说明在室温条件下供试品溶液24 h内稳定。
2.4.5 回收率试验 取白蒲黄胶囊(批号:160501)内容物细粉约0.5 g,精密称定,共6份,分别精密加入高、中、低3个浓度的12个待测化合物的对照品储备液适量,每个浓度3份,按上述方法制备供试溶液。在上述色谱条件下测定12个待测成分的峰面积并分析。结果表明平均回收率范围为97.13%~101.2%,RSD为1.2%~4.1%,说明该方法回收率良好。
2.5 样品测定 取白蒲黄胶囊3批,按上述“2.3.2”项下方法制备供试品溶液,进样测定,记录色谱峰面积,每批样品平行测定3次,代入相应标准曲线,分别计算β-蜕皮甾酮、筋骨草甾酮C、常春藤皂苷C、刺人参皂苷S、白头翁皂苷C、C47H76O17、白头翁皂苷B4、常春藤皂苷B、白头翁皂苷A3、α-常春藤皂苷、23-羟基白桦脂酸和常春藤皂苷元的含量,见表3。
表3 白蒲黄胶囊中12种有效成分的含量
Table 3 The contents of the twelve compounds in Baipuhuang capsules (μg per capsule,n=3)
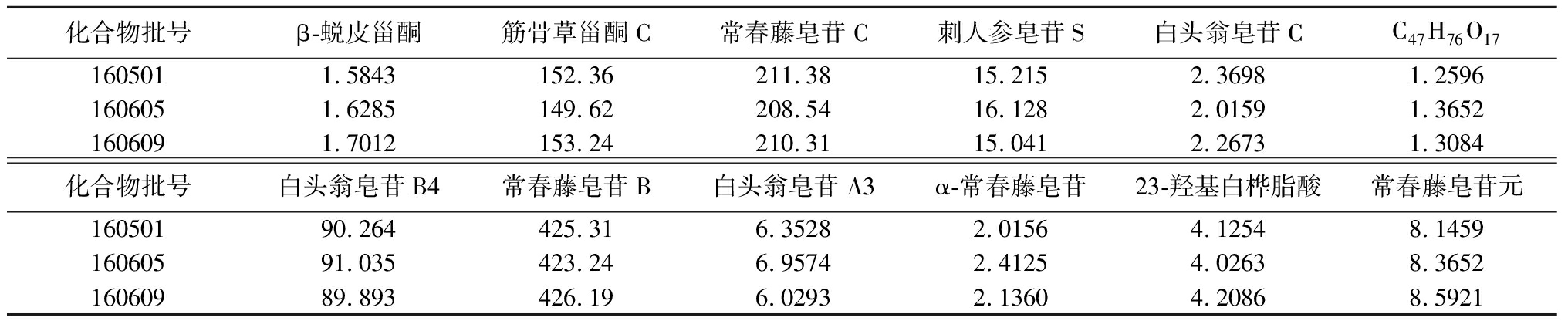
化合物批号β-蜕皮甾酮筋骨草甾酮C常春藤皂苷C刺人参皂苷S白头翁皂苷CC47H76O171605011.5843152.36211.3815.2152.36981.25961606051.6285149.62208.5416.1282.01591.36521606091.7012153.24210.3115.0412.26731.3084化合物批号白头翁皂苷B4常春藤皂苷B白头翁皂苷A3α-常春藤皂苷23-羟基白桦脂酸常春藤皂苷元16050190.264425.316.35282.01564.12548.145916060591.035423.246.95742.41254.02638.365216060989.893426.196.02932.13604.20868.5921
3 讨 论
在正负离子模式下,分别优化12种待测成分的质谱条件。质谱结果表明化合物1~6在正离子模式下的[M+H]+离子更稳定、灵敏度更高,其他6种成分在负离子模式下有更高的响应。因此,笔者通过一次进样,在正、负离子同时检测模式下对12种活性成分进行测定,然后在MS2模式下通过调节锥孔电压和碰撞能量值,分别选择响应值较好的2个子离子峰,根据它们的响应值大小选择最佳监测离子对。
12种被测组分中有4对同分异构体,其完全分离对于精确定量具有十分重要的意义。考察不同种类的流动相(乙腈-水,甲醇-水),不同的流速(0.5和0.4 mL/min),不同类型的色谱柱(Waters ACQUITY BEH色谱柱,50 mm×2.1 mm,1.7 mm;Phenomenex Kinetex C18色谱柱,100 mm× 3 mm,2.6 mm),以期在短时间内获得较好的峰形、高响应值和较好的分离度。由于目标化合物极性较小,选择甲醇-水系统作为流动相,为了获得较高的灵敏度和改善峰拖尾情况,向流动相中加入0.1%甲酸。
[1] Liu T,Ye LG,Guan XQ,et al. Immunopontentiating and antitumor activities of a polysaccharide from Pulsatilla chinensis(Bunge) Regel[J]. Int J Biol Macromol,2013,54:225-229.
[2] 连珊,江蔚新,薛睿.白头翁皂苷成分及药理作用研究进展[J].亚太传统医药,2016,12(2):37.
[3] 杨昌文.白头翁汤及拆方对模型小鼠抗炎作用的实验研究[J].中国中医急症,2016,25(9):1737-1739.
[4] 陈凯,张文明,喻凯,等.白头翁中抗肿瘤物质的筛选及其作用机制研究[J].天然产物研究与开发,2016,28(12):1875-1879.
[5] 彭翠平,许琼明,张天,等.白头翁总皂苷碱水解产物的抗胶质瘤作用及机制研究[J].中药新药与临床药理,2014,25(3):254-259.
[6] Xu QM,Shu Z,He WJ,et al. Antitumor activity of Pulsatilla chinensis (Bunge) Regel saponins in human liver tumor 7402 cells in vitro and in vivo[J]. Phytomedicine,2012,19(3/4):293-300.
[7] 焦宁,杨劼,刘国强.中药制剂质量控制方法研究新进展[J].河北医科大学学报,2013,34(1):120-123.
[8] Andrey Stavrianidi,Elena Stekolshchikova,Anna Porotova,et al. Combination of HPLC-MS and QAMS as a new analytical approach for determination of saponins in ginseng containing products[J]. J Pharm Biomed Anal,2017,132:87-92.
[9] Masi E,Taiti C,Heimler D,et al. PTR-TOF-MS and HPLC analysis in the characterization of saffron (Crocus sativus L.) from Italy and Iran[J]. Food Chem,2016,192:75-81.
[10] Han Y,Wen J,Zhou T,et al. Chemical fingerprinting of Gardenia jasminoides Ellis by HPLC-DAD-ESI-MS combined with chemometrics methods[J]. Food Chem,2015,188:648-657.
[11] Brkljaĉa R,Urban S. HPLC-NMR and HPLC-MS investigation of antimicrobial constituents in Cystophora monilifera and Cystophora subfarcinata[J]. Phytochemistry,2015,117:200-208.
[12] Zhang Z,Hu X,Zhang Q,et al. Determination for multiple mycotoxins in agricultural products using HPLC-MS/MS via a multiple antibody immunoaffinity column[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2016,1021:145-152.
[13] Wu Y,Jiang X,Zhang S,et al. Quantification of flavonol glycosides in Camellia sinensis by MRM mode of UPLC-QQQ-MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2016,1017/1018:10-17.
[14] Xie Z,Mui T,Sintara M,et al. Rapid quantitation of avenanthramides in oat-containing products by high-performance liquid chromatography coupled with triple quadrupole mass spectrometry(HPLC-TQMS)[J]. Food Chem,2017,224:280-288.
[15] Gabrielli M,Buica A,Fracassetti D,et al. Determination of sotolon content in South African white wines by two novel HPLC-UV and UPLC-MS methods[J]. Food Chem,2015,169:180-186.