癫痫发作具备突发突止、短暂一过性、自限性等特点,其大脑神经元异常放电诱发中枢神经系统电生理和生物化学功能暂时异常[1],同时脑电图监测到异常过度同步化放电的临床发作。而癫痫是指以反复癫痫发作为共同特征的慢性脑部疾病状态。脑电图是癫痫诊断和鉴别中一项不可取代的敏感性极高的检查工具。2017年国际抗癫痫联盟提出结合脑电图检查将癫痫发作分为局灶性起源、全面性起源和未知起源的癫痫发作。其中全面性起源的癫痫发作有强直-阵挛发作、阵挛发作、强直发作、肌阵挛发作、失张力发作、典型和不典型失神发作、眼睑肌阵挛发作等[2]。据汇总分析,国内外癫痫的患病率为0.5%~1.0%;癫痫的发病率为每年48例/10万;儿童是整个癫痫病症候群体中占比例最大的,18岁以下儿童占全部癫痫患者的6成以上,儿童癫痫发病率为成人的10~15倍;对0~16岁活动性癫痫的调查,每天均有癫痫发作的占8%[3]。这主要是因为儿童的中枢神经系统处于发育状态,兴奋性超过抑制性,成为癫痫易感的危险因素,给孩子的健康和生长发育带来极大的危害。目前脑电图已经成为评估脑损伤或退行性疾病患者大脑认知功能的一种相对便宜且易于使用的工具,对发现早期认知损害有一定临床意义[4-5],同时可以评估抗癫痫药物对认知功能的影响[6]。因此,对于儿童癫痫应尽量早发现早治疗,避免病情进一步发展,让孩子尽快脱离癫痫病的阴影[7]。新型抗癫痫药左乙拉西坦作用机制独特,不良反应小,辅药治疗儿童癫痫有效是目前国内外公认的,可显著减少发作频率[8],但单药治疗儿童全面性癫痫发作的依据有限[9-10]。本研究旨在探讨左乙拉西坦单药治疗对全面性癫痫发作脑电图间期放电数量的改变和临床效果。
1 资料与方法
1.1 一般资料 选择2015年1月—2017年5月我院收治的癫痫患儿140例。纳入标准:①年龄1个月~16岁,性别不限;②至少2次非诱发(或反射性)发作,2次发作相隔24 h以上[11];③临床和脑电图确诊、分类明确的癫痫发作;④单药治疗;⑤视频脑电图未监测到抽搐发作,但符合全面性发作间期脑电图特征的患儿;⑥患儿家属均知情同意。排除标准:①不符合临床纳入标准;②智力运动发育落后,原发性神经系统疾病,遗传代谢病等;③心、肝、肾等重要器官严重病变;④联合用药;⑤脑电图监测到2种及以上发作形式的癫痫综合征。将患儿随机分成对照组和观察组各70例。对照组男性43例,女性27例,年龄1个月~16岁,平均(4.7±3.9)岁;其中典型失神发作8例,不典型失神发作5例,肌阵挛发作16例,全面性强直-阵挛发作22例,失张力发作4例,强直发作8例,强直-不典型失神发作3例,肌阵挛失神发作3例,阵挛发作1例。观察组男性39 例,女性31例,年龄1个月~13岁,平均(4.5±3.4)岁;其中典型失神发作21例,不典型失神发作5例,肌阵挛发作11例,全面性强直-阵挛发作14例,失张力发作4例,强直发作10例,强直-不典型失神发作3例,肌阵挛失神发作1例,阵挛发作1例。2组性别、年龄、发作类型差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准。
1.2 治疗方法 对照组给予丙戊酸钠(赛诺菲杭州制药有限公司,注册证号H20010595,规格 300 mL:12 g)单药治疗。10岁以下患儿初始量为10 mg·kg-1·d-1,10 岁或10岁以上患儿初始量为30 mg·kg-1·d-1,口服,早、午、晚各1次;若患儿持续用药1周后疾病症状未控制或者控制不满意,则每周调整药物剂量5~10 mg·kg-1·d-1,直至疗效满意; 治疗总剂量为11.5~60 mg·kg-1·d-1。观察组给予左乙拉西坦(比利时优时珠海制药有限公司分包装,注册证号 H20160254,规格 500 mg/片)单药治疗。初始量为10 mg·kg-1·d-1,口服,早、晚各1次;第2周开始每周增加至5~10 mg·kg-1·d-1,持续3~4 周增加剂量至目标剂量20~40 mg·kg-1·d-1。
1.3 脑电图检查 应用日本光电工业株式会社生产型号EEG-1200C的数字化视频脑电图仪。所有患儿于治疗前和治疗后3个月、6个月进行长程15 h监测。
1.4 观察内容 ①详细记录每例患儿的临床特点,包括性别、年龄、体质量、发病年龄、发作类型、使用抗癫痫药物之前的治疗情况;②不同发作类型癫痫患儿服用抗癫痫药物前后脑电图癫痫样放电(interictal epileptiform activity,IEA)的变化;③治疗前后发作控制情况(发作频率、发作形式的变化);④安全性评价:记录患儿用药期间出现的所有不良事件(情绪异常、行为异常、认知改变、肝功能损害、皮疹等),并确定其是与抗癫痫药相关的不良事件;⑤患儿用药前后检查肝肾功能、血常规。
1.5 疗效及安全性判断 ①脑电图评判标准[12]:正常,IEA完全消失;明显好转,IEA减少50%以上;好转,IEA减少25%~49%;无变化;增加。②临床疗效按发作频率减少百分率评价[13]:无效,发作频率减少<50%;有效,发作频率减少≥50%;完全控制,发作频率减少100%;加重,发作频率增>25%。总有效=完全控制+有效。③安全性:评价家长描述的不良事件发生情况。
1.6 统计学方法 应用SSPS 21.0统计软件分析数据。计数资料比较采用χ2检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组脑电图变化情况比较 治疗后观察组脑电图变化情况优于对照组,IEA消失或减少50%以上比例高于对照组,差异均有统计学意义(P<0.05),见表1。
表1 2组脑电图变化情况比较
Table 1 Comparison of electroencephalogram changes between two groups (n=70,例数,%)
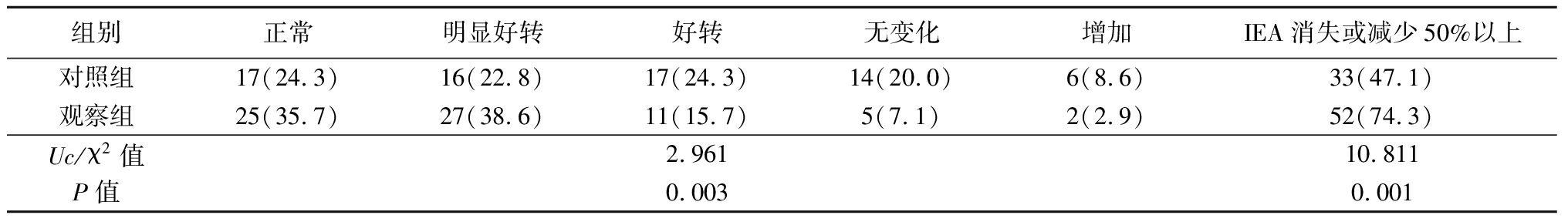
组别正常明显好转好转无变化增加IEA消失或减少50%以上对照组17(24.3)16(22.8)17(24.3)14(20.0)6(8.6)33(47.1)观察组25(35.7)27(38.6)11(15.7)5(7.1)2(2.9)52(74.3)Uc/χ2值2.96110.811P值0.0030.001
2.2 2组临床疗效比较 观察组临床疗效优于对照组,差异有统计学意义(P<0.05),2组总有效率差异无统计学意义(P>0.05),见表2~4。
表2 对照组不同发作类型癫痫治疗效果
Table 2 Therapeutic effect of different seizure types of epilepsy in control group (例数,%)
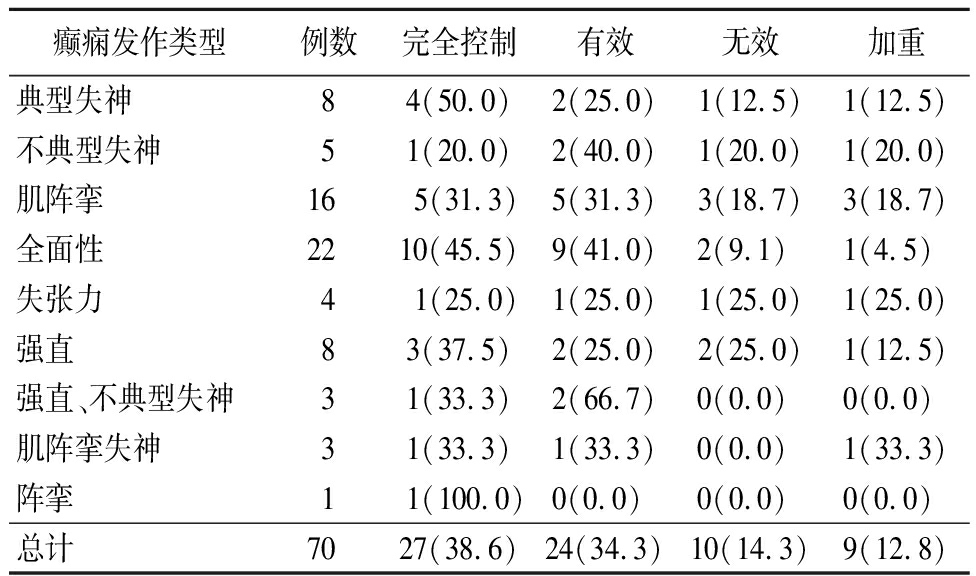
癫痫发作类型例数完全控制有效无效加重典型失神84(50.0)2(25.0)1(12.5)1(12.5)不典型失神51(20.0)2(40.0)1(20.0)1(20.0)肌阵挛165(31.3)5(31.3)3(18.7)3(18.7)全面性2210(45.5)9(41.0)2(9.1) 1(4.5) 失张力41(25.0)1(25.0)1(25.0)1(25.0)强直83(37.5)2(25.0)2(25.0)1(12.5)强直、不典型失神31(33.3)2(66.7)0(0.0) 0(0.0) 肌阵挛失神31(33.3)1(33.3)0(0.0) 1(33.3)阵挛11(100.0)0(0.0) 0(0.0) 0(0.0) 总计7027(38.6)24(34.3)10(14.3)9(12.8)
表3 观察组不同发作类型癫痫治疗效果
Table 3 Therapeutic effect of different types of epilepsy in observation group (例数,%)
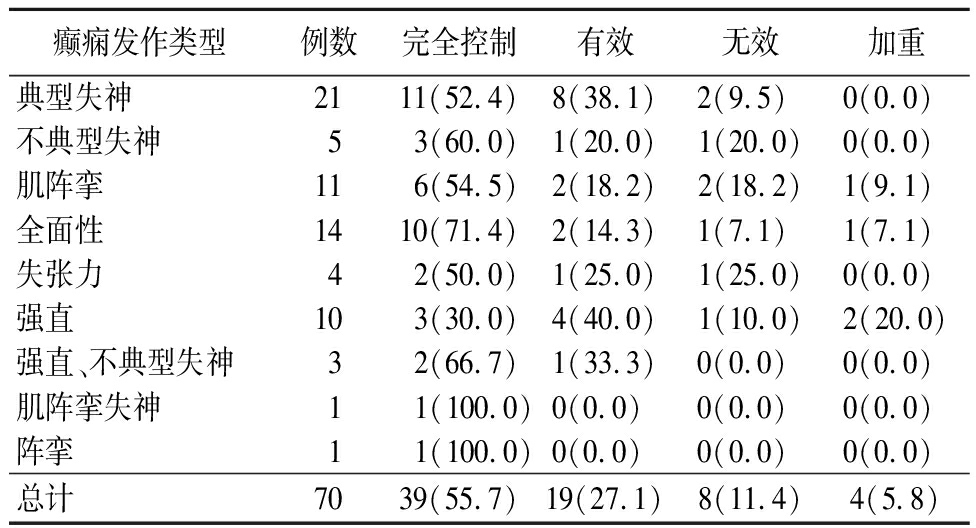
癫痫发作类型例数完全控制有效无效加重典型失神2111(52.4)8(38.1)2(9.5) 0(0.0) 不典型失神53(60.0)1(20.0)1(20.0)0(0.0) 肌阵挛116(54.5)2(18.2)2(18.2)1(9.1) 全面性1410(71.4)2(14.3)1(7.1) 1(7.1) 失张力42(50.0)1(25.0)1(25.0)0(0.0) 强直103(30.0)4(40.0)1(10.0)2(20.0)强直、不典型失神32(66.7)1(33.3)0(0.0) 0(0.0) 肌阵挛失神1 1(100.0)0(0.0) 0(0.0) 0(0.0) 阵挛1 1(100.0)0(0.0) 0(0.0) 0(0.0) 总计7039(55.7)19(27.1)8(11.4)4(5.8)
表4 2组临床疗效比较
Table 4 Comparison of clinical efficacy between two groups (n=70,例数,%)
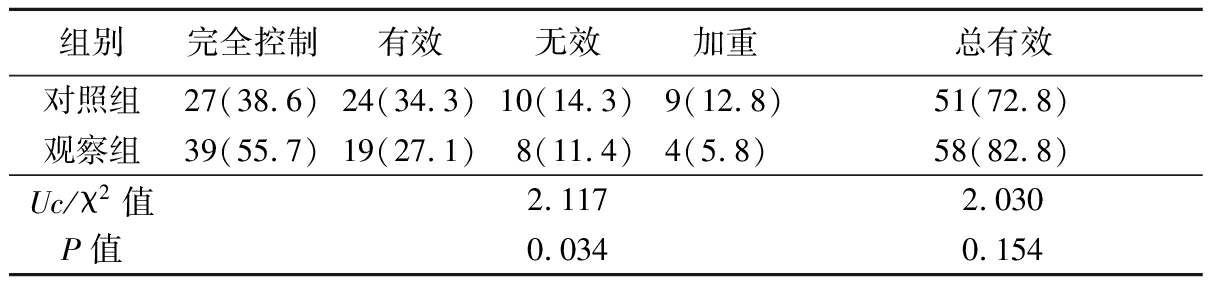
组别完全控制有效无效加重总有效 对照组27(38.6)24(34.3)10(14.3)9(12.8)51(72.8)观察组39(55.7)19(27.1)8(11.4)4(5.8) 58(82.8)Uc/χ2值2.1172.030P值0.0340.154
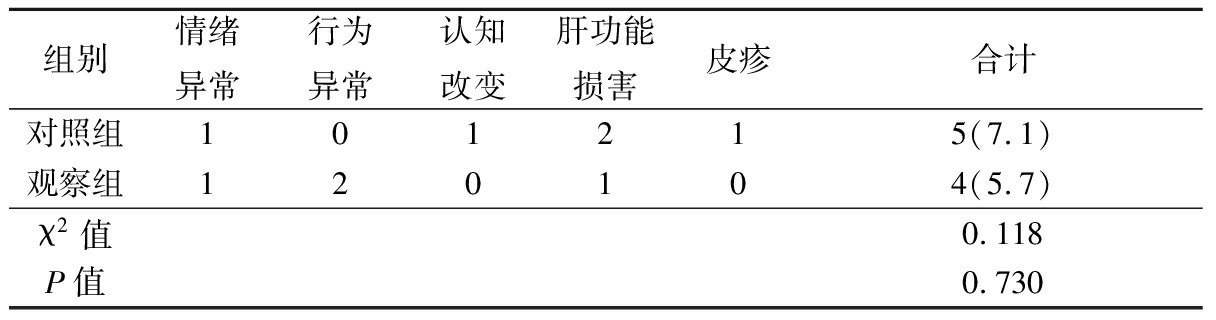
2.3 2组不良反应发生情况比较 2组不良反应发生率差异无统计学意义(P>0.05),见表5。
表5 2组不良反应发生情况比较
Table 5 Comparison of adverse reactions between two groups (n=70,例数,%)
组别情绪异常行为异常认知改变肝功能损害皮疹合计对照组101215(7.1)观察组120104(5.7)χ2值0.118P值0.730
3 讨 论
癫痫是一组慢性疾病,由中枢神经系统兴奋与抑制不平衡所致,其特点是大脑神经元突然和间歇性异常放电引起的周期性和短暂性脑功能障碍。相关研究发现,癫痫发作前的大脑结构异常、癫痫发作频率、发作时症状及发作对脑结构的损伤等多因素,均对患儿认知功能造成严重影响[14]。通过分析86例特发性全面性癫痫患者的临床资料证实,临床下IEA可导致神经损伤[15];长时间IEA对大脑高级皮层功能损伤程度远比癫痫发作更严重,尤其对认知语言的损伤,还会导致精神运动发育迟滞[16]。视频脑电图检查是记录大脑皮质神经元的电活动,可评估IEA数量、IEA所致的认知障碍和癫痫再发风险及药物疗效[2]。本研究结果显示,治疗后观察组IEA 消失或减少50%以上比例高于对照组。说明左乙拉西坦优于丙戊酸钠,与以往报道一致[17-18]。左乙拉西坦是一种吡咯烷酮衍生物,最初作为阿尔茨海默病的神经认知剂开发,与其他抗癫痫药比较,其具有一种独特的作用机制。通过与突触囊泡蛋白2A胞吐、聚合作用,调节神经递质释放,阻断神经元异常放电,发挥抗癫痫作用[19];还可通过降低癫痫患者血清胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)水平,抑制IEA,达到治疗癫痫的目的[20]。国内外研究显示,左乙拉西坦能有效地促进脑电恢复正常,改善认知功能[21-22]。
左乙拉西坦可用于单药或添加治疗2岁以内儿童部分或全面性癫痫发作[9,23];对早产儿和新生儿癫痫发作方面也是安全有效的[24-25];控制不同年龄组儿童肌阵挛发作、强直-阵挛发作和失神发作等难治性癫痫的临床有效率高[26],可有效减少儿童难治全面性癫痫发作频率[27];在单药或添加治疗儿童难治性癫痫持续状态时有较好的疗效和安全性[28-29]。本研究结果显示,在控制全面性癫痫发作频率方面,观察组临床疗效优于对照组(P<0.05),2组总有效率差异无统计学意义(P>0.05)。
另外,左乙拉西坦不与苯甲类药物、GABA或谷氨酰胺受体结合,不影响钠通道的活性,口服生物利用度高,线性代谢,无需血药浓度监测,蛋白结合率低,无肝细胞色素P450酶诱导作用,三分之二的药物通过肾脏经尿液排泄,剩余三分之一通过肝脏水解代谢[30]。本研究结果显示,对照组不良反应发生率为7.1%,观察组不良反应发生率为5.7%,主要集中在情绪、行为方面,无认知改变,2组不良反应发生率差异无统计学意义。左乙拉西坦不良反应有情绪异常、行为异常、认知改变、肝功能损害,但均较轻微,调整剂量或暂停使用后不良反应消失,未危及生命。这与刘远昌[31]、冯启蒙[32]的报道一致。
综上所述,左乙拉西坦治疗儿童各型全面性癫痫发作均有效,在改善发作间期IEA方面疗效显著,安全性良好,不良反应发生率低,左乙拉西坦对治疗全面性癫痫发作是一个有效而安全的临床选择。
[1] Klein S,Bankstahl M,Löscher W. Inter-individual variation in the effect of antiepileptic drugs in the intrahippocampal kainate model of mesial temporal lobe epilepsy in mice[J]. Neuropharmacology,2015,90:53-62.
[2] Fisher RS,Cross JH,French JA,et al. Operational classification of seizure types by the International League Against Epilepsy: Position Paper of the ILAE Commission for Classification and Terminology[J]. Epilepsia,2017,58(4):522-530.
[3] 涂雪松.癫痫的流行病学研究[J].脑与神经疾病杂志,2017,25(8):522-528,后插1页.
[4] 秦璇,姜泓.振幅整合脑电图在新生儿脑损伤中的应用进展[J].中国综合临床,2018,34(3):284-288.
[5] Smits LL,Liedorp M,Koene T,et al. EEG abnormalities are associated with different cognitive profiles in Alzheimer′s disease[J]. Dement Geriatr Cogn Disord,2011,31(1):1-6.
[6] 袁肖征,余勇,赵学敏.奥卡西平对部分性发作癫痫病人认知功能以及脑电图的影响[J].中西医结合心脑血管病杂志,2016,14(11):1288-1290.
[7] 赵进方.托吡酯片治疗小儿癫痫的随访结果观察[J].临床医学,2016,36(1):107-108.
[8] 李兴广.左乙拉西坦治疗儿童难治性癫痫临床疗效及对血清lgA、lgG和lgM水平的影响[J].脑与神经疾病杂志,2018,26(1):40-43.
[9] 叶高波,董建鹏,李丹,等.左乙拉西坦治疗2岁以下婴幼儿癫痫有效性及安全性研究[J].中国儿童保健杂志,2017,25(10):1041-1044.
[10] 武运红,韩虹,唐宇辉,等.左乙拉西坦口服液单药治疗婴儿期癫痫临床分析及随访研究[J].中国药物与临床,2015,15(1):121-122.
[11] 宋双双.1943例儿童癫痫病因及其与癫痫性脑病的相关性分析[D].青岛:山东大学,2017.
[12] 张双,金超,张静,等.左乙拉西坦、奥卡西平对部分性发作癫痫患儿的临床疗效及脑电图的影响[J].中国妇幼保健,2015,30(32):5679-5681.
[13] 李世敬,来华安.不同药物治疗部分性发作癫痫疗效及对脑电图的影响[J].西南国防医药,2016,26(11):1236-1238.
[14] 王加朋,梁彩艳.丙戊酸钠、奥卡西平与左乙拉西坦分别治疗小儿癫痫的疗效及对认知功能的影响[J].药物评价研究,2017,40(5):687-690.
[15] 李娜,宋玉成.临床下痫样放电对癫痫患者认知功能及胰岛素样生长因子1水平的影响[J/CD].中华脑科疾病与康复杂志:电子版,2015,5(4):218-221.
[16] Licht EA,Jacobsen RH,Fujikawa DG. Chronically impaired frontal lobe function from subclinical epiletiform discharges [J]. Epilepsy Behav,2002,3(1):96-100.
[17] 满丽娜,王坤,栾馥.左乙拉西坦联合奥卡西平治疗小儿癫痫的效果、不良反应及脑电图改善情况[J].实用临床医药杂志,2017,21(1):174-175.
[18] 王玉平.临床实践中足量使用左乙拉西坦的专家指导意见[J].中华医学信息导报,2016,31(4):21.
[19] 王凯旋,张静,盛放,等.左乙拉西坦联合家庭式干预治疗儿童癫痫的疗效分析[J].中华全科医学,2016,14(12):2063-2066.
[20] 赵国华,张红丽.左乙拉西坦治疗癫痫患者的应用效果及对GFAP、脑电波的影响研究[J].河北医药,2018,40(4):600-602.
[21] 侯蕴祈,麦慧玲,石海琴,等.左乙拉西坦治疗部分性癫痫发作121例的临床疗效及对脑电图的影响[J].脑与神经疾病杂志,2016,24(3):177-180,181.
[22] 夏敏,武士京,孔庆霞,等.左乙拉西坦添加治疗成人难治性癫痫部分性发作的临床疗效和脑电图分析[J].中风与神经疾病杂志,2015,32(2):168-170.
[23] 张奇.左乙拉西坦单药治疗不同类型小儿癫痫疗效与安全性观察[J].中国实用医药,2016,11(4):130-131.
[24] Han JY,Moon CJ,Youn YA,et al. Efficacy of levetiracetam for neonatal seizures in preterm infants[J]. BMC Pediatr,2018,18(1):131.
[25] McHugh DC,Lancaster S,Manganas LN. A systematic review of the efficacy of levetiracetam in neonatal seizures[J]. Neuropediatrics,2018,49(1):12-17.
[26] 朱秀云,陈秀敏.左乙拉西坦添加治疗儿童难治性癫痫的临床疗效观察[J].中国病案,2018,19(4):107-109.
[27] 唐红平,汪明辉,翦爱,等.左乙拉西坦片治疗儿童难治性癫痫的临床研究[J].中国临床药理学杂志,2017,33(22):2247-2249.
[28] 王波,黄艳,卢玉琳,等.左乙拉西坦治疗儿童难治性癫痫持续状态的疗效及耐受性分析[J].海峡药学,2015,27(6):246-247.
[29] 王玉珍,洪源,刘艳芹,等.左乙拉西坦添加治疗儿童难治性癫痫的疗效和安全性[J].临床荟萃,2014,29(8):942-943.
[30] Agrawal A,Banergee A. A Review on Pharmacokinetics of Levetiracetam in Neonates[J]. Curr Drug Metab,2017,18(8):727-734.
[31] 刘远昌.两种抗癫痫单药方案对部分性发作癫痫患儿临床疗效及安全性[J].临床军医杂志,2017,45(11):1171-1173.
[32] 冯启蒙.左乙拉西坦在婴儿癫痫治疗中的疗效及安全性探讨[J].中国实用神经疾病杂志,2018,21(7):746-749.