糖尿病是威胁人类健康导致死亡的主要疾病之一,随着糖尿病病程延长,病情进展,常伴有各种并发症[1-2]。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一,是指在除外其他疾病的情况下,糖尿病患者所患的与周围神经功能障碍有关的病变[3-4]。DPN患者的起病多隐匿,早期多表现为肢端感觉异常、肢体麻木,后期可出现运动神经受累和肌力减退甚至肌肉萎缩[5]。DPN的发病机制尚未完全明确,氧化应激可能通过微血管损害影响神经微循环,从而减弱受损神经纤维的再生能力,形成DPN。DPN的临床表现复杂多样,而且病情分级改变的严重性与症状不一定具有相关性[6-7]。近年来神经电生理检查手段的日益更新和完善,具有客观敏感、简便易行等优点,越来越广泛地应用于DPN的早期诊断中[8]。有研究应用肌电图诱发电位仪检测有症状的神经病变患者,发现其波幅减低,并证实波幅改变与皮肤活组织检查的表皮层神经纤维密度呈正相关,可使相关肌纤维神经损害[9-11]。但是在DPN的应用尚无相关报道。本研究分析DPN不同临床病情分级的神经电生理特点,旨在探讨神经电生理检测方法在早期诊断DPN中的价值,现报告如下。
1 资料与方法
1.1 一般资料 选择2015年1月—2016年12月在我院就诊的DPN患者90例作为观察组,均符合DPN的诊断标准。排除标准:①并发其他原因所致的神经病变者;②有严重肝、肾功能障碍者;③有出血倾向或已有出血症状者;④接受影响神经功能的药物治疗者;⑤妊娠与哺乳期妇女。观察组男性48例,女性42例;年龄28~79岁,平均(65.22±5.29)岁;体重指数23.11±2.49;病程(6.39±2.19)年。另选择同期健康体检者90例作为对照组,男性45例,女性45例;年龄26~81岁,平均(66.72±4.12)岁;体重指数22.41±3.11;无神经系统阳性体征、无皮肤疾病及神经系统疾病史。2组性别、年龄、体重指数差异均无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理委员会批准;患者或家属均签署知情同意书。
1.2 DPN病情分级 多伦多临床评分系统包括神经症状、神经反射、感觉功能检查评分三部分。①神经症状包括下肢麻木、疼痛、针刺样感觉、乏力、步态不稳、上肢相似症状,正常计0分,每个症状计1分; ②神经反射包括踝反射、膝反射,为双侧计分,正常计0分,减弱计1分,消失计2分; ③感觉功能检查包括右侧踇趾痛觉、温度觉、触压觉、振动觉、位置觉,正常计0分,异常计1分。6~8分者为轻度DPN(Ⅰ级),9~11分者为中度DPN(Ⅱ级),l2~14分者为重度DPN(Ⅲ级),14~19分者为超重度DPN(Ⅳ级)。
1.3 神经电生理检测 所有入选者在安静房间(室温22~25 ℃)取平卧位,选择英国MedelecSynergy 5通道肌电图诱发电位仪,用表面电极进行神经传导测定,主要测定正中神经的运动神经传导速度、远端潜伏期和波幅等。皮肤交感反应(sympathetic skin response,SSR)通过突然的电刺激诱发汗腺活动记录,其中潜伏期的测定为刺激开始至第一个负相波的起始点,正常值标准参照北京协和医院肌电图室的标准。躯体感觉诱发电位(somatosensory evoked potential,SEP)取双侧正中神经进行刺激,记录上肢与下肢的SEP异常情况,正常值标准参照北京协和医院肌电图室的标准。
1.4 统计学方法 应用SPSS 20.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验和F检验;计数资料比较采用χ2检验;相关性采用直线相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组神经传导结果比较 观察组运动神经传导速度、波幅明显小于对照组,远端潜伏期较对照组明显增加(P<0.05),见表1。
表1 2组神经传导结果比较
Table 1 Comparison of nerve conduction results between two groups ![]()
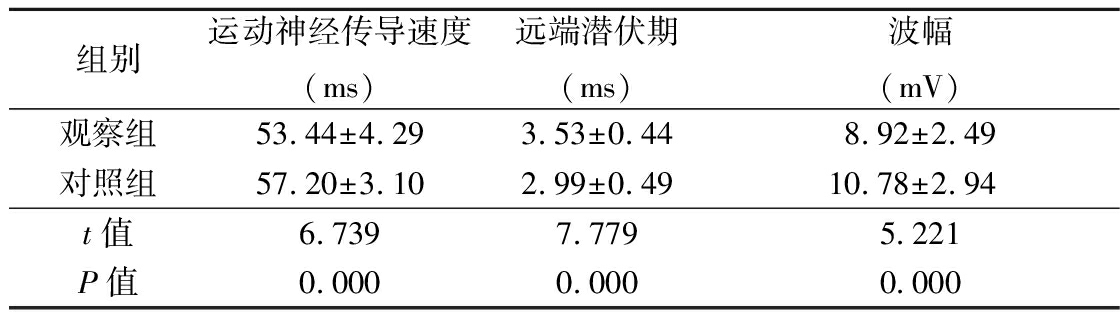
组别运动神经传导速度(ms)远端潜伏期(ms)波幅(mV)观察组53.44±4.293.53±0.448.92±2.49对照组57.20±3.102.99±0.4910.78±2.94t值6.7397.7795.221P值0.0000.0000.000
2.2 2组SSR和SEP异常情况比较 观察组SSR、上肢SEP和下肢SEP异常率较对照组明显增加(P<0.05),见表2。
2.3 神经电生理指标与DPN病情分级的相关性 DPN患者中Ⅰ级45例,Ⅱ级20例,Ⅲ级15例,Ⅳ级10例。随着DPN病情加重,运动神经传导速度、波幅均明显减小,远端潜伏期以及SSR、上肢SEP、下肢SEP异常率均明显增加(P<0.05),见表3。
表2 2组SSR和SEP异常情况比较
Table 2 Comparison of SSR and SEP abnormalities between two groups (n=90,例数,%)
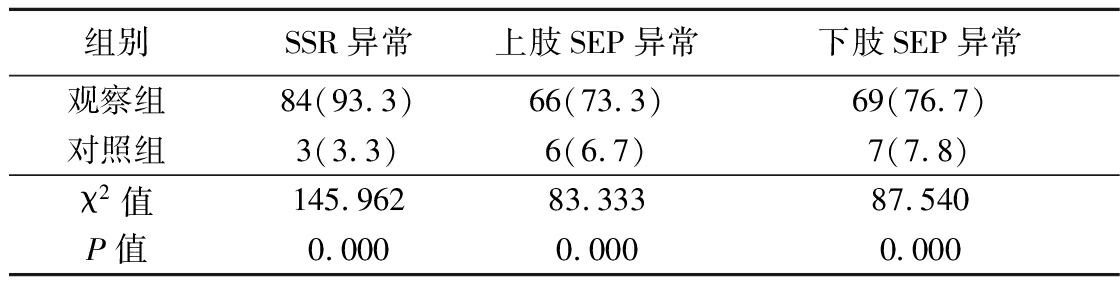
组别SSR异常上肢SEP异常下肢SEP异常观察组84(93.3)66(73.3)69(76.7)对照组3(3.3)6(6.7)7(7.8)χ2值145.96283.33387.540P值0.0000.0000.000
表3 不同DPN病情分级患者神经电生理指标比较
Table 3 Comparison of electrophysiological parameters in patients with different DPN grades
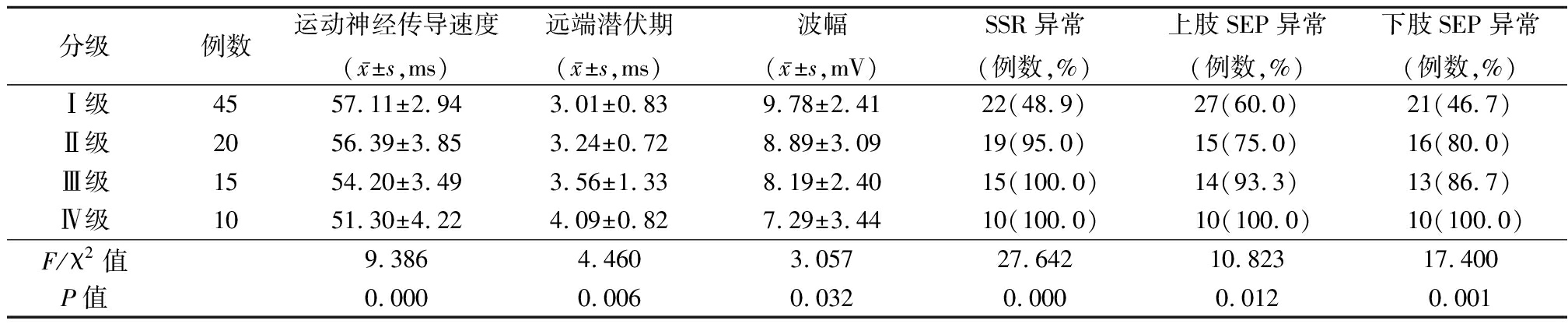
分级例数运动神经传导速度(x-±s,ms)远端潜伏期(x-±s,ms)波幅(x-±s,mV)SSR异常(例数,%)上肢SEP异常(例数,%)下肢SEP异常(例数,%)Ⅰ级4557.11±2.943.01±0.839.78±2.4122(48.9)27(60.0)21(46.7)Ⅱ级2056.39±3.853.24±0.728.89±3.0919(95.0)15(75.0)16(80.0)Ⅲ级1554.20±3.493.56±1.338.19±2.4015(100.0)14(93.3)13(86.7)Ⅳ级1051.30±4.224.09±0.827.29±3.4410(100.0)10(100.0)10(100.0)F/χ2值9.3864.4603.05727.64210.82317.400P值0.0000.0060.0320.0000.0120.001
2.4 直线相关分析 DPN病情分级与运动神经传导速度、波幅呈负相关,与远端潜伏期、SSR、上肢SEP和下肢SEP呈正相关(P<0.05),见表4。
表4 神经电生理指标与DPN病情分级的相关性
Table 4 Correlation between neurophysiological parameters and DPN grades of disease
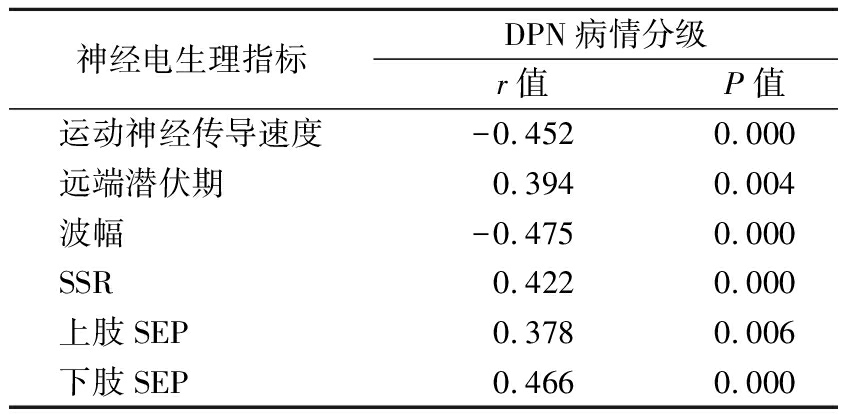
神经电生理指标DPN病情分级r值P值运动神经传导速度-0.4520.000远端潜伏期0.3940.004波幅-0.4750.000SSR0.4220.000上肢SEP0.3780.006下肢SEP0.4660.000
3 讨 论
当前我国糖尿病患病率明显增加,DPN是糖尿病的常见并发症,发病率高达20.0%[12]。DPN早期起病隐匿,进展缓慢,主要为感觉神经受累,是导致足部溃疡、感染和截肢的主要原因之一。DPN 的发病原因不明,大多数学者提出以下几种发病原因:①机体代谢紊乱,机体糖脂代谢紊乱可以使多元醇途径代谢亢进、糖化终末产物形成、肌醇代谢异常等机制引起神经功能障碍;②氧化应激,血糖异常升高,可以使非酶促糖基化作用加强,产物糖胺自身氧化产生氧自由基,利用多种途径使得周围神经功能受损,进而发展为神经营养障碍,导致DPN;③血管因素,DNP发生的另外一个重要因素是血管管壁的异常情况,血管管壁的顺应性改变是导致DNP的一个非常重要的作用。血糖持续波动较大,动脉管壁硬化、狭窄、闭塞等,神经周围的组织灌注不足,缺血、缺氧、坏死,导致周围神经病的发生。脱髓鞘、轴索变性等情况是神经纤维在缺血、缺氧的环境下发生的。高血糖引起微血管病变在临床上越来越常见,其导致的DPN是多重原因的,通过一系列复杂的机制导致神经功能异常。神经营养因子、遗传因素、免疫因素、亚麻酸缺乏、蛋白激酶C活性异常等也是最近研究的重点,上述因子对DPN的发生发展有一定的影响[13-14]。DPN迄今尚无有效的治疗方法,故对其进行早期诊断、早期预防尤为重要。
目前对DPN的诊断主要依靠糖尿病病史、神经损害症状及电生理的异常表现,近年来随着神经电生理检查手段的日益更新和完善,神经电生理指标被越来越广泛地应用于DPN的诊断[15]。在常规神经电生理检测指标中,SSR、SEP的应用比较多见,其中SSR生物学机制是多突触的交感反射,不同刺激方式的传入途径不同,可由内源性或外源性刺激引起,可反映小纤维和自主神经小纤维的变化情况[16-17]。SSR是人体在接受刺激后引起交感神经系统活动所记录到的表皮电压变化,可早期发现DPN患者交感神经小纤维损害情况,其灵敏度优于感觉神经传导速度及运动神经传导速度[18]。本研究结果显示,观察组SSR、上肢SEP和下肢SEP异常率较对照组明显增加。表明SEP、SSR是有价值的早期诊断DPN的方法,对评价交感神经功能障碍是非常实用的。虽然可对糖尿病中枢神经损害进行评价,但是其检测结果正常不能排除器质性病变[19]。
在神经电生理检测中,肌电图诱发电位仪主要反映躯体深感觉传导通路的功能,可对累及体感通路的病变进行定位,是DPN临床检查的延伸[20-21]。本研究结果显示,观察组运动神经传导速度、波幅明显低于对照组,远端潜伏期明显高于对照组。有研究表明,DPN患者的临床体征与神经传导速度减慢程度相关,DPN可出现弥漫性传导异常,但通常以远端神经异常程度更严重[22]。同时DPN在早期往往以小纤维受累为主,这可能是在某些患者尽管有DPN的症状体征,但常规神经传导检测正常的原因[23]。
本研究结果显示,随着DPN病情分级加重,运动神经传导速度、波幅明显减小,远端潜伏期以及SSR、上肢SEP、下肢SEP异常率明显增加(P<0.05);DPN病情分级与运动神经传导速度、波幅呈负相关,与远端潜伏期、SSR、上肢SEP和下肢SEP呈正相关(P<0.05)。提示DPN存在着明显的脱髓鞘改变,也存在明确的轴索变性,感觉神经动作电位波幅较传导速度灵敏度更高,感觉传导各参数主要可受病情分级的影响。也表明神经电生理指标还可以反映神经病变的严重程度,诱发电位的波幅反映了轴索损伤程度,神经传导速度反映了神经髓鞘的完整性[24-25]。
综上所述,神经电生理指标可提高DPN的确诊率,并反映患者的病情状况,有助于DPN的早期发现和治疗。
[1] Yeh HC,Brown TT,Maruthur N,et al. Comparative effectiveness and safety of methods of insulin delivery and glucose monitoring for diabetes mellitus:a systematic review and meta-analysis[J]. Ann Intern Med,2012,157(5):336-347.
[2] 车春晖,魏笑凡,黄华品,等.糖尿病周围神经病患者神经电生理与临床症状相关分析[J].中华全科医师杂志,2016,15(5):366-370.
[3] Trivedi JR,Phillips L,Chhabra A. Hereditary and acquired polyneuropathy conditions of the peripheral nerves: clinical considerations and MR neurography imaging[J]. Semin Musculoskelet Radiol,2015,19(2):130-136.
[4] Morales-Vidal S,Morgan C,McCoyd M,et al.Diabetic peripheral neuropathy and the management of diabetic peripheral neuropathic pain[J]. Postgrad Med,2012,124(4):145-153.
[5] Deshmukh V,Deshmukh C.Achieving good glycaemic control-effective use of self monitoring of blood glucose(SMBG) [J]. J Indian Med Assoc,2012,110(3):161-163.
[6] 杨丹,鲍海萍,黄山.糖尿病周围神经病变患者的电生理检查结果及患病危险因素分析[J].中国糖尿病杂志,2016,24(6):540-542.
[7] Witzel II,Jelinek HF,Khalaf K,et al. Identifying common genetic risk factors of diabetic neuropathies[J]. Front Endocrinol(Lausanne),2015,6:88.
[8] 李蕾,张红霞,李清楚,等.运动诱发电位对2型糖尿病马尾神经近端损害的诊断价值[J].郑州大学学报:医学版,2016,51(3):401-405.
[9] Misra SL,Craig JP,Patel DV,et al. In vivo confocal microscopy of corneal nerves: an ocular biomarker for peripheral and cardiac autonomic neuropathy in type 1 diabetes mellitus[J]. Invest Ophthalmol Vis Sci,2015,56(9):5060-5065.
[10] Cheng C,Kobayashi M,Martinez JA,et al. Evidence for epigenetic regulation of gene expression and function in chronic experimental diabetic neuropathy[J]. J Neuropathol Exp Neurol,2015,74(8):804-817.
[11] 庞国明,郑晓东,朱璞,等.糖尿病周围神经病变的中医证型与神经电生理的相关性研究[J].中医临床研究,2014,6(33):17-20.
[12] Wiessman MP,Liberty IF,Segev RW,et al. Clinical characteristics and survival of patients with diabetes mellitus following non-traumatic lower extremity amputation[J]. Isr Med Assoc J,2015,17(3):145-149.
[13] Yan LH,Mu B,Guan Y,et al. Assessment of the relationship between non-alcoholic fatty liver disease and diabetic complications[J]. J Diabetes Investig,2016,7(6):889-894.
[14] 张娜,段伟松,高长玉.糖尿病周围神经病病情分级与电生理的相关性[J].脑与神经疾病杂志,2010,18(6):436-438.
[15] Won JC,Park TS. Recent Advances in Diagnostic Strategies for Diabetic Peripheral Neuropathy[J]. Endocrinol Metab (Seoul),2016,31(2):230-238.
[16] Erbas O,Oltulu F,Ylmaz M,et al. Neuroprotective effects of chronic administration of levetiracetam in a rat model of diabetic neuropathy[J]. Diabetes Res Clin Pract,2016,114:106-116.
[17] 朱祖福,张慧萍,孔玉,等.以眩晕失衡为主要表现的糖尿病神经病变30例分析[J].中国实用神经疾病杂志,2016,19(1):108-109.
[18] Chiu YC,Liao WT,Liu CK,et al. Reduction of spinal glycine receptor-mediated miniature inhibitory postsynaptic currents in streptozotocin-induced diabetic neuropathic pain[J]. Neurosci Lett,2016,611:88-93.
[19] 刘平.TCSS评分在2型糖尿病周围神经病变筛查和治疗中的应用[J].海南医学,2012,23(17):21-23.
[20] Pitarokoili K,Kerasnoudis A,Behrendt V,et al. Facing the diagnostic challenge: Nerve ultrasound in diabetic patients with neuropathic symptoms[J]. Muscle Nerve,2016,54(1):18-24.
[21] Xu ZZ,Kim YH,Bang S,et al. Inhibition of mechanical allodynia in neuropathic pain by TLR5-mediated A-fiber blockade[J]. Nat Med,2015,21(11):1326-1331.
[22] Kharatmal SB,Singh JN,Sharma SS. Calpain inhibitor,MDL 28170 confer electrophysiological,nociceptive and biochemical improvement in diabetic neuropathy[J]. Neuropharmacology,2015,97:113-121.
[23] 白亚娟,方桂珍.临床症状积分表在糖尿病周围神经病变筛查中的应用价值[J].解放军护理杂志,2015,32(4):20-22,26.
[24] Lovblom LE,Halpern EM,Wu T,et al. In vivo corneal confocal microscopy and prediction of future-incident neuropathy in type 1 diabetes: a preliminary longitudinal analysis[J]. Can J Diabetes,2015,39(5):390-397.
[25] Petropoulos IN,Ferdousi M,Marshall A,et al. The inferior whorl for detecting diabetic peripheral neuropathy using corneal confocal microscopy[J]. Invest Ophthalmol Vis Sci,2015,56(4):2498-2504.