血脑屏障在中枢神经系统物质交换及内环境稳定中有着重要作用,其结构主要包括微血管内皮细胞及其间紧密连接、内皮基膜及星形胶质细胞终足[1-2]。一旦神经系统受到缺血再灌注损伤,血管内皮细胞及紧密连接受损是血脑屏障的主要病理生理变化[3]。当Toll样受体4(Toll like receptor 4,TLR4)受到微生物或缺血损伤信号激动时,导致其下游一系列炎症信号的激活,从而诱发免疫炎性反应[4]。在正常组织细胞中,基质金属蛋白酶(matrix metalloprotein,MMP)能够有效降解细胞外基质,其中MMP-2和MMP-9是MMP家族的重要成员,可破坏内皮细胞间的紧密连接,加重脑水肿的形成,并能进一步诱发炎性细胞在缺血脑组织的聚集增加,导致血管内皮细胞凋亡[5-6]。既往研究表明,抑制TLR4-MMP-2/MMP-9信号通路在心肌细胞缺血再灌注损伤中的激活,可有效减少心肌梗死的面积[7]。本研究通过人脐静脉内皮细胞接受氧糖剥夺-复糖复氧模型,模拟在体内的血脑屏障缺血再灌注损伤,探讨与TLR4-MMP-2/MMP-9信号通路激活的关系,旨在为减少血脑屏障损伤提供理论依据。
1 材料与方法
1.1 细胞培养及分组 人脐静脉内皮细胞株HUVEC-12购自于美国ATCC公司,使用含10%胎牛血清+1%双抗的DMEM培养基于37 ℃、5%CO2培养箱(Thermo,美国)中进行细胞培养。当细胞融合至80%时,用0.05%胰酶(含0.02%乙二胺四乙酸)(Hyelone,美国)消化传代。采用随机数字表法将HUVEC-12分为4组(n=36),对照组(C组),氧糖剥夺组(O组),TAK242+氧糖剥夺组(TO组),CCT+氧糖剥夺处理组(MO组),其中TAK242为受体TLR4的特异性阻断剂,CCT为MMP-2/MMP-9的特异性抑制剂。
1.2 氧糖剥夺模型的建立 O、OS、OPS和OP组细胞PBS缓冲液洗涤细胞3次,并更换为无糖培养基BBS(NaCl 116 mmol/L,KCl 5.4 mmol/L, MgSO4 0.8 mmol/L,NaH2PO4 1.0 mmol/L,NaHCO3 26.2 mmol/L,CaCl2 1.8 mmol/L,glycine 0.02 mmol/L,phenol red 2 mg/L),向培养基中持续以2 L/min的速度通入100% N2 30 min达到无氧状态,置入低氧培养箱(Thermo,美国),低氧培养箱持续输入95% N2和5% CO2以维持无氧状态。氧糖剥夺6 h后,将细胞于低氧培养箱中取出,并更换成为原10%胎牛血清+1%双抗的DMEM培养基,37 ℃、5%CO2细胞培养箱内继续培养24 h。氧糖剥夺处理前1 h,向TO和MO组HUVEC-12培养基内分别加入TLR4特异性阻断剂TAK242(10 mmol/L,批号HY-11109,MCE公司,美国)和MMP-2/MMP-9抑制剂CCT(200 mg/L,广州杰特伟公司)。C组HUVEC细胞仅使用PBS缓冲液洗涤3次,正常条件下培养。
1.3 凋亡率测定 每组取6孔,Annexin V-FITC/PI免疫荧光法测定细胞凋亡程度。各组HUVEC-12细胞经0.05%胰酶消化后收获,于200 μL的PBS缓冲液中重悬;加入5 μL Annexin V-FITC试剂,避光室温孵育 15 min; 加入10 μL PI(50 μg/mL),补加缓冲液200 μL,应用FACS420型流式细胞仪(Becton Dickinson公司,美国)检测,检测荧光强度值,以百分比表示凋亡率,实验重复3次并取均值。
1.4 存活率的测定 每组取6孔,采用四甲基偶氮唑(MTT)法测定神经元存活率。在96孔板内每孔加入MTT(5 mg/mL)20 μL,37 ℃、5%CO2细胞培养箱内孵育4 h,弃上清并使用PBS缓冲液洗涤(3次),100 mL DMSO加入至每孔,振荡器上振荡10 min后,使用酶标仪在490 nm波长处测定各孔吸光度(A值),并以相对应的C组作为对照组,以百分比反映HUVEC-12细胞的存活率,实验重复3次并取均值。
1.5 电阻值的测定 每组取6孔,将HUVEC-12细胞按照1.0×105/cm2接种于细胞小室(Transwell) 24孔板,上室300 μL培养基,下室700 μL培养基。Transwell中HUVEC-12细胞培养4 d达到完全融合,将细胞培养基换成上述氧糖剥夺培养基,在低氧培养箱中接受氧糖剥夺6 h后,更换为正常DMEM培养基,并于37 ℃、5%CO2培养箱内继续培养24 h;TO和MO组HUVEC-12细胞分别在氧糖剥夺前接受TAK242和CCT处理1 h。应用EVOM2电阻仪(Millipore公司,美国)检测跨内皮电阻,通过减去没有接种HUVEC-12细胞的Transwell小室膜跨内皮电阻值,得到该小孔HUVEC-12细胞的跨内皮电阻值,实验重复3次并取均值。
1.6 渗透性的测定 每组取6孔,比照电阻值的测定,HUVEC-12细胞在Transwell培养至4 d开始实验。在Transwell上室中加入终浓度为1 mg/mL的葡聚糖-FITC的无糖培养基200 μL,下室加入无糖培养基700 μL,氧糖剥夺6 h后,置于37 ℃、5%CO2培养箱内继续培养。24 h后将下池内的样品100 μL滴定于96孔板中,酶标仪(ELX800,BioTek公司,美国)测定荧光强度,其中激发波长为490 nm,发射波长为 520 nm,通过葡聚糖-FITC的荧光强度反应渗透性,实验重复3次并取均值。
1.7 TNF-α和IL-1β测定 每组取6孔,采用ELISA法测定TNF-α和IL-1β浓度。PBS缓冲液洗涤6孔板内的HUVEC-12细胞,并加入细胞裂解液和蛋白酶抑制剂(上海碧云天生物科技有限公司)充分研磨,4 ℃下离心30 min(12 000 r/min,离心半径为7 cm),取上清液进行BCA蛋白定量。根据ELISA试剂盒(Biosource International公司,美国)说明书,行TNF-α和IL-1β浓度测定:分别加入生物素化的TNF-α和IL-1β抗体工作液、酶结合工作液及显色剂,25℃避光孵育90 min,终止反应后液PBS缓冲液洗涤,酶标仪测量OD450,根据标准品的A值绘制蛋白标准曲线计算样品浓度,结果以pg/g表示,实验重复3次并取均值。
1.8 Western blot检测 每组取6孔,采用蛋白免疫印迹法测定MMP-2、MMP-9表达水平。按ELISA法获得总蛋白,每孔内加入各组蛋白样品30 μg,6% SDS-PAGE中电流恒定电泳,使用半干法电压恒定将蛋白由SDS-PAGE转至PVDF膜,TBST洗涤PVDF膜后,25 ℃脱脂奶粉封闭孵育1 h,TBST洗涤PVDF膜。37 ℃下PVDF膜兔抗大鼠MMP-2、MMP-9多克隆抗体(1∶1 000,Abcam,美国)中孵育1 h,TBST洗涤PVDF膜,山羊抗兔二抗(1∶1 000,Abcam,美国)25 ℃下孵育1 h,TBST洗涤PVDF膜,ECL化学法发光,内参蛋白为GADPH。
1.9 统计学方法 应用SPSS 11.5统计软件处理数据。计量资料比较分别采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
O组、TO组和MO组凋亡率、荧光强度、TNF-α浓度、IL-1β浓度、MMP-2和MMP-9表达均高于C组,TO组和MO组高于O组,MO组又高于TO组,差异有统计学意义(P<0.05);O组、TO组和MO组存活率、电阻值均低于C组, TO组和MO组存活率、电阻值均高于O组,MO组低于TO组,差异有统计学意义(P<0.05)。见表1,图1。
表1 4组HUVEC-12细胞凋亡率、存活率、电阻值、葡聚糖-FITC荧光强度、TNF-α、IL-1β、MMP-2和MMP-9表达比较
Table 1 Comparison of apoptosis,viability,resistance value,Dextran-FITC fluorescence,TNF-α,IL-1β,MMP-2 and MMP-9 among groups ![]()
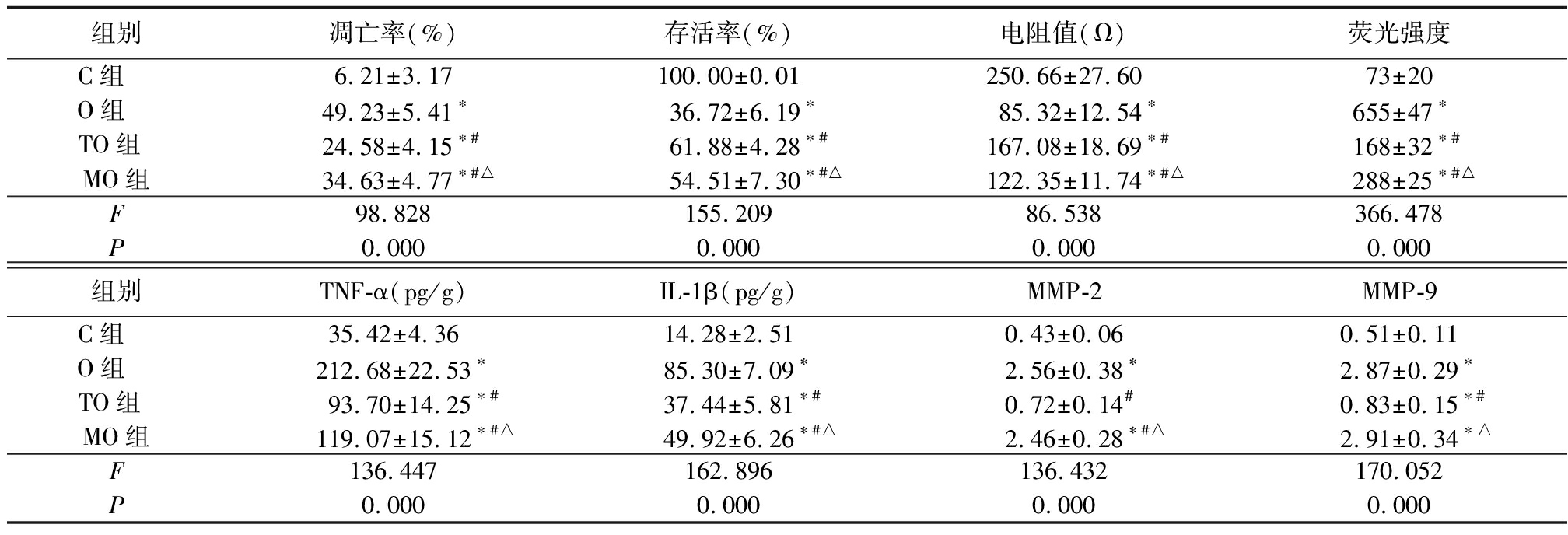
组别凋亡率(%)存活率(%)电阻值(Ω)荧光强度C组 6.21±3.17100.00±0.01250.66±27.6073±20O组 49.23±5.41∗36.72±6.19∗85.32±12.54∗655±47∗TO组 24.58±4.15∗#61.88±4.28∗#167.08±18.69∗#168±32∗#MO组34.63±4.77∗#△54.51±7.30∗#△122.35±11.74∗#△288±25∗#△F98.828155.20986.538366.478P0.0000.0000.0000.000组别TNF-α(pg/g)IL-1β(pg/g)MMP-2MMP-9C组 35.42±4.3614.28±2.510.43±0.060.51±0.11O组 212.68±22.53∗85.30±7.09∗2.56±0.38∗2.87±0.29∗TO组 93.70±14.25∗#37.44±5.81∗#0.72±0.14#0.83±0.15∗#MO组119.07±15.12∗#△49.92±6.26∗#△2.46±0.28∗#△2.91±0.34∗△F136.447162.896136.432170.052P0.0000.0000.0000.000
*P值<0.05与C组比较 #P值<0.05与O组比较 △P值<0.05与TO组比较(SNK-q检验)
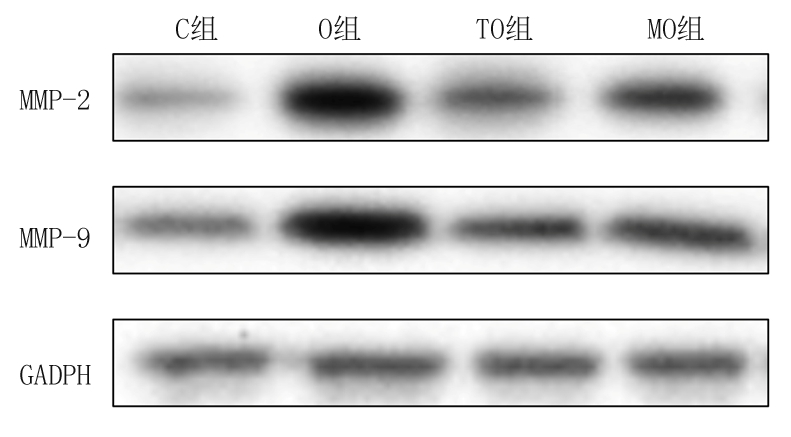
图1 4组HUVEC-12细胞MMP-2和MMP-9表达
Figure 1 Expression of MMP-2 and MMP-9 in four groups of HUVEC-12 cells
3 讨 论
人脐静脉内皮细胞是研究血脑屏障相关病理生理变化的常用体外细胞培养模型[8],本研究根据既往文献报道,采用氧糖剥夺6 h-复糖复氧 24 h模型模拟在体缺血再灌注损伤[9-10]。在正常存活的细胞内侧存在磷脂酰丝氨酸,当细胞处于凋亡早期阶段时,位于内侧的磷脂酰丝氨酸可表达在细胞膜外侧。Annexin V作为一种Ca2+依赖性磷脂结合蛋白,通过与磷脂酰丝氨酸特异性结合,从而显示处于凋亡早期的细胞;PI无法进入活细胞,故坏死细胞PI染色为阳性,而凋亡细胞则为PI染色弱阳性或者阴性,Annexin V联合PI染色能够准确反映细胞凋亡的情况[11-12]。琥珀酸脱氢酶催化四甲基偶氮唑形成不溶于水的蓝紫结晶甲瓒,可在490 nm波长处有吸收峰值,而琥珀酸脱氢酶是线粒体内重要的三羧酸循环链催化酶,故可以反映存活细胞的生长程度[13]。本研究结果显示,人脐静脉内皮细胞HUVEC-12在接受氧糖剥夺处理6 h,复氧复糖24 h后能够Annexin V阳性/PI阴性或弱阳性HUVEC-12细胞的比例显著升高,MTT处理后在490 nm波长的吸收值明显下降。表明氧糖剥夺-复糖复氧可增加人脐静脉内皮细胞的凋亡率,降低存活率,模型能够反映血脑屏障受到缺血再灌注损伤时的凋亡情况。
血脑屏障的结构功能基础包括血管内皮细胞之间的紧密连接等,而细胞间的紧密连接具有稳定血管内胶渗压和血管张力的作用,还可选择性通过循环的中的某些免疫细胞的作用[14]。测定细胞间电阻值及渗透性是评价紧密连接形成程度的重要方法[15-16]。本研究采用细胞小室(Transwell)法构建HUVEC-12细胞紧密连接模型,显示氧糖剥夺-复糖复氧能够有效降低细胞间电阻值,增加渗透性,氧糖剥夺-复糖复氧模型对人脐静脉内皮细胞之间的紧密连接具有损伤作用。表明缺血再灌注损伤可通过损伤细胞间的紧密连接破坏血脑屏障的完整性。
TLR4是细胞发生免疫炎症反应被激活时的重要受体分子。已有研究表明,离体心肌细胞缺血再灌注损伤模型中发现抑制受体TLR4的激活可有效抑制IL-1β和TNF-α的表达,减少心肌细胞的坏死和凋亡[17]。MMP-2和MMP-9作为TLR4下游重要的信号分子,已有研究证实动脉粥样硬化的形成、脓毒血症的发生发展以及缺血再灌注损伤与TLR4-MMP-2/MMP-9信号通路的激活有密切联系[18-19]。TAK242通过与TLR4受体胞内段的Cys747位点竞争性的结合,在不影响TLR4受体胞外片段的二聚化的同时,阻断TLR4的胞内部分与配体结合,抑制TLR4受体信号向下游传递[20]。CCT是一种小分子多肽,通过噬菌体展示技术筛选的针对MMP-2、MMP-9的特异性阻断剂,CCT对其他MMP酶系无显著影响[21]。本研究结果显示,与单纯氧糖剥夺-复糖复氧比较,TAK242和CCT可减弱氧糖剥夺-复糖复氧对HUVEC-12细胞的损伤作用,增加电阻值,降低渗透压,降低炎性因子TNF-α和IL-1β的表达。表明氧糖剥夺-复糖复氧对HUVEC-12细胞的损伤作用可能与激活TLR4/MMP-2/MMP-9信号通路激活相关。本研究结果进一步显示,与接受CCT处理的氧糖剥夺-复糖复氧HUVEC-12细胞比较,TAK242能够进一步减弱氧糖剥夺-复糖复氧对HUVEC-12细胞的损伤作用,增加电阻值,降低渗透压,降低炎性因子TNF-α、IL-1β以及MMP-2、MMP-9的表达。既往研究表明,TLR4还能通过作用于下游信号分子HMGB和NF-κB发挥炎性激活作用。表明氧糖剥夺-复糖复氧损伤HUVEC-12细胞的机制除了激动TLR4-MMP-2/MMP-9信号通路以外,还可能通过TLR4受体激活其他下游信号通路。
综上所述,氧糖剥夺-复糖复氧诱导HUVEC-12细胞凋亡的机制可能与激活TLR4-MMP-2/MMP-9信号通路相关。
[1] Varatharaj A,Galea I. The blood-brain barrier in systemic inflammation[J]. Brain Behavior Immun,2017,60:1-12.
[2] Jakki SL,Senthil V,Yasam VR,et al. The blood brain barrier and its role in Alzheimer's therapy:an overview[J]. Curr Drug Targets,2018,19(2):155-169.
[3] Zhu T,Yao Q,Hu X,et al. The role of MCPIP1 in ischemia/reperfusion injury-induced HUVEC migration and apoptosis[J]. Cell physiol Biochem,2015,37(2):577-591.
[4] Ye HY,Jin J,Jin LW,et al. Chlorogenic acid attenuates lipopolysaccharide-Induced acute kidney injury by inhibiting TLR4/NF-κB Signal Pathway[J]. Inflammation,2017,40(2):523-529.
[5] Piromkraipak P,Sangpairoj K,Tirakotai W,et al. Cysteinyl Leukotriene Receptor Antagonists Inhibit Migration,Invasion,and Expression of MMP-2/9 in Human Glioblastoma[J]. Cell Mol Neurobiol,2018,38(2):559-573.
[6] Zhang S,An Q,Wang T,et al. Autophagy- and MMP-2/9-mediated reduction and redistribution of ZO-1 contribute to hyperglycemia-increased blood-brain barrier permeability during early reperfusion in stroke[J]. Neuroscience,2018,377:126-137.
[7] Timmers L,Sluijter J P,van Keulen JK,et al. Toll-like receptor 4 mediates maladaptive left ventricular remodeling and impairs cardiac function after myocardial infarction[J]. Circ Res,2008,102(2):257-264.
[8] Dong W,Xiao S,Cheng M,et al. Minocycline induces protective autophagy in vascular endothelial cells exposed to an in vitro model of ischemia/reperfusion-induced injury[J]. Biomed Rep,2016,4(2):173-177.
[9] Urbanek T,Kuczmik W,Basta-kaim A,et al. Rapamycin induces of protective autophagy in vascular endothelial cells exposed to oxygen-glucose deprivation[J]. Brain Res, 2014,1553:1-11.
[10] Yang X,He X Q,Li GD,et al. AntagomiR-451 inhibits oxygen glucose deprivation(OGD)-induced HUVEC necrosis via activating AMPK signaling[J]. PLoS One,2017,12(4):e0175507.
[11] 薛锐,夏中元,雷少青,等.PTEN在糖尿病因素削弱缺氧后处理对心肌细胞保护效应中的作用:与GSK-3β介导的线粒体凋亡途径的关系[J].中华麻醉学杂志,2017,37(1):108-111.
[12] 孟丽华,薛荣亮,杨毅猛,等.蛋白质转导4型-铜锌超氧物歧化酶融合蛋白在人星形胶质细胞中穿膜能力和保护作用的研究[J].国际麻醉学与复苏杂志,2017,38(8):682-687.
[13] Fromer MW,Chang S,Hagaman ALR,et al. The endothelial cell secretome as a novel treatment to prime adipose-derived stem cells for improved wound healing in diabetes[J]. J Vasc Surg,2018,68(1):234-244.
[14] Kuruca SE,Karadenizli S,Akgun-dar K,et al. The effects of 17β-estradiol on blood brain barrier integrity in the absence of the estrogen receptor alpha;an in-vitro model[J]. Acta Histochem,2017,119(6):638-647.
[15] Pluskota E,Bledzka KM,Bialkowska K,et al. Kindlin-2 interacts with endothelial adherens junctions to support vascular barrier integrity[J]. J Physiol,2017,595(20):6443-6462.
[16] Zhang R,Ge J. Proteinase-activated receptor-2 modulates Ve-cadherin expression to affect human vascular endothelial barrier function[J]. J Cell Biochem,2017,118(12):4587-4593.
[17] Zhang J,Zhang J,Yu P,et al. Remote ischaemic preconditioning and sevoflurane postconditioning synergistically protect rats from myocardial injury induced by ischemia and reperfusion partly via inhibition tlr4/myd88/nf-κb signaling pathway[J]. Cell Physiol Bioche,2017,41(1):22-32.
[18] Chao W,Deng JS,Huang SS,et al. 3,4-dihydroxybenzalacetone attenuates lipopolysaccharide-induced inflammation in acute lung injury via down-regulation of MMP-2 and MMP-9 activities through suppressing ROS-mediated MAPK and PI3K/AKT signaling pathways[J]. Int Immunopharmacol,2017,50:77-86.
[19] Lei Y,Yang G,Hu L,et al. Increased dipeptidyl peptidase-4 accelerates diet-related vascular aging and atherosclerosis in ApoE-deficient mice under chronic stress[J]. Int J Cardiol,2017,243:413-420.
[20] 马成永,林永忠,王淳,等.Toll样受体4抑制剂TAK-242对Aβ25-35诱导PC12细胞毒性损伤的保护作用[J].中华神经医学杂志,2016,15(12):1206-1211.
[21] Koivunen E,Arap W,Valtanen H,et al. Tumor targeting with a selective gelatinase inhibitor[J]. Nat Biotechnol,1999, 17(8):768-774.