子宫具有行月经、主胎孕、泌带液、促分娩、排恶露的功能[1-2]。对于女性来说其重大意义,但是随着社会的发展,患子宫内膜息肉者越来越多,需要引起相关的重视。本研究主要从分子生物学角度研究乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)、C-KIT与子宫内膜息肉的关系,报告如下。
1 资料与方法
1.1 一般资料 选择2017年1月—2018年1月在我院接收经宫腔镜电切术治疗的子宫内膜息肉患者60例,纳入标准:①宫腔镜检查发现宫内肿块呈现鱼肉样,肿物蒂形态大小各有不同,一般半径为0.25~1 cm,数目因人而异;②造影检查发现输卵管存在缺陷;③取不同部位子宫内膜检查发现均为不成熟上皮,基本在增生期,不分泌液体,有恶性的转化。通过患者的月经周期和子宫内膜增生情况,将患者分为分泌期和增生期各30例,年龄29~63岁,中位年龄46岁。另选取同期在我院进行体检无子宫内膜病变的妇女60例为对照组,年龄29~65岁,中位年龄47岁,分泌期和增生期各30例。
对照组内膜取样禁忌证包括:①经检查内膜有病变者;②绝对禁忌证是宫内妊娠,胎儿存活且希望继续妊娠;③相对禁忌证为有出血倾向。
本研究所有受试者均知情同意。
1.2 研究方法
1.2.1 取样[3-8] 采用门诊子宫内膜取样技术替代诊断性刮宫,可在没有麻醉或仅进行局部麻醉的情况下进行,不需扩张宫颈或仅轻微扩张宫颈。
1.2.2 试剂及调配 鼠抗人ALDH1和C-KIT基因单克隆抗体,兔抗人C-KIT相关蛋白质多克隆抗体,DNA抽取试剂盒W6501以及DNA纯化回收试剂盒,Taq酶,0.5%~1% 伊红酒精溶液(正确称取质量足够的伊红,将其用少量水溶解之后,加入纯醋酸调配,过滤,把过滤掉的沉渣用火轻轻烘干,再用工业酒精调配),美兰染剂[美兰(g)∶纯乙醇(mL)∶硫酸铝钾(g)∶蒸馏水(mL)∶碘酸钠(g)∶冰醋酸(mL)∶甘油(mL)=6∶100∶150∶2 000∶1.2∶120∶900],盐酸酒精溶液[9-10]。
1.2.3 病理切片染色 ①将切片从蒸馏水中取出,置入苏木精水溶液中染色;②将样本放入酸水及氨水中分色;③流水冲洗1 min后置入蒸馏水中;④分别应用70%和90%酒精脱水10 min;⑤置入酒精伊红染色液进行染色,2~3 min。将正常组织与病变组织不同时期标本分别标记。
1.2.4 免疫组织化学[11-12] ALDH1、C-KIT基因和蛋白质表达根据试剂说明书进行质量控制。将取下的组织用PBS冲洗后放入4%多聚甲醛磷酸盐缓冲液中进行固定;将固定液倒出,依次用蒸馏水冲洗3次、50%酒精冲洗2次,然后70%酒精1 d,80%酒精过夜,95%酒精3 h,最后无水酒精Ⅰ、Ⅱ各2 h 依次脱水;应用1∶1无水酒精二甲苯45 min,后二甲苯Ⅰ、Ⅱ各30 min;浸入石蜡中,在恒温箱内用石蜡Ⅲ包埋组织,应用1∶1二甲苯石蜡(58 ℃)45 min,石蜡Ⅰ、Ⅱ、Ⅲ共2.5 h;包埋后对组织块进行修整,应用切片机切成5~7 μm石蜡带;组织的展片需在50 ℃温水中进行,组织片通过捞片便可黏载玻片上;恒温箱烤片2 h,温度68 ℃;烤片后将组织置于室温60 min,然后应用二甲苯Ⅰ、Ⅱ浸泡,共25 min;分别进行无水酒精Ⅰ、Ⅱ各2 min,95%、80%、70%酒精Ⅰ、Ⅱ各2 min;PBS冲洗2~3次,每次5 min;3%H2O2去离子进行内源性过氧化物酶活性灭活,孵育约10 min; PBS冲洗5 min 2~3次;采用0.01 mmol/L枸橼酸缓冲液(pH 6.0),煮沸,温度维持在95℃ 15~20 min,冷却20 min以上;PBS冲洗5 min 2~3次;采用正常山羊血清封闭液孵育约20 min;甩干多余液体;滴注Ⅰ抗50 μL,而后室温静置1 h,或者4 ℃过夜,过夜则需在37 ℃复温45 min;PBS冲洗5 min 2~3次;滴注辣根过氧化物酶标记的Ⅱ抗40~50 μL,室温静置1 h;PBS冲洗5 min 2~3次;滴注SP(链霉亲和素-过氧化物酶),室温孵育30 min~1 h;PBS冲洗5 min 2~3次;DAB显色5~10 min,染色程度可通过显微镜观察,判断细胞中有无显色,胞浆呈棕色者判定阳性细胞;置入苏木精溶液复染色2 min,盐酸酒精分化;自来水冲洗10~15 min;常规脱水、透明、封片及镜检。
1.3 统计学方法 应用SPSS 17.0统计软件分析数据。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
增生期和分泌期子宫内膜息肉组ALDH1、C-KIT基因和蛋白质的表达阳性率均高于对照组,差异有统计学意义(P<0.05),见表1,2。
表1 子宫内膜息肉组和对照组ALDH1、C-KIT基因表达情况比较 (n=30,例数,%)
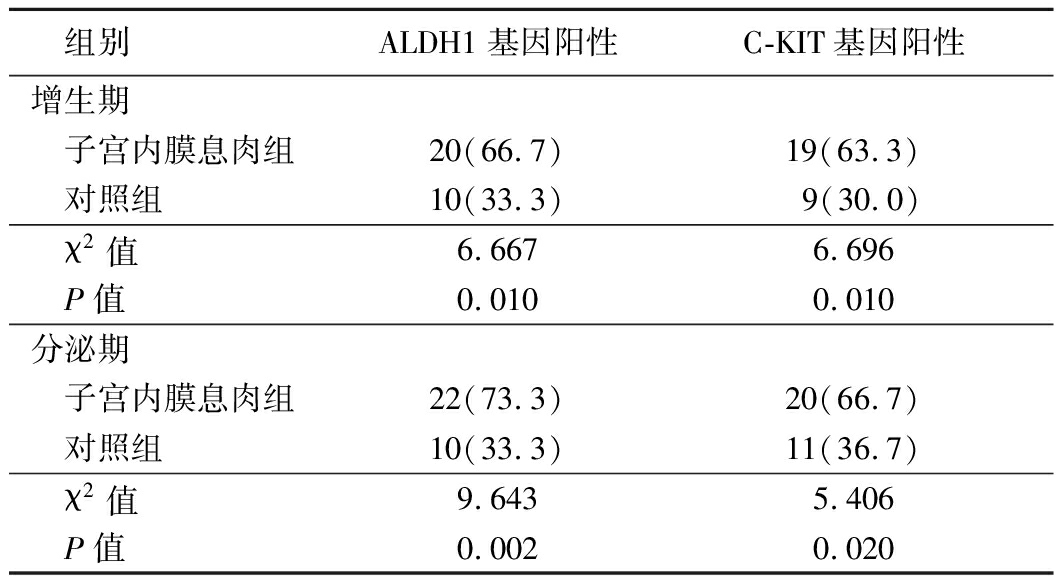
组别ALDH1基因阳性C-KIT基因阳性增生期 子宫内膜息肉组20(66.7)19(63.3) 对照组10(33.3)9(30.0) χ2值6.6676.696 P值0.0100.010分泌期 子宫内膜息肉组22(73.3)20(66.7) 对照组10(33.3)11(36.7) χ2值9.6435.406 P值0.0020.020
表2 子宫内膜息肉组和对照组ALDH1、C-KIT蛋白质表达情况比较 (n=30,例数,%)
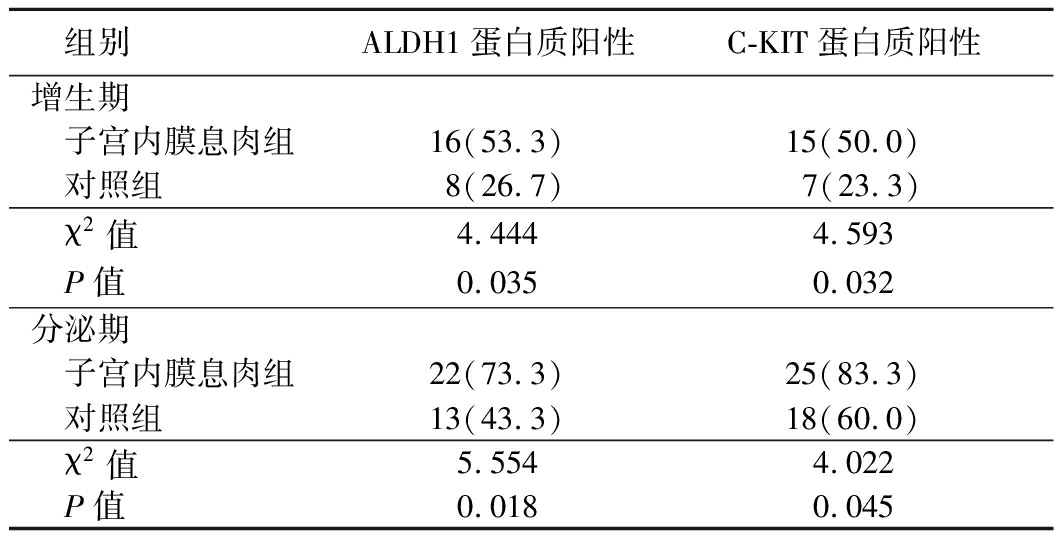
组别ALDH1蛋白质阳性C-KIT蛋白质阳性增生期 子宫内膜息肉组16(53.3)15(50.0) 对照组8(26.7)7(23.3) χ2值4.444 4.593 P值0.0350.032分泌期 子宫内膜息肉组22(73.3)25(83.3) 对照组13(43.3)18(60.0) χ2值5.5544.022 P值0.0180.045
3 讨 论
3.1 相关基因分析 C-KIT基因突变与子宫内膜上皮内病变预后有直接关系,可作为判断子宫内膜上皮是否存在恶变预后的重要指标之一。此基因属于一种细胞内原癌基因,可以编码具有酪氨酸激酶活性的蛋白质(一种是跨膜手提蛋白),可与SCF(与其对应的一种配体蛋白)特异性结合,使蛋白质活化,导致酪氨酸激酶受体信号传导过程激活,使细胞增殖分化、迁移凋亡以及血管形成等过程正常运行,此过程中如果酪氨酸激酶激活过程出现异常,便会影响正常细胞的凋亡过程,细胞产生恶变,子宫内膜上皮细胞即产生病变[13-14]。对子宫肿瘤的C-KIT基因进行检测已有许多研究,通过基因的第11号位上的外显子序列,可研究子宫肿瘤的发生发展。
ALDH1基因位于9号染色体,由10.6×104个碱基所构成,包含13个外显子,不存在重复序列,能够编码500多个氨基酸,在N端是蛋氨酸,具有2个激活位点,分别为谷氨酸和半胱氨酸,基因的启动区包含2个盒,分别为ATA盒和CCAAT盒,位于转录起始部位上游的32 bp和74 bp处。ALDH1有重要的作用,与干细胞的生长与分化密切相关。ALDH1参与人体上皮干细胞的自我更新、分化和自我保护,与子宫内膜疾病的发生发展有很大的关系,可作为子宫内膜病变治疗的特异性靶点[15-17]。
3.2 疾病基本信息 子宫内膜息肉是妇科的常见一种疾病,多由于炎症刺激、雌激素分泌过多、药物刺激等引起,一般与雌激素分泌过多、孕激素不足有关,主要表现为不规则异常子宫出血,或者出现一段时间的闭经后持续出血,导致患者出现月经不调、痛经等症状,严重者导致受精卵不易着床,导致不孕。一般可以用药物治疗,服用激素黄体酮或中药,在治疗期间应禁食生冷辛辣刺激性食物,平时注意休息,保持愉悦心情,注意劳逸结合。目前认为子宫内膜息肉与基因有关系。本研究结果显示,子宫内膜息肉患者ALDH1和C-KIT 基因表达阳性率高于对照组。很多患者没有明显的不良症状,超过一半患者存在阴道不规则出血,包括排卵期出血、月经过量、不定时出血等。绝经后出血也与息肉有关系。子宫内膜息肉对妇女的危害很大,严重者还会发生恶变,大多数女性缺乏常规体检,常常会忽略,再加上目前技术的局限性,会出现漏检率高和阳性率低的现象。年龄和雌孕激素水平是影响子宫颈息肉的关键因素,绝经后妇女要定期检查,对可疑者,要进行C-KIT、ALDH1基因和(或)蛋白检测,以便尽早发现、尽快治疗。应用技术包括子宫分段性诊刮术和宫腔镜探查与电切除技术结合。子宫分段性诊刮术的优点是简单易行,缺点是无法了解宫腔内的情况,复发率较高;宫腔镜探查与电切除技术结合对身体伤害小,恢复快。
3.3 相关基因与疾病的关系 子宫内膜息肉在无生育需求的女性中可以选择不手术,有的在一段时间之后可以自行消退,恶变的机会较小,但是对于有生育需求的女性需要手术去掉,以防影响后期生育。本研究提示子宫内膜息肉可以通过常规体检早发现、早预防,尤其是有家族史的已婚妇女,更需要检查相关基因,了解自身的遗传易感性,对控制自身疾病的发生有很重要的临床意义,同时对于已经患有子宫内膜息肉的患者也有一定的意义,医生可以通过检测患者的相关基因了解病情的发展情况,指导临床治疗;对于治疗后已经康复的妇女可以通过检测相关基因了解病情的复发情况,这比复发后影像学检查更有先见性,可以及时控制疾病,减少患者的痛苦。
总之,子宫内膜息肉是妇科常见疾病,大部分存在不规则出血,但少部分没有症状,子宫内膜息肉是导致年轻人不孕不育的常见原因。虽然子宫内膜息肉有时可以自行消退,但是仍然不容忽视,需要将相关基因检测作为一项常规检查,以便对疾病的发生起到预防作用。
[1] Ahmed S,Rashed H,Hegazy A,et al. Prognostic value of ALDH1,EZH2 and Ki-67 in astrocytic gliomas[J]. Turk Patoloji Derg,2016,32(2):70-81.
[2] Tsai MS,Chen WC,Lai CH,et al. Epigenetic therapy regulates the expression of ALDH1 and immunologic response:relevance to the prognosis of oral cancer[J]. Oral Oncol,2017,9(3):88-96.
[3] Ghaffari F,Arabipoor A,Bagheri Lankarani N,et al. Hysteroscopic polypectomy without cycle cancellation in IVF/ICSI cycles:a cross-sectional study[J]. Eur J Obstet Gynecol Reprod Biol,2016,205:37-42.
[4] Zhang X,Shen D,Lu ZR,et al. Effects of hydroxysafflor yellow A on ALDH1:inhibition kinetics and molecular dynamics simulation[J]. Elsevierjournal,2014,6(11):1664-1672.
[5] Bozkurt M,Sahin L,Ulas M. Hysteroscopic polypectomy decreases NF-κB1 expression in the mid-secretory endometrium of women with endometrial polyp[J]. Eur J Obstet Gynecol Reprod Biol,2015,189:96-100.
[6] 李雪凤,闫雅妮,冯艳霞,等.经阴道超声对宫腔粘连患者宫腔容积和血流变化的临床评价及诊断价值[J].河北医科大学学报,2017,38(9):1072-1075.
[7] Wong M,Crnobrnja B,Liberale V,et al. The natural history of endometrial polyps[J]. Hum Reprod,2017,32(2):340-345.
[8] Devic A,Vasilijevoc M,Devic A. Endometrial intraepithelial neoplasia (EIN) in an endometrial polyp[J]. De Gruyter,2015,7(10):343-346.
[9] 张海涛,金美善,石爱平,等.肿瘤干细胞标记物ALDH1在非浸润性膀胱癌组织中的表达及其临床意义[J].吉林大学学报:医学版,2013,39(2):326-329 .
[10] 温坚,刘颂平,殷新明.乙醛脱氢酶1与子宫内膜异位症的相关性研究[J].中国妇幼保健,2013,28(35):5878-5881.
[11] Dixit SG,Ghatak S,Singh P,et al. Estrogen receptor,progesterone receptor and CD8+ expression in endometrium of women of unexplained infertility[J]. J Gynecol Obstet Hum Reprod,2018,(18):30163-30166.
[12] Saccardi C,Gizzo S,Ludwig K,et al. Endometrial polyps in women affected by levothyroxine-treated hypothyroidism--histological features,immunohistochemical findings,and possible explanation of etiopathogenic mechanism:a pilot study[J]. Biomed Res Int,2013,2013:503419.
[13] Troncon JK,Meola J,Candido-Dos-Reis FJ,et al. Analysis of differential genetic expression in endometrial polyps of postmenopausal women[J]. Climacteric,2017,20(5):462-466.
[14] Dominick S,Hickey M,Chin J,et al. Levonorgestrel intrauterine system forendometrial protection in women with breast cancer on adjuvant tamoxifen[J]. Cochrane Database Syst Rev,2015,9(12):CD007245.
[15] Tiras B,Korucuoglu U,Polat M,et al. Management of endometrial polyps diagnosed before or during ICSI cycles[J]. Reprod Biomed Online,2012,24(1):123-128.
[16] Bel S,Billard C,Godet J,et al. Risk of malignancy on suspicion of polyps in menopausal women[J]. Eur J Obstet Gynecol Reprod Biol,2017,216:138-142.
[17] Dal Cin P,Timmerman D,Van den Berghe I,et al. Genomic changes in endometrial polyps associated with tamoxifen show no evidence for its action as an external carcinogen[J]. Cancer Res,2017,58(11):2278-2281.