在解读甲状腺超声图像时,超声医师常面临不知如何报告很常见且绝大多数是良性结节的窘境[1]。2017年,美国放射学会(American College of Radiology, ACR)甲状腺影像报告和数据系统(the Thyroid Imaging Reporting and Data System,TI-RADS)公布了关于甲状腺结节分类诊断的白皮书,该白皮书根据甲状腺结节的超声表现分类对其进行了新的危险分层。ACR TI-RADS从5个特征类别给甲状腺结节赋值,按总分将结节分成1~5类。甲状腺结节是否需要穿刺或超声随诊取决于该结节的ACR TI-RADS分类和其最大径。像其他专业学会和研究者所制定的危险分层一样,ACR TI-RADS旨在提供一种易于应用的方法协助医师明确治疗方案[2]。现对该白皮书进行解读,旨在对实施和应用ACR TI-RADS提供指导。
1 ACR TI-RADS概述
ACR TI-RADS从结节以下5个方面的超声表现对其评估——成分、回声、形态、边缘和钙化,每个类别赋予0~3分(表1)。在评估结节时,医师分别从前4个类别中选择一个特征,并从最后一个类别中选择所有特征并对这些分值进行求和。总分决定了结节的ACR TI-RADS水平,其范围从TR1(良性)到TR5(高度怀疑恶性)。请注意,尽管结节可能被授予0分并因此被定性为TR1,但所有其他结节至少有2分,因为囊实性混合(1分)的结节也会至少有一个实性成分的特性。虽然超声弹性成像是一种很有前途的技术[3-4],但它在许多超声科室均不具备,故并没有纳入ACR TI-RADS。
表1 5个ACR TI-RADS类别超声特征与相对应的分值

成分回声形态边缘钙化囊性或几乎全为囊性0分无回声0分宽>高0分光滑0分无或大的彗星尾征0分海绵状0分高回声或等回声1分高>宽3分边界不清1分粗钙化1分囊实混合1分低回声2分分叶状或不规则2分周边钙化2分实性或几乎全为实性2分极低回声3分甲状腺外延伸3分点状强回声3分
在ACR TI-RADS中,根据结节的TR分级及其最大直径建议是否对其进行细针穿刺抽吸活检(fine needle aspiration biopsy,FNA)或超声随访。对于风险等级TR3~TR5的结节,表2列出了FNA或随诊的阈值,对于总分等于或高于这个阈值的结节,建议其进行FNA或随诊。
表2 TR分级和FNA或超声随诊的标准
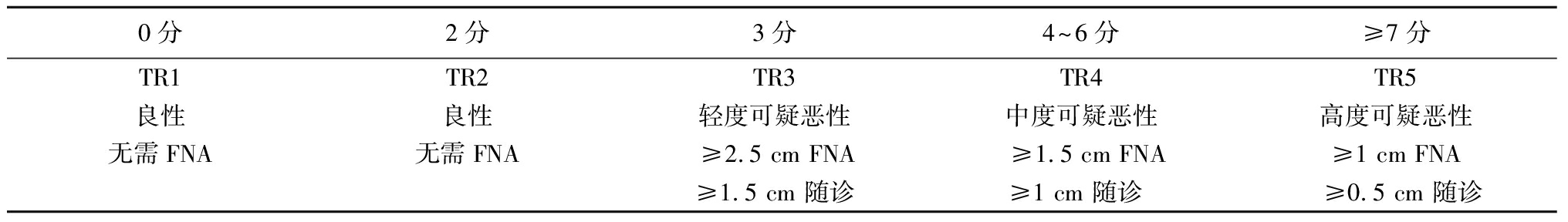
0分2分3分4~6分≥7分TR1TR2TR3TR4TR5良性良性轻度可疑恶性中度可疑恶性高度可疑恶性无需FNA无需FNA≥2.5 cm FNA≥1.5 cm FNA≥1 cm FNA≥1.5 cm 随诊≥1 cm 随诊 ≥0.5 cm 随诊
与其他专业学会一样[5-6],ACR TI-RADS建议仅在结节最大径≥1 cm的情况下对高度怀疑的结节进行FNA,并提倡对最大径≥2.5 cm的较低恶性风险的结节进行FNA。
ACR TI-RADS旨在在识别临床重要癌症的益处与使患有良性结节或惰性癌症的患者接受活检和治疗的风险以及成本之间做到平衡。白皮书中提出的随访超声检查的建议大大减轻了重要恶性肿瘤随着时间推移而未被发现的可能性。
2 ACR TI-RADS与其他系统之间的差异
2.1 结构 为使系统易于理解和应用,ACR TI-RADS不包括子类别,也不包括TR0类代表正常的甲状腺。 ACR TI-RADS还可用于语音识别报告或计算机化决策支持系统中的模板实施。
2.2 FNA的大小阈值 ACR TI-RADS与大多数其他指南一致,≥1 cm高度可疑结节建议行FNA。然而,对轻度疑似和中度可疑结节的FNA阈值(分别为2.5 cm和1.5 cm)高于美国甲状腺协会和韩国甲状腺放射学会所倡导的临界值。
在两个协会引用的2005年出版物中,Machens等[7]认为,2 cm以上的甲状腺乳头状癌和滤泡性甲状腺癌远处转移的累积风险增加。因此,他们提倡对大于2 cm的结节进行活检。然而,ACR TI-ARDS从他们的图表中得出,结节远处转移的风险从更大的结节开始逐渐轻微的增加。 更重要的是,Deveci等[8]根据切除标本的肿瘤大小进行了分析,而不是超声检查所测得大小。随后的研究表明,超声所测结节大小与病理所测结节大小之间缺乏一致性,超声的测值更大。 在Bachar等[9]研究的205例甲状腺乳头状癌中,超声所测结节的平均直径为(2.65±1.07) cm,而病理学所测结节的平均直径为(1.97±1.17) cm。
超声医学会赞助的一项研究分析显示,TR1和TR2结节的癌症风险水平不超过2%,TR3结节为5%,TR4结节为5%~20%,TR5结节至少为20%[10]。已发表的和新进行的SEER数据分析显示,结节最大径在2.5 cm时远处转移风险略有增加,结节最大径在3 cm时甲状腺癌相关死亡发生率略有增加[11]。
3 ACR TI-RADS特征类别
3.1 成分 在ACR TI-RADS中,囊性或几乎完全囊性以及海绵状的结节为0分,认为是良性结节,无需随诊。多数研究者认为海绵状指的是结节内存在很小的囊肿,类似于湿海绵中充满液体的间隙,然而对于结节中须具有多少囊肿才可称为海绵状存在争议。根据ACR甲状腺词典,结节内至少有50%应由微小的囊肿占据[12](图1)。
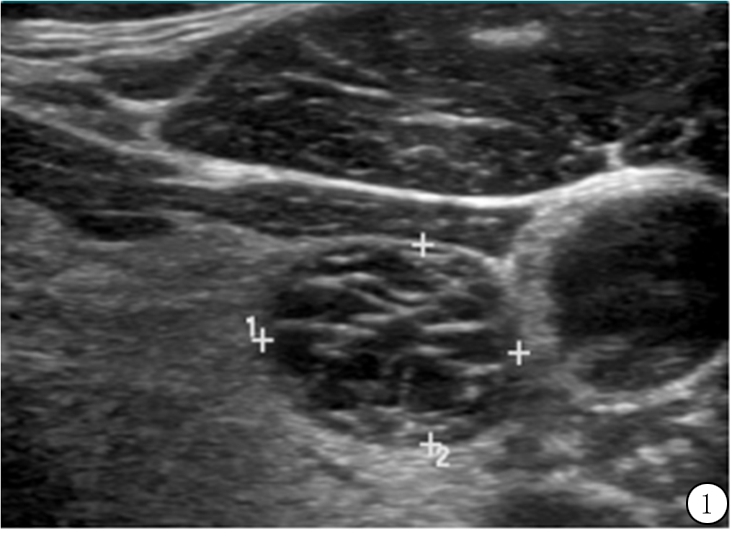
图1 59岁女性甲状腺内0.9 cm海绵状结节,结节内超过50%的成分由小囊构成,该海绵状结节在成分这一类别中评0分且不在其他类别中加分(1类)
此外,如果存在其他特征,如容易识别的周边钙化或粗大钙化,就意味着不能将该结节分为海绵状结节。然而,小囊肿后壁的微小强回声点也不能误认为是微钙化。结节内因钙化后方的声影不能明确结节内部结构时,认为该结节为实性,在成分这一类别中评2分。
对于囊实性混合结节,不像海绵状结节,ACR TI-RADS不要求超声工作者评估结节内实性成分的百分比,因为评估过程中主观性较强,且评估实性成分的特点比评估实性成分占比更重要。然而,一般来说,小囊成分少于5%,其余部分为实性的结节应分为实性结节(图2)。
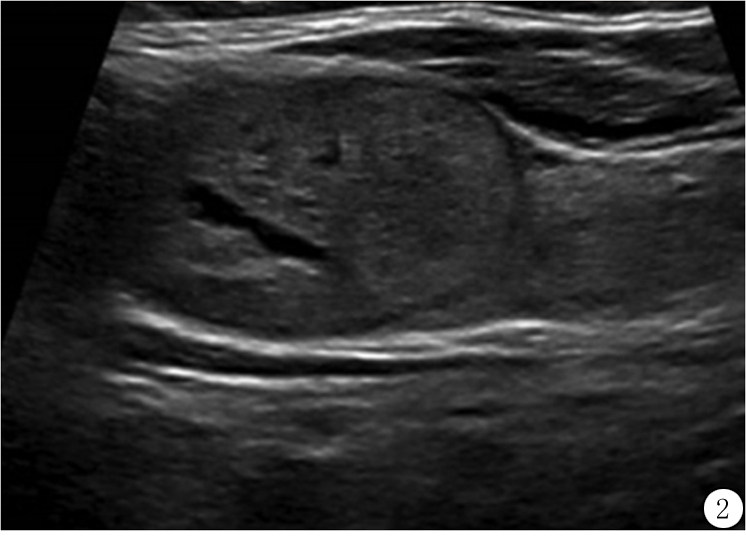
图2 65岁女性甲状腺内4.6 cm良性胶质结节的超声矢状断面图像,分类为实性(成分2分),尽管里面有小囊性成分,等回声特点再加1分,别的类别不加分,总分是3分(3类)
结节内实性成分的超声特征可帮助明确处理方案,如实性成分内出现点状强回声或粗大钙化或周边钙化可提高结节可疑恶性的程度[13-14]。这些特征和其他也适用于实性结节的可疑特征会增加囊实性结节的评分。此外,结节的最大径而非实性成分的最大径决定处理方案。如果囊实性结节的实性成分小于一个给定甲状腺分级的完全实性结节穿刺的阈值,而整个结节的大小高于这个临界值,则建议FNA。结节内可疑实性成分的组织太小而不能细针穿刺者仍需超声随诊,以减小临床上重要的恶性肿瘤长期内仍不能被发现的可能性。
实性成分的其他特征也应考虑在内,包括它们的位置和形态。位置指的是它们在整个结节内的位置及是否对称。单发的附壁结节,呈肿块样向液体成分内突出者较可疑。形态指的是实性成分和液体成分之间界面,里面的实性结节呈分叶状为可疑发现(图3)。相反,实性成分表面光滑,沿整个结节边缘均匀分布者较少考虑为恶性(图4)。一些研究者也注意实性附壁结节和囊壁之间的界面,呈锐角者更可疑[15-16]。同样,虽然彩色多普勒超声尚未被证实能够可靠地区分良性和恶性结节[17],但固体成分中的血流信号可使组织与碎片或出血区别开来,能探及血流表明实性成分为活体组织而不是血凝块、碎屑或坏死组织。
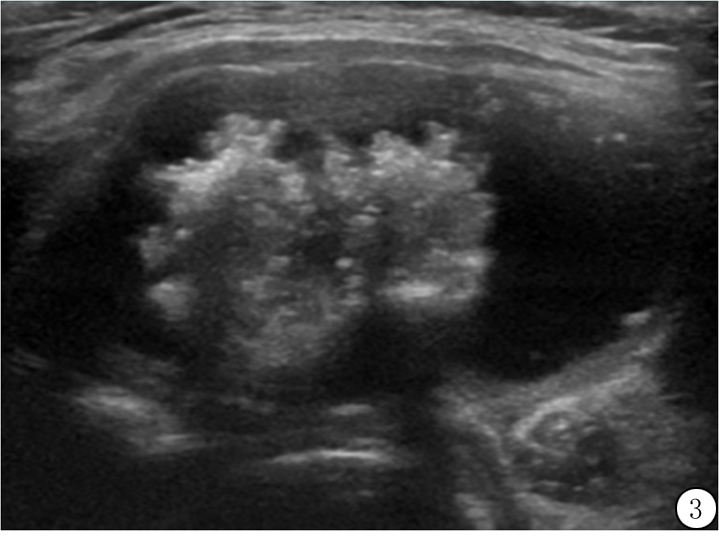
图3 39岁男性囊实性混合的乳头状甲状腺癌,结节内有实性分叶状附壁成分,还有点状强回声,成分得1分,实性成分等回声加1分,点状强回声加3分,总分5分(4类)
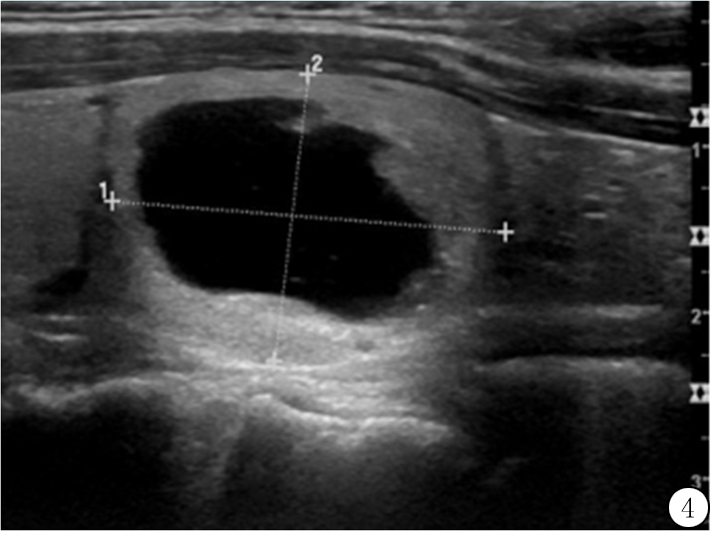
图4 40岁女性甲状腺内良性囊实性混合结节(1分),等回声实性成分沿结节周围均匀分布(1分),总分2分(2类)
3.2 回声 以相邻甲状腺实质回声作为参考评估结节回声,结节回声明显低于颈前肌群回声者定义为极低回声结节(图5)。此类别还包括“无回声”,为0分的特征,它适用于囊性或几乎完全囊性的结节。如果结节内钙化太多而不能评估结节回声者,认为该结节至少为等回声或高回声,评1分。
3.3 形态 高大于宽是一种敏感性低但特异性高的恶性指标。在甲状腺横断面上比较平行和垂直于超声声束所测量的结节的高度和宽度,通常肉眼即可看出高大于宽的外形,很少需要正式测量(图6)。
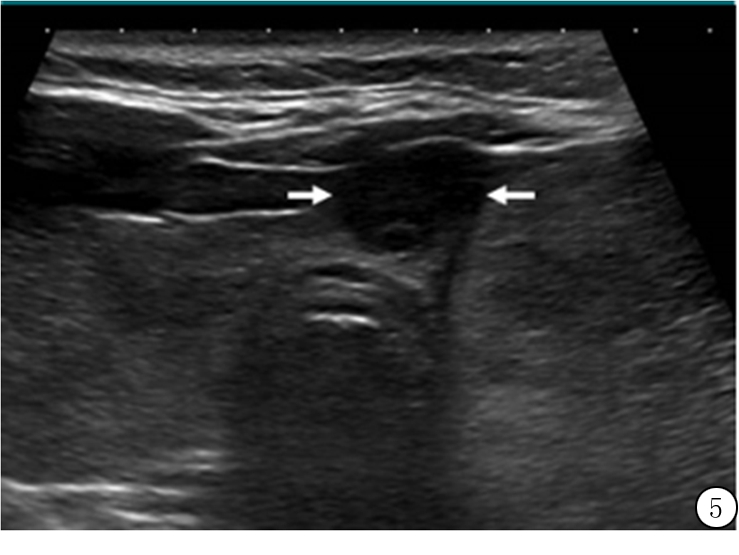
图5 24岁女性甲状腺内极低回声乳头状癌(箭头)超声横断面图像,实性成分加2分,极低回声加3分,共5分(4类)
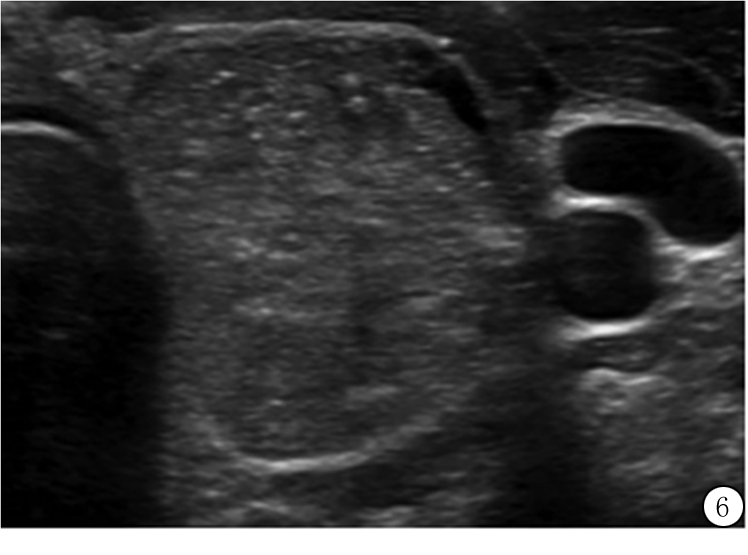
图6 47岁男性甲状腺乳头状癌超声横断面图像,结节高大于宽,除了形态加3分,实性成分加2分,等回声加1分,多数点状强回声加3分,共9分(5类)
3.4 边缘 结节的边缘定义为结节与相邻甲状腺内、外组织间的界面。边缘光滑指的是均匀的、逐渐弯曲的界面(图7)。若结节的实性部分呈分叶状,成角或突向周围组织,则该结节的边缘应归类为分叶或不规则,均给2分,故也不必区分到底是分叶状还是不规则(图8)。甲状腺外延伸给3分,特点为明确向邻近组织的侵袭,为恶性的特有征象,若结节仅仅向甲状腺边界膨出则不是甲状腺外延伸(图9)。如果结节的边界显示不清,则归类为边界不清,给0分,因为边界不清不是一个鉴别特征。声晕的存在既不具有鉴别特征,也不与其他边界类型相互排斥,故白皮书中未将“晕”纳入边缘这一类别。
3.5 局灶性强回声 粗大钙化和周边钙化因通常均伴一定程度的声影而容易诊断。然而,可能出现在乳头状癌内代表砂粒体的点状强回声不是很明显。值得注意的是,可能在海绵状结节中可见小的点状强回声代表微小囊肿的后壁。此外,斑点样的正常或非恶性甲状腺组织有时也包含小亮点,不能将其误认为点状强回声(图10)。如果小亮点样结构既出现在可疑组织内又出现在正常甲状腺组织内,则可能不是ACR TI-RADS分类里的点状强回声。但要除外弥漫硬化性甲状腺癌。
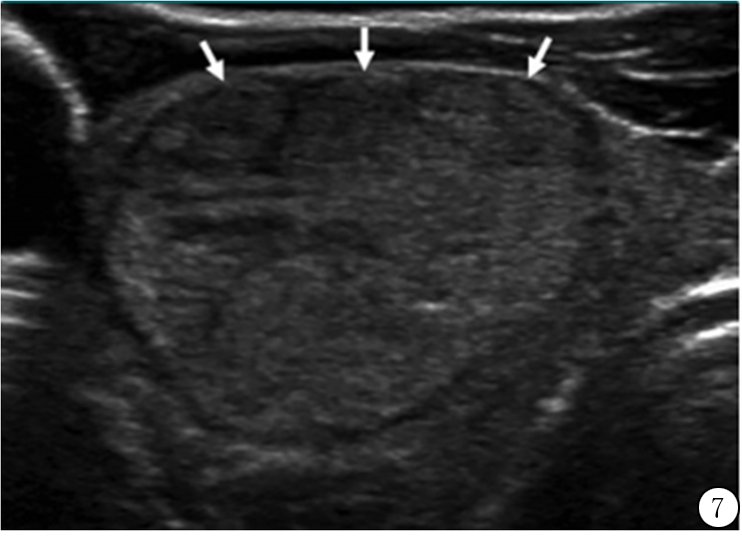
图7 52岁女性甲状腺内良性滤泡样结节超声横断面图像,结节边缘光滑(箭头),实性成分加2分,等回声加1分,共3分(3类)
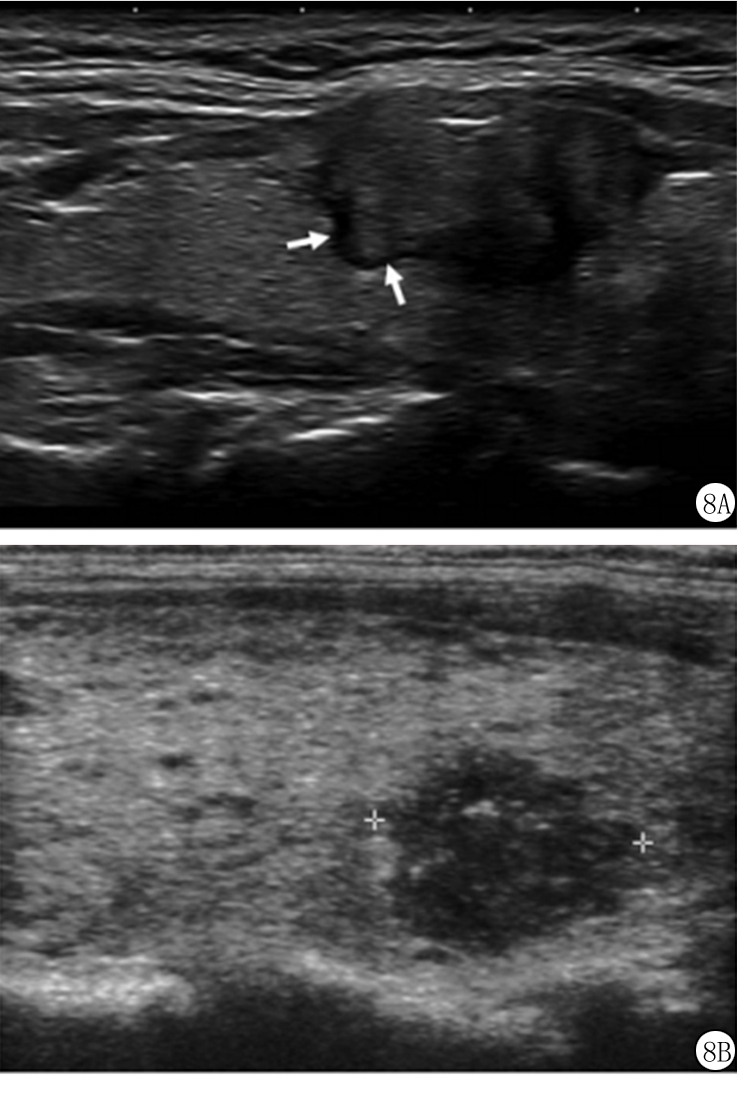
图8 A.61岁男性2.2 cm甲状腺癌超声矢状断面图像,显示结节边缘呈分叶状(箭头),加2分,实性成分加2分,低回声加2分,共6分(4类);B.39岁女性1.2 cm甲状腺癌超声矢状断面图像显示结节边界不规则(毛刺样),加2分,实性成分加2分,极低回声加3分,点状强回声加3分,共10分(5类)
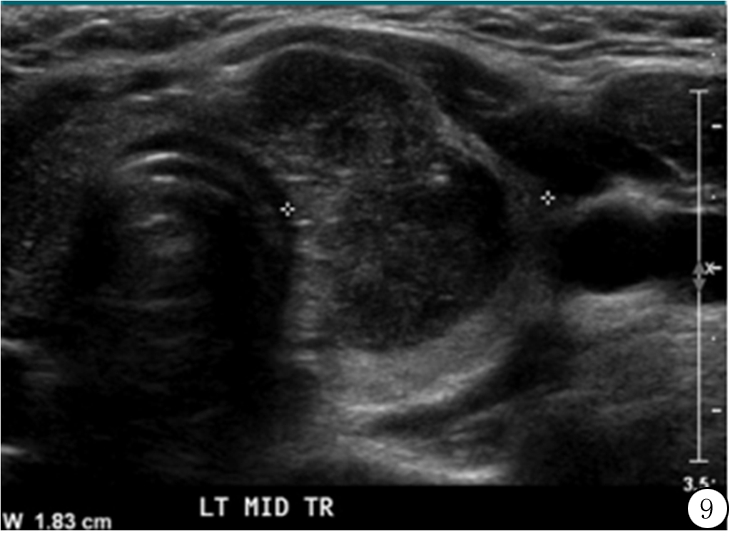
图9 24岁女性甲状腺乳头状癌向甲状腺边缘突出,术中未见侵袭。实性成分加2分,低回声加2分,高大于宽加3分,边缘分叶加2分,共9分(5类)
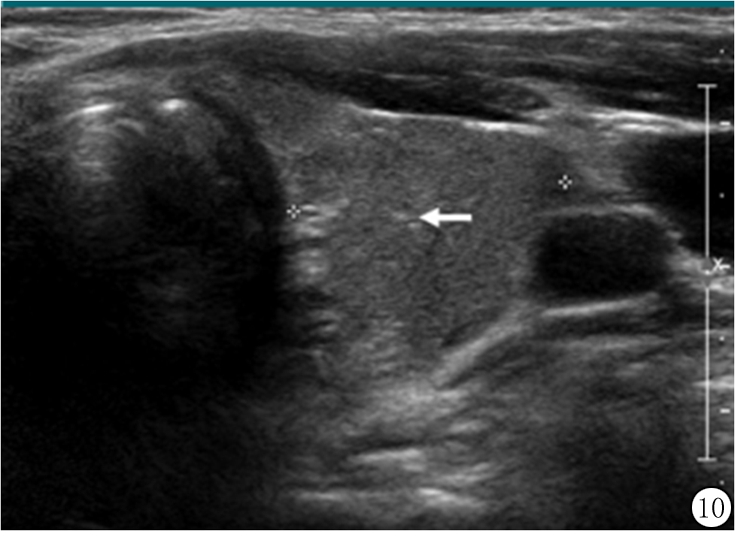
图10 42岁男性甲状腺左叶超声图像,代表散斑样正常或非恶性组织的小亮点不能误认为点状强回声
ACR TI-RADS还将小彗星尾和大彗星尾征加以区分。大的彗星尾大于1 mm,呈“V”形,与结节内的胶质有关,出现在结节的囊性成分中为良性征象。另一方面,小彗星尾征按点状强回声处理,出现在低回声的实性组织中定为3分(图11)。如果结节中同时出现2种彗星尾征,按更可疑者给予分数。中心原则是不能单靠彗星尾征确定一个结节为良性。
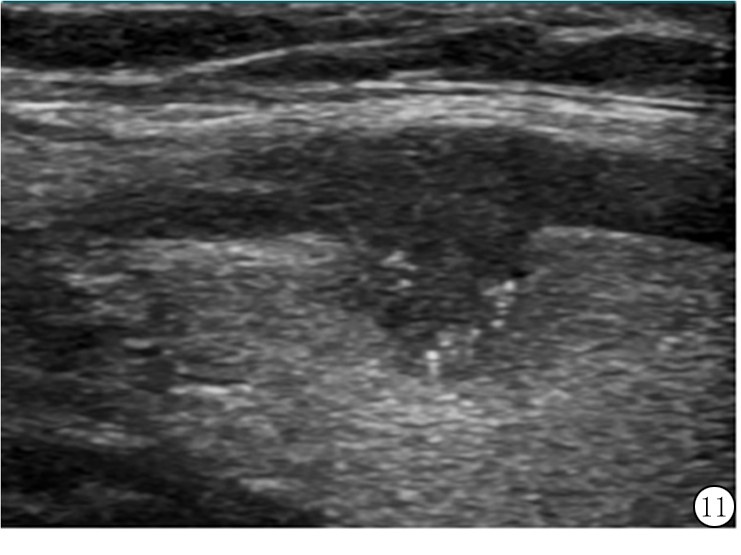
图11 54岁女性甲状腺乳头状癌中小彗星尾征和额外的点状强回声,点状强回声加3分,实性成分加2分,低回声加2分,边缘分叶状加2分,共9分(5类)
4 甲状腺微小乳头状癌
ACR TI-RADS与其他指南一致,不建议对小于1 cm的结节进行常规FNA,即使它们非常可疑。 然而,由于一些甲状腺专家主张对甲状腺微小乳头状癌进行主动监测、消融或腺叶切除术,故在某些情况下5~9 mm 的TR5结节的FNA可能是适当的[18-21]。执行FNA的决定将涉及转诊医师和患者之间的共同决策。此外,关键的边缘位置的结节可能使手术复杂化[18-20]。 因此,ACR TI-RADS应指出结节是否邻接气管或是否与气管食管沟(喉返神经的位置)相邻。
5 报告考虑因素
5.1 测量和记录 准确确定甲状腺结节的大小是至关重要的,因为结节的最大径决定了否应对该结节进行FNA或随访。
结节应测量3个径线:横断面上结节的最大横径、横断面上垂直于横径的前后径和纵断面上结节的上下径。对于处于倾斜方位的结节,这些测量可能与用于确定高大于宽的形状的测量不同,但这种差异在实践中很少会出现问题。测量还应包括结节的声晕(如果存在)。
声像图上结节位置的详细记录同样重要,特别是当甲状腺回声不均匀或存在多个结节时。每个需随访的结节应按顺序编号,并标明其在甲状腺中的位置(右叶,左叶,峡部,上段,中段,下段,如有必要还应记录外侧、内侧、前侧或后侧)(图12)。该委员会建议,报告中需随诊的,最高ACR TI-RADS分数低于FNA大小阈值的结节,最多不应该超过4个。
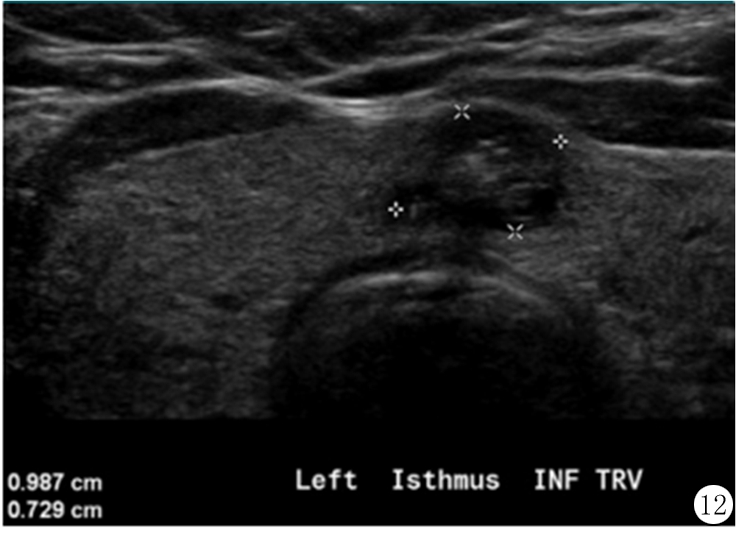
图12 61岁女性甲状腺结节的超声横断面图像,文字说明表示结节位于峡部左侧
该委员会没有强调以前取样过的结节的随诊,是否需要重复活检通常由外科医师根据先前FNA结果的管理建议进行评估。
5.2 生长的定义 与其他专业学会设立的标准一样,ACR TI-RADS将明显生长定义为至少结节的3个径线增加20%且最少增加2 mm,或体积增加≥50%[6]。因为如果仅将当前超声测值与前一次测值进行比较,增大可能不明显,所以如果可以的话,还要与更早期检查的测值相比较。
5.3 随诊超声检查的时间安排 根据ACR TI-RADS,对于TR5病变,建议每年随诊1次,持续5年。对于TR4病变,应在第1年、第2年、第3年和第5年随诊。对于TR3病变,可以在第1年、第3年和第5年进行随诊。如果结节大小没有变化,第5年以后可不再随诊,因为结节的生长在时间跨度上的稳定性可靠地表明结节具有良性行为[22]。没有公布的证据可以指导管理显著增大但第5年时仍不到FNA阈值的结节,但可能需要继续进行随访。如果结节的ACR TI-RADS水平在随访时增加,则下一次随诊应在1年内完成,无论其初始水平如何。
5.4 进行活检的结节的数量 委员会建议ACR TI-RADS最高总分满足FNA标准的结节最多不超过2个。结节的大小不是穿刺的主要标准。如果≥3个结节符合ACR TI-RADS活检标准,那么根据总分活检2个最可疑的结节,即使它们不是最大的。
6 颈淋巴结的评估
颈淋巴结的评估是每次甲状腺超声检查的重要部分。提示颈部淋巴结转移的异常发现包括:淋巴结呈球形、正常淋巴门回声丢失、淋巴外周探及血流而不是淋巴门血流、淋巴结回声不均匀伴囊性成分,以及可能代表微钙化的点状强回声。 ACR TI-RADS建议除了穿刺最多2个最可疑结节外,还可使用细针穿刺可疑淋巴结。
[1] Burch HB,Burman KD,Cooper DS,et al. A 2015 survey of clinical practice patterns in the management of thyroid nodules[J]. J Clin Endocrinol Metab, 2016,101(7):2852-2862.
[2] Tessler FN,Middleton WD,Grant EG,et al. ACR Thyroid Imaging, Reporting and Data System(TI-RADS): White Paper of the ACR TI-RADS Committee[J]. J Am Coll Radiol, 2017,14(5):587-595.
[3] Magri F,Chytiris S,Chiovato L. The role of elastography in thyroid ultrasonography[J]. Curr Opin Endocrinol Diabetes Obes,2016,23(5):416-422.
[4] Park VY,Kim EK,Kwak JY,et al. Thyroid imaging reporting and data system and ultrasound elastography: diagnostic accuracy as a tool in recommending repeat fine-needle aspiration for solid thyroid nodules with non-diagnostic fine-needle aspiration cytology[J]. Ultrasound Med Biol,2016,42(2):399-406.
[5] Shin JH,Baek JH,Chung J,et al. Ultrasonography Diagnosis and Imaging-Based Management of Thyroid Nodules: Revised Korean Society of Thyroid Radiology Consensus Statement and Recommendations[J]. Korean J Radiol,2016,17(3):370-395.
[6] Haugen BR,Alexander EK,Bible KC,et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer[J]. Thyroid,2016,26(1):1-133.
[7] Machens A,Holzhausen HJ,Dralle H. The prognostic value of primary tumor size in papillary and follicular thyroid carcinoma[J]. Cancer,2005,103(11):2269-2273.
[8] Deveci MS,Deveci G,LiVolsi VA,et al. Concordance between thyroid nodule sizes measured by ultrasound and gross pathology examination: effect on patient management[J]. Diagn Cytopathol,2007,35(9):579-583.
[9] Bachar G,Buda I,Cohen M,et al. Size discrepancy between sonographic and pathological evaluation of solitary papillary thyroid carcinoma[J]. Eur J Radiol, 2013,82(11):1899-1903.
[10] Middleton WD,Teefey SA,Reading CC,et al. Multiinstitutional Analysis of Thyroid Nodule Risk Stratification Using the American College of Radiology Thyroid Imaging Reporting and Data System[J]. AJR Am J Roentgenol,2017,208(6):1331-1341.
[11] Nguyen XV,Choudhury KR,Eastwood JD,et al. Incidental thyroid nodules on CT: evaluation of 2 risk-categorization methods for workup of nodules[J]. AJNR Am J Neuroradiol,2013,34(9):1812-1817.
[12] Grant EG,Tessler FN,Hoang JK,et al. Thyroid ultrasound reporting lexicon: white paper of the ACR Thyroid Imaging,Reporting and Data System (TIRADS) Committee[J]. J Am Coll Radiol,2015,12(12 Pt A):1272-1279.
[13] Lee M,Kim EK,Kwak JY,et al. Partially cystic thyroid nodules on ultrasound: probability of malignancy and sonographic differentiation[J]. Thyroid ,2009,19(4):341-346.
[14] Park JM,Choi Y,Kwag HJ. Partially cystic thyroid nodules: ultrasound fndings of malignancy[J]. Korean J Radiol,2012,13(5):530-535.
[15] Kim DW,Lee EJ,In HS,et al. Sonographic differentiation of partially cystic thyroid nodules: a prospective study[J]. AJNR Am J Neuroradiol,2010,31(10):1961-1966.
[16] Kim DW,Park JS,In HS,et al. Ultrasound-based diagnostic classifcation for solid and partially cystic thyroid nodules[J]. AJNR Am J Neuroradiol,2012,33(6):1144-1149.
[17] Rosario PW,Silva AL,Borges MA,et al. Is Doppler ultrasound of additional value to gray-scale ultrasound in differentiating malignant and benign thyroid nodules?[J]. Arch Endocrinol Metab,2015,59(1):79-83.
[18] Leboulleux S,Tuttle RM,Pacini F,et al. Papillary thyroid microcarcinoma: time to shift from surgery to active surveillance?[J]. Lancet Diabetes Endocrinol, 2016,4(11):933-942.
[19] Brito JP,Hay ID,Morris JC. Low risk papillary thyroid cancer[J]. BMJ,2014,348:g3045.
[20] Brito JP,Ito Y,Miyauchi A,et al. A clinical framework to facilitate risk stratification when considering an active surveillance alternative to immediate biopsy and surgery in papillary microcarcinoma[J]. Thyroid,2016,26(1):144-149.
[21] Ito Y,Miyauchi A,Inoue H,et al. An observational trial for papillary thyroid microcarcinoma in Japanese patients[J]. World J Surg,2010,34(1):28-35.
[22] Durante C,Costante G, Lucisano G,et al. The natural history of benign thyroid nodules[J]. JAMA,2015,313(9):926-935.