神经干细胞(neural stem cells,NSCs)[1-7]具有自我分裂、增殖更新,以及分化为神经元、星形胶质细胞、少突胶质细胞的特性。NSCs的发现,更新了神经元不能再生的观点,对于深入了解神经系统的结构和功能至关重要[8-10]。如果NSCs能够大量获得,并达到进行自体或异体移植,成功治疗某些神经系统疾病的目的,将会推动医学的重大进步。NSCs在成年鼠和胚胎脑中均有分布,但是胚胎脑中的比例远高于成年脑。目前,NSCs体外培养有一定难度,增殖率低,不易大量获得。对此,本研究在实验中摸索出一种高效的NSCs培养方法,培养的NSCs纯度高、增殖快,且具有多向分化潜能,值得推广应用。
1 材料与方法
1.1 实验动物和试剂 ICR孕鼠(孕12.5 d),由河北省实验动物中心提供。DMEM/F12培养基,Gibco公司,美国;胎牛血清,Hyclone公司;L-谷氨酰胺,Invitrogen公司;牛血清白蛋白,Sigma,美国;青霉素、链霉素,Hyclone公司;Accutase, Sigma公司,美国; 多聚赖氨酸(Poly-L-lysine,PLL), Sigma,美国;Cell Counting Kit-8(CCK8),日本同仁化学研究所; 碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF),Peprotech公司; 表皮生长因子(epidermal growth factor,EGF),Peprotech公司; Tween-20,Sigma,美国; N2添加剂, Invitrogen公司;B27添加剂,Hyclone公司;牛血清白蛋白(bovine serum albumin,BSA),Sigma,美国;Triton X-100,Sigma,美国;过氧化氢,天津化学试剂三厂;巢蛋白(nestin)单克隆抗体,NSE多抗,GFAP多抗,Santa Cruz公司,美国;DyLightTM594标记山羊抗兔IgG,北京中杉金桥。
1.2 分离培养 取孕12.5 d ICR孕鼠,用戊巴比妥腹膜下注射麻醉(65 mg/kg),孕鼠腹部以75%酒精消毒后,手术剪打开腹腔,剪开子宫,将胎鼠用75%酒精消毒后断头处死,用眼科手术剪剪开全脑,置于D-HANKs液的培养皿中。在解剖显微镜下充分去除软脑膜和脉络丛组织。去除胎鼠颜面部后逐层分离,取出皮质剪成约1 mm3大小,移入无菌10 mL离心管。用3倍体积的Acutase消化,37 ℃水浴5 min。用由粗到细的火焰抛光的玻璃吸管轻轻吹打成单细胞悬液(此步骤时间不超过3 min)。垂直静置15~30 min,使未吹开的大块组织沉底。将上清移入另一无菌10 mL离心管,加无菌PBS,吹打均匀,1 000 r/min,5 min,离心洗涤2~3次,至上清清澈。应用新的培养基,主要成分为B27、20 ng/mL bFGF和20 ng/mL EGF 的DMEM/F12,将细胞重悬于该培养基中,以5×105个细胞/mL密度接种在75 mL的玻璃培养瓶中。置37 ℃,5%CO2 饱和湿度培养箱内进行培养。2~3 d换液1次。每天倒置显微镜进行观察。
1.3 传代培养 细胞在接种后3~4 d神经球形成后,进行传代,以5×105个细胞/mL继续培养。传代过程:待神经球形成后,准备10 mL无菌离心管,并将细胞移入管中;神经球垂直静置管中15~30 min后沉底;将上清吸走,向沉淀中加入3 倍体积的Acutase消化液,进行37 ℃水浴5 min;再用细火焰抛光的玻璃吸管轻轻吹打成单细胞悬液(此步骤时间不超过5 min);记数后以5×105个细胞/mL继续培养,培养基成分同上。
1.4 小鼠NSCs鉴定
1.4.1 nestin 免疫荧光 将培养的神经球离心,1 000 r/min,5 min,PBS洗涤3遍后,加入4%多聚甲醛固定,4 ℃,30 min。PBS洗3遍后加入终浓度0.01%的结晶紫染色5 min。PBS洗2遍后将球加入盛有OCT包埋剂的EP管。将EP管于液氮中冷冻30 s,放入冰冻切片机平衡20 min后进行冰冻切片,片厚10 μm。将切片用烤片机烤干,-20 ℃保存;取出切片,PBS浸泡10 min;用含0.3%Triton X-100的PBS透膜10 min,用0.01 mol/L PBS洗涤3次,5 min/次;再用含10% BSA和2%马血清的封闭液于37 ℃孵育30 min后加入2% BSA稀释的特异性一抗[兔抗nestin单克隆抗体(1∶100)],湿盒中4 ℃孵育过夜。用含0.1% Tween 20的PBS洗涤3次,5 min/次,加入2% BSA稀释的二抗(DyLightTM594标记山羊抗兔IgG含有4,6-联脒-2-苯基吲哚),湿盒中避光室温孵育1 h。用含0.1% Tween 20的PBS洗涤3次,5 min/次,0.01 mol/L PBS洗涤1次,5 min。避光封片[封片剂:8.5 mL甘油+1 mL对苯二胺(10 g/L),用碳酸盐缓冲液调pH至8.5~8.8]。最后荧光显微镜下观察结果,采集图像。
1.4.2 生长曲线绘制(CCK8法) 向96孔板中每孔加入100 μL细胞悬液,含1 000个细胞,在37 ℃下预孵育培养板。从第2天开始,每天任意取5孔,加入10 μL CCK8溶液,37 ℃下孵育2 h;在酶标仪上测定光吸收值,测定波长为450 nm。用所测得的CCK8值绘制生长曲线。
1.4.3 分化潜能 收集神经球接种于PLL包被的盖玻片上,加入条件培养液。条件培养液组成:含B27和N2的DMEM/F12 培养基中,加入10 ng/mL胶质细胞源性神经营养因子。在培养后3 d各取出3片细胞进行胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和神经元特异性烯醇化酶(neuronal specific enolase,NSE)免疫细胞化学染色检测。
取出细胞爬片,用0.01 mol/L PBS进行3次清洗,5 min/次。4%多聚甲醛固定,室温,30 min。0.01 mol/L PBS清洗3次,5 min/次。 封闭内源性过氧化物酶:3%H2O2 甲醇,室温,10~15 min。0.01 mol/L PBS 清洗3次,每次5 min。暴露抗原:0.3%Triton X-100,室温 10 min。0.01 mol/L PBS 清洗3次,每次5 min。 封闭非特异抗原:滴加10%正常山羊血清,室温或37 ℃,20~30 min。甩去多余的血清,不洗。 一抗孵育:滴加适当稀释的一抗(兔抗NSE一抗(1∶80)、兔抗GFAP一抗(1∶80),湿盒中,4 ℃,过夜。以不加PBS 代替一抗作阴性对照。0.01 mol/L PBS 清洗3次,每次5 min。二抗孵育:滴加生物素化羊抗兔IgG,37 ℃,1 h。0.01 mol/L PBS 清洗3次,每次5 min。三抗孵育:滴加SABC,37 ℃,1 h。0.01 mol/L PBS 清洗3次,每次5 min。显色:用DAB显色液显色,显微镜下监测,终止。0.01 mol/L PBS 清洗3次,每次5 min。常规脱水、透明、封片。显微镜下观察结果,采集图像。
2 结 果
2.1 形态学观察 细胞原代培养结果显示,在接种后1 d,细胞多呈悬浮生长状态,以单细胞形式多见。接种后2 d,悬浮的单细胞逐渐减少,而细胞团开始增多,并疏松连接在一起。接种后3~4 d,细胞团继续增多,并且体积增大,以规则圆形分散悬浮,细胞连接逐渐紧密。细胞团即为NSCs增生形成的神经球,其外围分布有一层大小较均匀,折光性好的细胞(图1)。
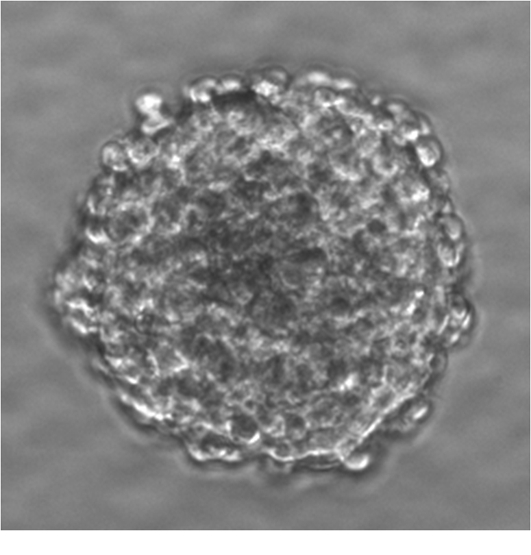
图1 倒置显微镜观察的神经球( ×200)
Figure 1 Neurospheres observed by inverted microscope( ×200)
2.2 小鼠NSCs的鉴定
2.2.1 nestin免疫组织化学染色 结果显示,神经球内大部分细胞呈nestin阳性,阳性反应产物主要聚集在细胞浆内(图2)。
2.2.2 细胞生长曲线 细胞在传代后4 d内以增殖为主;以5×105个细胞/mL进行传代,测得CCK8值为0.117,细胞倍增时间为2 d;4 d时CCK8值达0.331,此时细胞密度最高,是传代细胞数的2.83倍;自5 d后,细胞增殖减慢,CCK8值逐渐下降(图3)。
2.2.3 细胞的分化潜能 经诱导分化后,神经球周围细胞逐渐爬出,呈贴壁生长,细胞体积增大,并伸出放射状的细长突起;随着细胞向周围迁移,细胞形态从圆形转变为多角形或椎体形,有突起相互交织,具有神经元样的形态特征。细胞密度由神经球中心向周缘逐渐下降。
免疫细胞化学染色显示:先爬出的细胞为GFAP阳性,其伸出的细长辐射状突起交织成丛(图4),形成支架,可引导其他细胞向周围迁移;后伸出的细胞为NSE阳性细胞,附着于支架上,从神经球的中心向周围呈分散状分布,其胞体呈三角形或椎体形,突起相对细小,也相互交织成丛(图5),体积较大、突起明显的NSE阳性细胞着色较深,体积较小、突起少的NSE阳性细胞着色较浅。
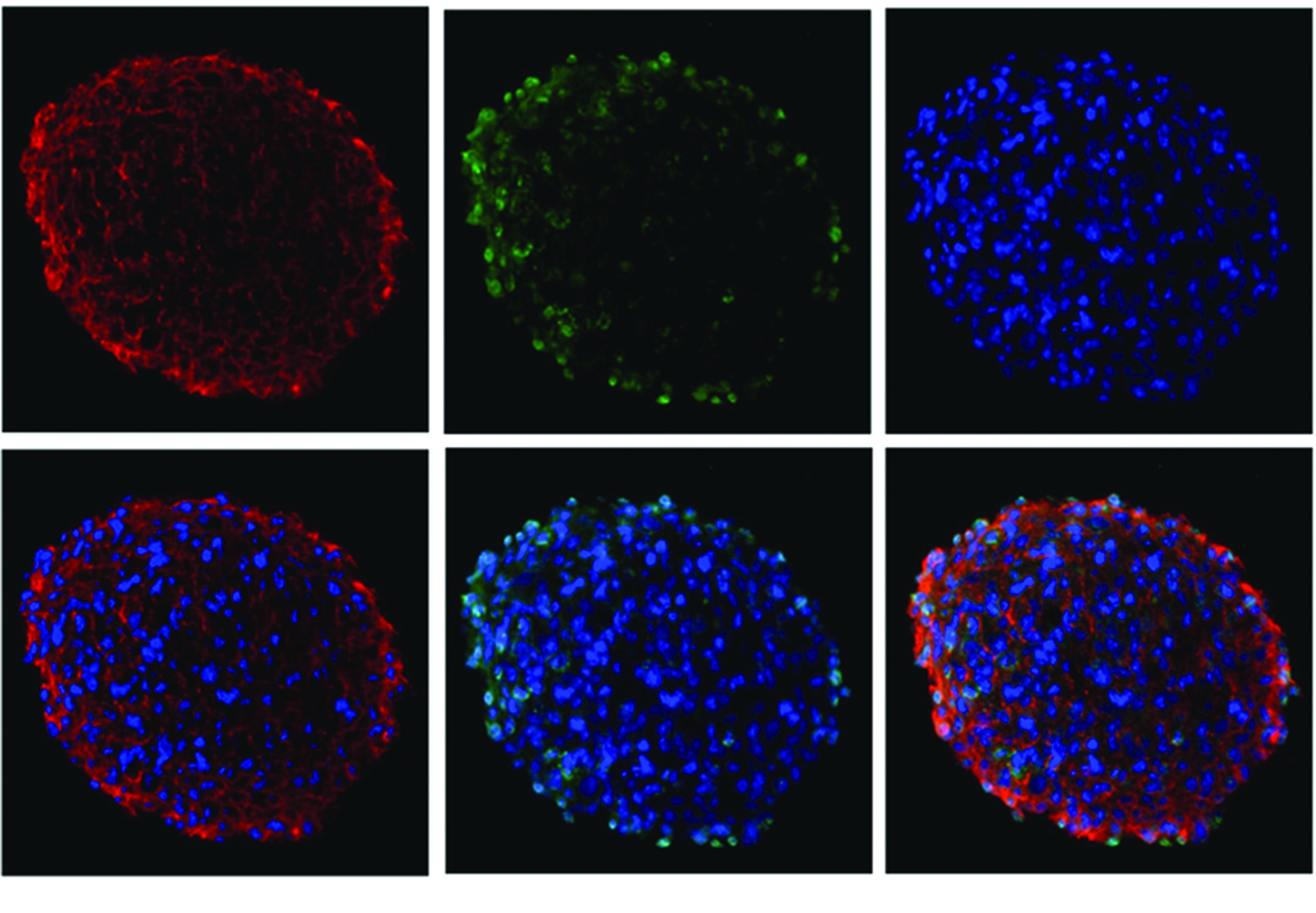
图2 免疫细胞化学检测神经球中巢蛋白和Ki67阳性细胞,DAPI染色细胞核( ×200)
Figure 2 Nestin and ki67 positive cells in neurospheres were detected by immunocytochemistry, with dapi stained the nuclei( ×200)
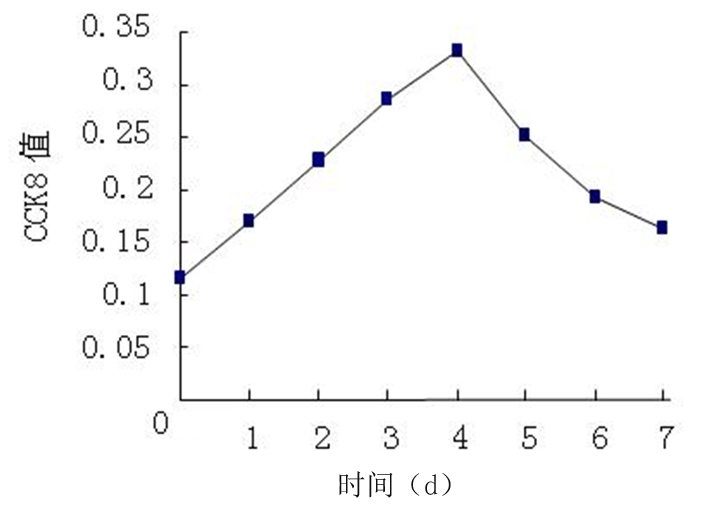
图3 小鼠神经干细胞的生长曲线
Figure 3 The growth curve of mouse NSCs
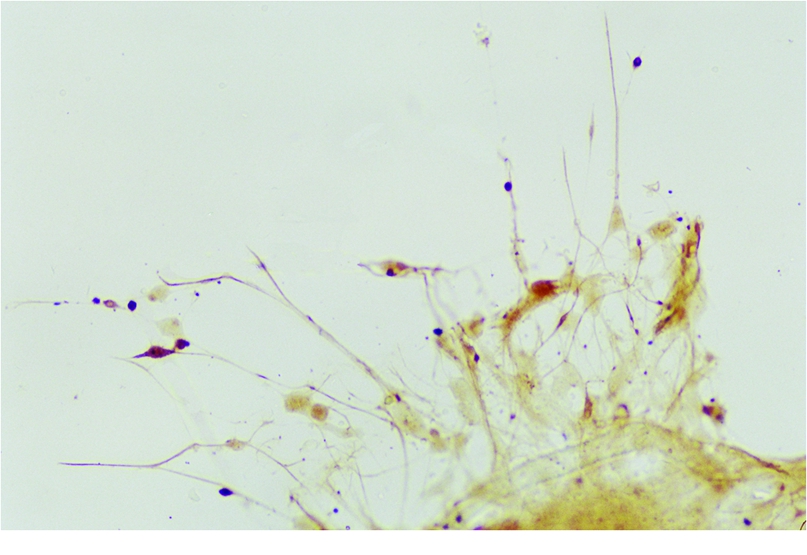
图4 诱导分化后的GFAP阳性细胞( ×200)
Figure 4 GFAP positive cells after neurospheres were induced to differentiation( ×200)
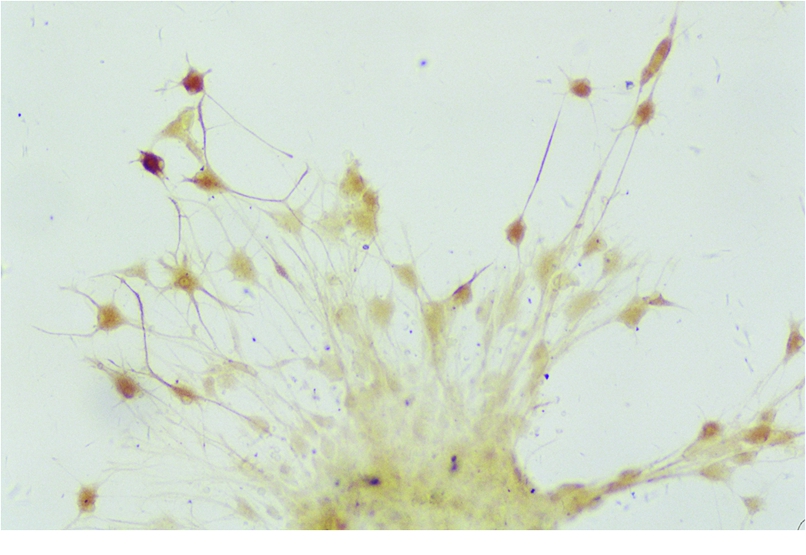
图5 诱导分化后的NSE阳性细胞( ×200)
Figure 5 NSE positive cells after neurospheres were induced to differentiation( ×200)
3 讨 论
NSCs的发现,对于了解神经系统的发生、发育规律、调控机制以及在神经系统疾病和损伤治疗中有了广阔的应用前景。NSCs培养以无血清培养技术[11]为主,目的是去除诱导NSCs分化的成分,同时添加bFGF和(或)EGF,能够促进NSCs的有丝分裂,抑制NSCs分化。这种培养技术也有不足,因为是悬浮培养,所以当神经球逐渐增大到一定程度时,在中心区的细胞出现营养缺乏,导致细胞的凋亡或坏死。本研究结果与上述报道一致,反映细胞增殖状态的Ki67免疫阳性细胞主要位于神经球边缘与培养基充分接触的部位,而神经球内部较少见。
本研究观察到,将NSCs消化为单细胞,接种于用Matrigel铺过底的培养皿中,细胞分散均匀,贴壁迅速,分化同步。在诱导分化后1 d即可呈现出2种细胞类型:一种细胞伸出长而粗的突起,且突起交织成网,构成支架,具备胶质细胞的特征;另一种细胞突起较少,形态多为圆形,推测为正在分化的细胞;也可见具备典型神经元形态的细胞。诱导分化后2 d,具有神经元形态特征的细胞突起进一步生长,交织;胶质细胞突起变得不明显,数量下降,有细胞死亡。诱导后3 d,部分细胞死亡,死亡细胞以胶质细胞为主;具有神经元形态特征的细胞仍可见较长的突起,基本形态仍存在。
NSCs在成年和胚胎脑中都有分布,胚胎脑中的比例远高于成年脑。有报道,NSCs培养中,分离单细胞的方法有酶消化法和机械分离法2种。在神经球传代时,用传统的胰酶消化,不易掌握消化时间,容易造成消化过度或消化效果欠佳。因此,推荐机械分离法,对传代神经球进行切割,但该方法耗时长,并且容易污染。本研究在传代培养时,用Sigma公司推出的专用酶Acutase消化液对神经球进行消化,可将其消化成单细胞,在不损伤细胞膜的前提下,可达到较理想的分离效果。
NSCs具有增殖更新能力和多向分化潜能,巢蛋白为其特征性标记[12-14]。巢蛋白的表达是暂时性的,一旦前体细胞分化成终末分化细胞如神经元或胶质细胞,巢蛋白的表达即终止[15]。本研究所培养的细胞增殖活跃(细胞倍增时间为2 d),经免疫细胞化学染色证实,所培养细胞为nestin阳性细胞,并且可以分化为星形胶质细胞(GFAP是星形胶质细胞特异性标记物,常用作标记星形胶质细胞[16-17])和神经元(NSE阳性细胞[18-19])。因此,可以确定培养的细胞即为NSCs。
[1] Than-Trong E,Ortica-Gatti S,Mella S,et al. Neural stem cell quiescence and stemness are molecularly distinct outputs of the Notch3 signalling cascade in the vertebrate adult brain[J]. Development,2018,145(10):dev161034.
[2] Moore L,Skop NB,Rothbard DE,et al.Tethered growth factors on biocompatible scaffolds improve stemness of cultured rat and human neural stem cells and growth of oligodendrocyte progenitors[J]. Methods,2018,133:54-64.
[3] Labeed FH,Lu J,Mulhall HJ,et al. Biophysical characteristics reveal neural stem cell differentiation potential[J]. PLoS One,2011,6(9):e25458.
[4] Ferent J,Cochard L,Faure H,et al. Genetic activation of Hedgehog signaling unbalances the rate of neural stem cell renewal by increasing symmetric divisions[J].Stem Cell Reports,2014,3(2):312-323.
[5] Fischer U,Backes C,Raslan A,et al. Gene amplification during differentiation of mammalian neural stem cells in vitro and in vivo[J]. Oncotarget,2015,6(9):7023-7039.
[6] 郜峦,王键,程发峰,等.益气活血化痰中药复方对大鼠胚胎神经干细胞生长分化增殖的影响机制研究[J].北京中医药大学学报,2016,39(2):113-118.
[7] 齐辰,王霞.乙醇对胎鼠脑新皮质神经干细胞凋亡的影响[J].环境与健康杂志,2017,34(5):377-381.
[8] Nam SM,Kim JW,Yoo DY,et al. Additive or synergistic effects of aluminum on the reduction of neural stem cells,cell proliferation,and neuroblast differentiation in the dentate gyrus of high-fat diet-fed mice[J]. Biol Trace Elem Res,2014,157(1):51-59.
[9] Lin R,Lang M,Heinsinger N,et al. Stepwise impairment of neural stem cell proliferation and neurogenesis concomitant with disruption of blood-brain barrier in recurrent ischemic stroke[J]. Neurobiol Dis,2018,115:49-58.
[10] Annese T,Corsi P,Ruggieri S,et al. Isolation and characterization of neural stem cells from dystrophic mdx mouse[J]. Exp Cell Res,2016,343(2):190-207.
[11] Li Y,Chopp M. Temporal profile of nestin expression after focal cerebral ischemia in adult rat[J]. Brain Res,1999,838(1/2):1-10.
[12] Yang E,Liu N,Tang Y,et al. Generation of neurospheres from human adipose-derived stem cells[J]. Biomed Res Int,2015,2015:743714.
[13] 罗时珂,廖祥中,谢东明,等.巢蛋白对缺血心肌损伤再修复影响[J].赣南医学院学报,2017,37(2):199-202.
[14] Bernal A,Arranz L. Nestin-expressing progenitor cells:function,identity and therapeutic implications[J]. Cell Mol Life Sci,2018,75(12):2177-2195.
[15] Bern M,Saladino J,Sharp JS.Conversion of methionine into homocysteic acid in heavily oxidized proteomics samples[J]. Rapid Commun Mass Spectrom,2010,24(6):768-772.
[16] Cobb JA,O′Neill K,Milner J,et al. Density of GFAP-immunoreactive astrocytes is decreased in left hippocampi in major depressive disorder[J]. Neuroscience,2016,316:209-220.
[17] Tichy J,Spechtmeyer S,Mittelbronn M,et al. Prospective evaluation of serum glial fibrillary acidic protein(GFAP) as a diagnostic marker for glioblastoma[J]. J Neurooncol,2016,126(2):361-369.
[18] 万丽,易桦林,贝伟剑.C57胚胎小鼠神经干细胞的分离、培养与鉴定[J].广东药学院学报,2014,30(3):354-357.
[19] 郭映辉,李梅,刘新光,等.动态监测血清caspaxe-3和NSE在新生儿缺氧缺血性脑病诊治中的价值[J].河北医科大学学报,2016,37(9):1069-1072.